Страница не найдена
wordmap
Данная страница не найдена или была удалена.
Только что искали:
задумываемые 2 секунды назад
шабашенною 3 секунды назад
зашпаклевывавшийся 7 секунд назад
аади 7 секунд назад
скроено 10 секунд назад
вологодский 11 секунд назад
стетрао 11 секунд назад
металлург 11 секунд назад
высотник 12 секунд назад
залазный 12 секунд назад
лоданов 13 секунд назад
гай 14 секунд назад
наковальня 20 секунд назад
щелочно-устойчивый 21 секунда назад
асапко 21 секунда назад
Последние игры в словабалдучепуху
| Имя | Слово | Угадано | Время | Откуда |
|---|---|---|---|---|
| Игрок 1 | трагикомедия | 161 слово | 3 часа назад | 95.29.167.136 |
| Лерооооой | платинировка | 5 часов назад | 82. 144.87.170 144.87.170 |
|
| Игрок 3 | колесо | 9 слов | 6 часов назад | 212.74.201.62 |
| Игрок 4 | человек | 1 слово | 11 часов назад | 95.153.168.187 |
| Игрок 5 | тубдиспансер | 117 слов | 12 часов назад | 91.132.23.36 |
| Игрок 6 | трагикомедия | 116 слов | 16 часов назад | 91.132.23.36 |
| Игрок 7 | анкилостомоз | 143 слова | 23 часа назад | 95.29.167.89 |
| Играть в Слова! | ||||
| Имя | Слово | Счет | Откуда | |
|---|---|---|---|---|
| Игрок 1 | ночва | 34:35 | 13 минут назад | 176. 98.51.142 98.51.142 |
| Игрок 2 | перун | 51:52 | 39 минут назад | 95.153.179.141 |
| Игрок 3 | сипотца | 22:19 | 46 минут назад | 176.59.198.151 |
| Игрок 4 | посул | 56:53 | 49 минут назад | 95.153.179.141 |
| Игрок 5 | театр | 0:0 | 1 час назад | 217.107.125.15 |
| Игрок 6 | защип | 40:39 | 217.107.125.15 | |
| Игрок 7 | газон | 52:52 | 2 часа назад | 178.35.8.37 |
| Играть в Балду! | ||||
| Имя | Игра | Вопросы | Откуда | |
|---|---|---|---|---|
| Лерооооой | На двоих | 20 вопросов | 5 часов назад | 82. 144.87.170 144.87.170 |
| Я | На одного | 10 вопросов | 7 часов назад | 185.78.36.210 |
| Аа | На одного | 20 вопросов | 9 часов 50 секунд назад | 176.59.109.144 |
| Оппопараог | На одного | 20 вопросов | 9 часов назад | 176.59.109.144 |
| Кэ | На двоих | 10 вопросов | 16 часов назад | 176.59.139.251 |
| Кэ | На двоих | 10 вопросов | 16 часов назад | 176.59.139.251 |
| Кэ | На одного | 10 вопросов | 16 часов назад | 176.59.139.251 |
| Играть в Чепуху! | ||||
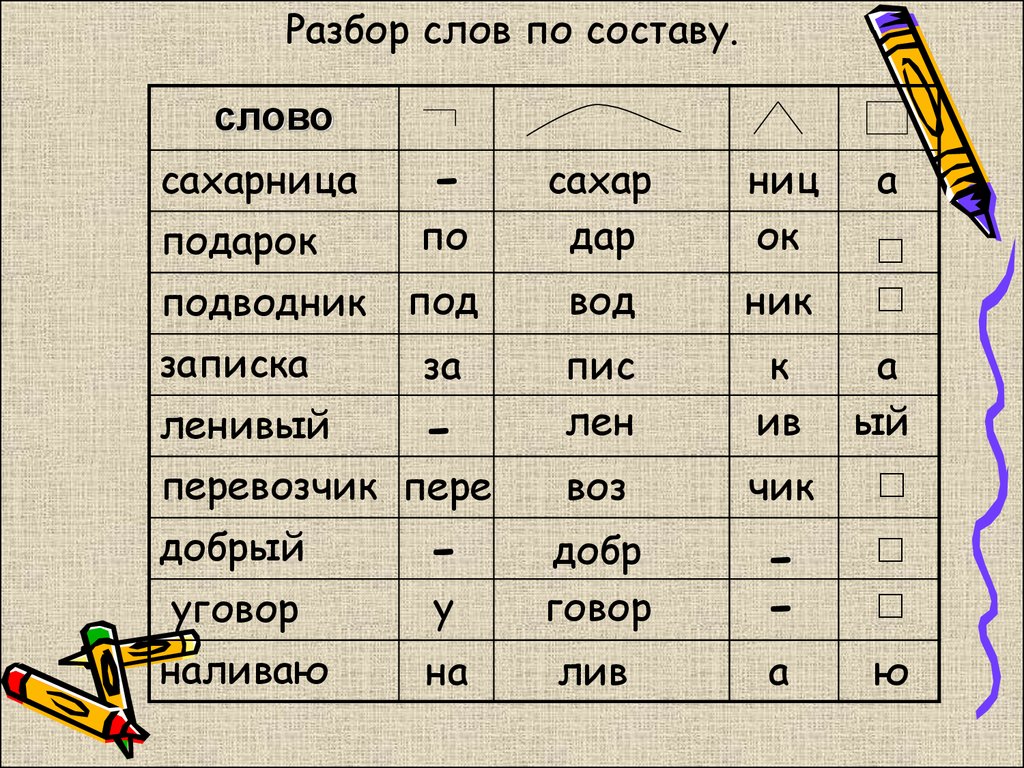
Слова «воспитан» морфологический и фонетический разбор
Объяснение правил деление (разбивки) слова «воспитан» на слоги для переноса.
Онлайн словарь Soosle.ru поможет: фонетический и морфологический разобрать слово «воспитан» по составу, правильно делить на слоги по провилам русского языка, выделить части слова, поставить ударение, укажет значение, синонимы, антонимы и сочетаемость к слову «
Содержимое:
- 1 Слоги в слове «воспитан» деление на слоги
- 2 Как перенести слово «воспитан»
- 3 Синонимы слова «воспитан»
- 4 Ударение в слове «воспитан»
- 5 Фонетическая транскрипция слова «воспитан»
- 6 Фонетический разбор слова «воспитан» на буквы и звуки (Звуко-буквенный)
- 7 Предложения со словом «воспитан»
- 8 Как правильно пишется слово «воспитан»
- 9 Ассоциации к слову «воспитан»
Слоги в слове «воспитан» деление на слоги
Количество слогов: 3
По слогам: во-спи-тан
По правилам школьной программы слово «воспитан» можно поделить на слоги разными способами. Допускается вариативность, то есть все варианты правильные. Например, такой:
Допускается вариативность, то есть все варианты правильные. Например, такой:
По программе института слоги выделяются на основе восходящей звучности:
во-спи-тан
Ниже перечислены виды слогов и объяснено деление с учётом программы института и школ с углублённым изучением русского языка.
с примыкает к этому слогу, а не к предыдущему, так как не является сонорной (непарной звонкой согласной)
Как перенести слово «воспитан»
во—спитан
вос—питан
воспи—тан
Синонимы слова «воспитан»
1. предупредительный
2. почтительный
3. вспоенный
4. благовоспитанный
5. благонравный
6. негрубый
7. выпестованный
8. пестованный
9. поднятый
10. интеллигентный
11.
12. муштрованный
13. выращенный
14. паинька
15. пай-мальчик
16. джентльмен
17. с хорошими манерами
Ударение в слове «воспитан»
воспи́тан — ударение падает на 2-й слог
Фонетическая транскрипция слова «воспитан»
[васп’`итан]
Фонетический разбор слова «воспитан» на буквы и звуки (Звуко-буквенный)
| Буква | Звук | Характеристики звука | Цвет |
|---|---|---|---|
| в | [в] | согласный, звонкий парный, твёрдый, шумный | в |
| о | [а] | гласный, безударный | о |
| с | [с] | согласный, глухой парный, твёрдый, шумный | с |
| п | [п’] | согласный, глухой парный, мягкий, шумный | п |
| и | [`и] | гласный, ударный | и |
| т | [т] | согласный, глухой парный, твёрдый, шумный | т |
| а | [а] | гласный, безударный | а |
| н | [н] | согласный, звонкий непарный (сонорный), твёрдый | н |
Число букв и звуков:
На основе сделанного разбора делаем вывод, что в слове 8 букв и 8 звуков.
Буквы: 3 гласных буквы, 5 согласных букв.
Звуки: 3 гласных звука, 5 согласных звуков.
Предложения со словом «воспитан»
Он заявлял, что был рождён от девы и воспитан
Эдвард Томас, Будда. История и легенды.
Очень жаль, что знакомство с моей новой моделью ничему не научило ни вас, ни вашего помощника, который к тому же так дурно воспитан, что закрывает гостя на ключ.
Евгений Велтистов, Рэсси – неуловимый друг, 1970.
Он вежлив, хорошо воспитан, мало говорит и обладает красивой улыбкой.
Жан Филипп, Зинедин Зидан. Биография, 2017.
Как правильно пишется слово «воспитан»
Правописание слова «воспитан»
Орфография слова «воспитан»
Правильно слово пишется:
Нумерация букв в слове
Номера букв в слове «воспитан» в прямом и обратном порядке:
Ассоциации к слову «воспитан»
Традиция
Строгость
Почитание
Благочестие
Манера
Иезуит
Барышня
Джентльмен
Сирота
Предрассудок
Лона
Вежливость
Выскочка
Деликатность
Учтивость
Православие
Послушание
Счастие
Идеал
Интеллигент
Сдержанность
Мораль
Католик
Вероника
Порядочность
Сверстник
Комсомол
Дух
Хам
Манер
Повиновение
Детство
Леди
Англичанка
Приличие
Грубость
Протестант
Целомудрие
Устой
Патриотизм
Интеллигентный
Образованный
Вежливый
Галантный
Деликатный
Сдержанный
Неглупый
Протестантский
Обаятельный
Чопорный
Учтивый
Обученный
Аристократический
Порядочный
Вульгарный
Послушный
Цивилизованный
Набожный
Рабский
Дисциплинированный
Культурный
Застенчивый
Строгий
Светский
Трудолюбивый
Остроумный
Благородный
Добропорядочный
Добродетельный
Состоятельный
Невежественный
Кроткий
Покладистый
Респектабельный
Неприличный
Скромный
Умный
Элегантный
Грубоватый
Опрятный
Католический
Подобающий
Приветливый
Невежливый
Подобать
Приличествовать
Приучить
Избаловать
Впитать
Вырастить
Дурно
Безукоризненно
Безупречно
Прилично
Хорошо
Скверно
Деликатно
Плохо
Недурно
Тонко
Опубликовано: 2020-11-14
Популярные слова
воспитанник , беседами , взбежавшие , взъерошив , выскребу , высчитанною , вытравлявшей , вячеславом , гемолизом , геннадиевичи , гимнастерочку , домоустройство , завибрируют , завинчивающимся , павлиньего , парабеллумами , парковавшемся , перебираемыми , плакатная , подающее , подлетать , подросту , положительнейшего , помпонах , поохотившимся , пражского , прогульном , прокашливаться , проституируя , противогазовые , развернувшее , разделе , раскрутилось , раскусывают , расторгну , резервированного , реорганизовавшем , респонсорною , сильванер , солея
Структура и организация актиновых филаментов — клетка
Основным белком цитоскелета большинства клеток является актин, который полимеризуется с образованием актиновых филаментов — тонких гибких волокон диаметром примерно 7 нм и длиной до нескольких микрометров (). Внутри клетки актиновые филаменты (также называемые микрофиламентами) организованы в структуры более высокого порядка, образуя пучки или трехмерные сети со свойствами полутвердых гелей. Сборка и разборка актиновых филаментов, их сшивание в пучки и сети и их ассоциация с другими клеточными структурами (такими как плазматическая мембрана) регулируются множеством актин-связывающих белков, которые являются критическими компонентами актинового цитоскелета. Актиновые филаменты особенно многочисленны под плазматической мембраной, где они образуют сеть, обеспечивающую механическую поддержку, определяющую форму клетки и обеспечивающую движение клеточной поверхности, что позволяет клеткам мигрировать, поглощать частицы и делиться.
Внутри клетки актиновые филаменты (также называемые микрофиламентами) организованы в структуры более высокого порядка, образуя пучки или трехмерные сети со свойствами полутвердых гелей. Сборка и разборка актиновых филаментов, их сшивание в пучки и сети и их ассоциация с другими клеточными структурами (такими как плазматическая мембрана) регулируются множеством актин-связывающих белков, которые являются критическими компонентами актинового цитоскелета. Актиновые филаменты особенно многочисленны под плазматической мембраной, где они образуют сеть, обеспечивающую механическую поддержку, определяющую форму клетки и обеспечивающую движение клеточной поверхности, что позволяет клеткам мигрировать, поглощать частицы и делиться.
Рисунок 11.1
Актиновые филаменты. Электронная микрофотография актиновых филаментов. (С любезного разрешения Роджера Крейга, Медицинский центр Массачусетского университета.)
Сборка и разборка актиновых филаментов
Актин был впервые выделен из мышечных клеток, в которых он составляет Считается, что он исключительно участвует в сокращении мышц, но в настоящее время известно, что он является чрезвычайно распространенным белком (обычно от 5 до 10% от общего белка) во всех типах эукариотических клеток. У дрожжей есть только один ген актина, но высшие эукариоты имеют несколько различных типов актина, которые кодируются разными членами семейства генов актина. У млекопитающих, например, есть по крайней мере шесть различных генов актина: четыре экспрессируются в различных типах мышц и два экспрессируются в немышечных клетках. Однако все актины очень похожи по аминокислотной последовательности и сохраняли высокую консервативность на протяжении всей эволюции эукариот. Дрожжевой актин, например, равен 90% идентичны по аминокислотной последовательности актинам клеток млекопитающих.
У дрожжей есть только один ген актина, но высшие эукариоты имеют несколько различных типов актина, которые кодируются разными членами семейства генов актина. У млекопитающих, например, есть по крайней мере шесть различных генов актина: четыре экспрессируются в различных типах мышц и два экспрессируются в немышечных клетках. Однако все актины очень похожи по аминокислотной последовательности и сохраняли высокую консервативность на протяжении всей эволюции эукариот. Дрожжевой актин, например, равен 90% идентичны по аминокислотной последовательности актинам клеток млекопитающих.
Трехмерные структуры как отдельных молекул актина, так и актиновых филаментов были определены в 1990 году Кеннетом Холмсом, Вольфгангом Кабшем и их коллегами. Отдельные молекулы актина представляют собой глобулярные белки из 375 аминокислот (43 кДа). Каждый мономер актина ( глобулярный [G] актин ) имеет сайты тесного связывания, которые опосредуют взаимодействия «голова к хвосту» с двумя другими мономерами актина, поэтому мономеры актина полимеризуются с образованием филаментов 9. 0013 (нитчатый [F] актин ) (). Каждый мономер повернут на 166 o в филаментах, которые поэтому имеют вид двухцепочечной спирали. Поскольку все актиновые мономеры ориентированы в одном направлении, актиновые филаменты имеют четкую полярность, а их концы (называемые плюс-минус-концами) различимы друг от друга. Эта полярность актиновых филаментов важна как для их сборки, так и для установления уникального направления движения миозина относительно актина, как будет обсуждаться далее в этой главе.
0013 (нитчатый [F] актин ) (). Каждый мономер повернут на 166 o в филаментах, которые поэтому имеют вид двухцепочечной спирали. Поскольку все актиновые мономеры ориентированы в одном направлении, актиновые филаменты имеют четкую полярность, а их концы (называемые плюс-минус-концами) различимы друг от друга. Эта полярность актиновых филаментов важна как для их сборки, так и для установления уникального направления движения миозина относительно актина, как будет обсуждаться далее в этой главе.
Рисунок 11.2
Сборка и структура актиновых филаментов. (A) Мономеры актина (G-актин) полимеризуются с образованием актиновых филаментов (F-актин). На первом этапе образуются димеры и тримеры, которые затем растут за счет добавления мономеров к обоим концам. (B) Структура (подробнее…)
Сборка актиновых филаментов может быть изучена in vitro путем регулирования ионной силы растворов актина. В растворах с низкой ионной силой актиновые филаменты деполимеризуются до мономеров. Затем актин спонтанно полимеризуется, если ионная сила увеличивается до физиологического уровня. Первым этапом полимеризации актина (называемым нуклеацией) является образование небольшого агрегата, состоящего из трех мономеров актина. Затем актиновые филаменты могут расти за счет обратимого добавления мономеров к обоим концам, но один конец (плюс-конец) удлиняется в пять-десять раз быстрее, чем минус-конец. Мономеры актина также связывают АТФ, который гидролизуется до АДФ после сборки филамента. Хотя АТФ не требуется для полимеризации, мономеры актина, с которыми связан АТФ, полимеризуются легче, чем те, с которыми связан АДФ. Как обсуждается ниже, связывание и гидролиз АТФ играют ключевую роль в регуляции сборки и динамического поведения актиновых филаментов.
Затем актин спонтанно полимеризуется, если ионная сила увеличивается до физиологического уровня. Первым этапом полимеризации актина (называемым нуклеацией) является образование небольшого агрегата, состоящего из трех мономеров актина. Затем актиновые филаменты могут расти за счет обратимого добавления мономеров к обоим концам, но один конец (плюс-конец) удлиняется в пять-десять раз быстрее, чем минус-конец. Мономеры актина также связывают АТФ, который гидролизуется до АДФ после сборки филамента. Хотя АТФ не требуется для полимеризации, мономеры актина, с которыми связан АТФ, полимеризуются легче, чем те, с которыми связан АДФ. Как обсуждается ниже, связывание и гидролиз АТФ играют ключевую роль в регуляции сборки и динамического поведения актиновых филаментов.
Поскольку полимеризация актина обратима, филаменты могут деполимеризоваться за счет диссоциации субъединиц актина, что позволяет при необходимости разрушать филаменты актина (). Таким образом, между мономерами актина и филаментами существует кажущееся равновесие, которое зависит от концентрации свободных мономеров. Скорость включения мономеров актина в филаменты пропорциональна их концентрации, поэтому существует критическая концентрация мономеров актина, при которой скорость их полимеризации в филаменты равна скорости диссоциации. При этой критической концентрации мономеры и нити находятся в очевидном равновесии.
Скорость включения мономеров актина в филаменты пропорциональна их концентрации, поэтому существует критическая концентрация мономеров актина, при которой скорость их полимеризации в филаменты равна скорости диссоциации. При этой критической концентрации мономеры и нити находятся в очевидном равновесии.
Рисунок 11.3
Обратимая полимеризация мономеров актина. Полимеризация актина представляет собой обратимый процесс, в котором мономеры как связываются с концами актиновых филаментов, так и диссоциируют от них. Скорость диссоциации субъединицы ( k off ) не зависит от концентрации мономера, (подробнее…)
Как отмечалось ранее, два конца актиновой нити растут с разной скоростью, при этом мономеры присоединяются к быстрому -растущего конца (плюсового конца) в пять-десять раз быстрее, чем медленно растущего (минусового) конца. Поскольку АТФ-актин диссоциирует менее легко, чем АДФ-актин, это приводит к разнице в критической концентрации мономеров, необходимых для полимеризации на двух концах. Эта разница может привести к явлению, известному как беговая дорожка , иллюстрирующая динамическое поведение актиновых филаментов (). Чтобы система находилась в общем устойчивом состоянии, концентрация свободных актиновых мономеров должна быть промежуточной между критическими концентрациями, необходимыми для полимеризации на положительном и отрицательном концах актиновых филаментов. В этих условиях происходит чистая потеря мономеров с отрицательного конца, которая уравновешивается чистым добавлением к положительному концу. Беговая дорожка требует АТФ, при этом АТФ-актин полимеризуется на положительном конце филаментов, а АДФ-актин диссоциирует на отрицательном конце. Хотя роль беговой дорожки в клетке неясна, она может отражать динамическую сборку и разборку актиновых филаментов, необходимых клеткам для движения и изменения формы.
Эта разница может привести к явлению, известному как беговая дорожка , иллюстрирующая динамическое поведение актиновых филаментов (). Чтобы система находилась в общем устойчивом состоянии, концентрация свободных актиновых мономеров должна быть промежуточной между критическими концентрациями, необходимыми для полимеризации на положительном и отрицательном концах актиновых филаментов. В этих условиях происходит чистая потеря мономеров с отрицательного конца, которая уравновешивается чистым добавлением к положительному концу. Беговая дорожка требует АТФ, при этом АТФ-актин полимеризуется на положительном конце филаментов, а АДФ-актин диссоциирует на отрицательном конце. Хотя роль беговой дорожки в клетке неясна, она может отражать динамическую сборку и разборку актиновых филаментов, необходимых клеткам для движения и изменения формы.
Рисунок 11.4
Беговая дорожка. Минус-концы актиновых филаментов растут медленнее, чем плюс-концы. Эта разница в скорости роста отражается в разнице в критической концентрации мономеров для добавления к двум концам нити.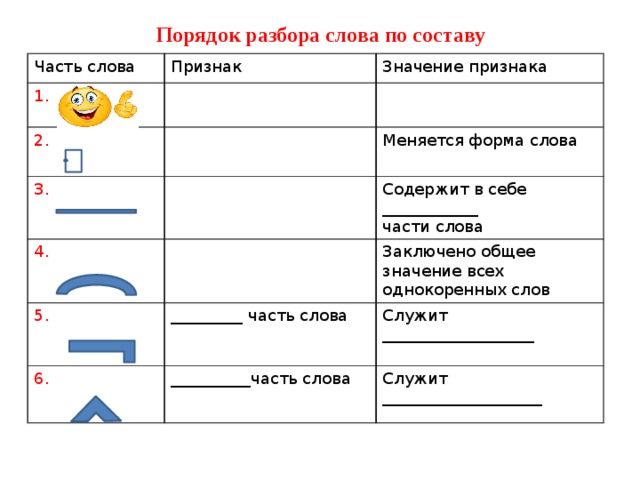 Актин, связанный с АТФ (подробнее…)
Актин, связанный с АТФ (подробнее…)
Следует отметить, что некоторые препараты, используемые в клеточной биологии, действуют путем связывания с актином и воздействия на его полимеризацию. Например, цитохалазины связываются с плюс-концами актиновых филаментов и блокируют их удлинение. Это приводит к изменениям формы клеток, а также к ингибированию некоторых типов клеточных движений (например, клеточного деления после митоза), указывая на то, что для этих процессов необходима полимеризация актина. Другой препарат, фаллоидин, прочно связывается с актиновыми филаментами и препятствует их диссоциации на отдельные актиновые молекулы. Фаллоидин, меченный флуоресцентным красителем, часто используется для визуализации актиновых филаментов с помощью флуоресцентной микроскопии.
Внутри клетки как сборка, так и разборка актиновых филаментов регулируются актин-связывающими белками (). Оборот актиновых филаментов внутри клетки примерно в 100 раз быстрее, чем in vitro , и этот быстрый оборот актина играет критическую роль в различных клеточных движениях. Ключевым белком, ответственным за разборку актиновых филаментов внутри клетки, является cofilin , который связывается с актиновыми филаментами и увеличивает скорость диссоциации актиновых мономеров с минус-конца. Кроме того, кофилин может разрезать актиновые филаменты, генерируя больше концов и дополнительно усиливая разборку филаментов.
Ключевым белком, ответственным за разборку актиновых филаментов внутри клетки, является cofilin , который связывается с актиновыми филаментами и увеличивает скорость диссоциации актиновых мономеров с минус-конца. Кроме того, кофилин может разрезать актиновые филаменты, генерируя больше концов и дополнительно усиливая разборку филаментов.
Рисунок 11.5
Влияние актин-связывающих белков на оборот филаментов. Кофилин связывается с актиновыми филаментами и увеличивает скорость диссоциации мономеров актина (связанных с АДФ) с минус-конца. Кофилин остается связанным с мономерами АДФ-актина, предотвращая их повторную сборку. их реинкорпорация в нити. Однако другой актин-связывающий белок, профилин , может обратить вспять этот эффект кофилина и стимулировать включение мономеров актина в филаменты. Профилин действует, стимулируя обмен связанного АДФ на АТФ, что приводит к образованию мономеров АТФ-актина, которые диссоциируют от кофилина и затем доступны для сборки в филаменты. Другие белки ( Arp2/3 белки ) могут служить сайтами зародышеобразования для инициации сборки новых филаментов, поэтому кофилин, профилин и белки Arp2/3 (а также другие актин-связывающие белки) могут действовать вместе, способствуя образованию новых филаментов. быстрый оборот актиновых филаментов и ремоделирование актинового цитоскелета, что необходимо для различных движений клеток и изменения формы клеток. Как и следовало ожидать, активности белков cofilin, profilin и Arp2/3 контролируются множеством клеточных сигнальных механизмов (обсуждаемых в главе 13), позволяющих должным образом регулировать полимеризацию актина в ответ на стимулы окружающей среды.
Другие белки ( Arp2/3 белки ) могут служить сайтами зародышеобразования для инициации сборки новых филаментов, поэтому кофилин, профилин и белки Arp2/3 (а также другие актин-связывающие белки) могут действовать вместе, способствуя образованию новых филаментов. быстрый оборот актиновых филаментов и ремоделирование актинового цитоскелета, что необходимо для различных движений клеток и изменения формы клеток. Как и следовало ожидать, активности белков cofilin, profilin и Arp2/3 контролируются множеством клеточных сигнальных механизмов (обсуждаемых в главе 13), позволяющих должным образом регулировать полимеризацию актина в ответ на стимулы окружающей среды.
Организация актиновых филаментов
Отдельные актиновые филаменты собраны в два основных типа структур, называемых актиновыми пучками и актиновыми сетями, которые играют разные роли в клетке (). В пучках актиновые филаменты сшиты в плотно упакованные параллельные массивы. В сетях актиновые филаменты слабо сшиты в ортогональные массивы, которые образуют трехмерные сети со свойствами полутвердых гелей. Формирование этих структур регулируется множеством актин-связывающих белков, которые сшивают актиновые филаменты по разным схемам.
Формирование этих структур регулируется множеством актин-связывающих белков, которые сшивают актиновые филаменты по разным схемам.
Рисунок 11.6
Актиновые пучки и сети. (A) Электронная микрофотография пучков актина (стрелки), выступающих из актиновой сети (стрелки), лежащей в основе плазматической мембраны макрофага. Пучки поддерживают выступы клеточной поверхности, называемые микрошипами или филоподиями (см. (подробнее…)
Все актин-связывающие белки, участвующие в сшивании, содержат по крайней мере два домена, которые связывают актин, что позволяет им связывать и сшивать два разных актиновых филамента. Природа ассоциации между этими филаментами затем определяется размером и формой сшивающих белков (см. ).Белки, которые сшивают актиновые филаменты в пучки (наз.0013 связывающие актин белки ) обычно представляют собой небольшие жесткие белки, которые заставляют филаменты плотно прилегать друг к другу. Напротив, белки, которые организуют актиновые филаменты в сети, имеют тенденцию быть большими гибкими белками, которые могут сшивать перпендикулярные филаменты. Эти сшивающие актин белки, по-видимому, представляют собой модульные белки, состоящие из родственных структурных единиц. В частности, актин-связывающие домены многих из этих белков сходны по структуре. Они разделены спейсерными последовательностями, которые различаются по длине и гибкости, и именно эти различия в спейсерных последовательностях ответственны за различные свойства перекрестного связывания различных актин-связывающих белков.
Эти сшивающие актин белки, по-видимому, представляют собой модульные белки, состоящие из родственных структурных единиц. В частности, актин-связывающие домены многих из этих белков сходны по структуре. Они разделены спейсерными последовательностями, которые различаются по длине и гибкости, и именно эти различия в спейсерных последовательностях ответственны за различные свойства перекрестного связывания различных актин-связывающих белков.
Существует два структурно и функционально различных типа пучков актина, включающих разные белки, связывающие актин (). Пучки первого типа, содержащие близко расположенные актиновые филаменты, выстроенные параллельно, поддерживают выступы плазматической мембраны, такие как микроворсинки (см. и ). В этих пучках все филаменты имеют одинаковую полярность, плюс-концы которых прилегают к плазматической мембране. Примером связывающего белка, участвующего в формировании этих структур, является 9.0013 fimbrin , который был впервые выделен из кишечных микроворсинок, а затем обнаружен в поверхностных проекциях самых разных типов клеток.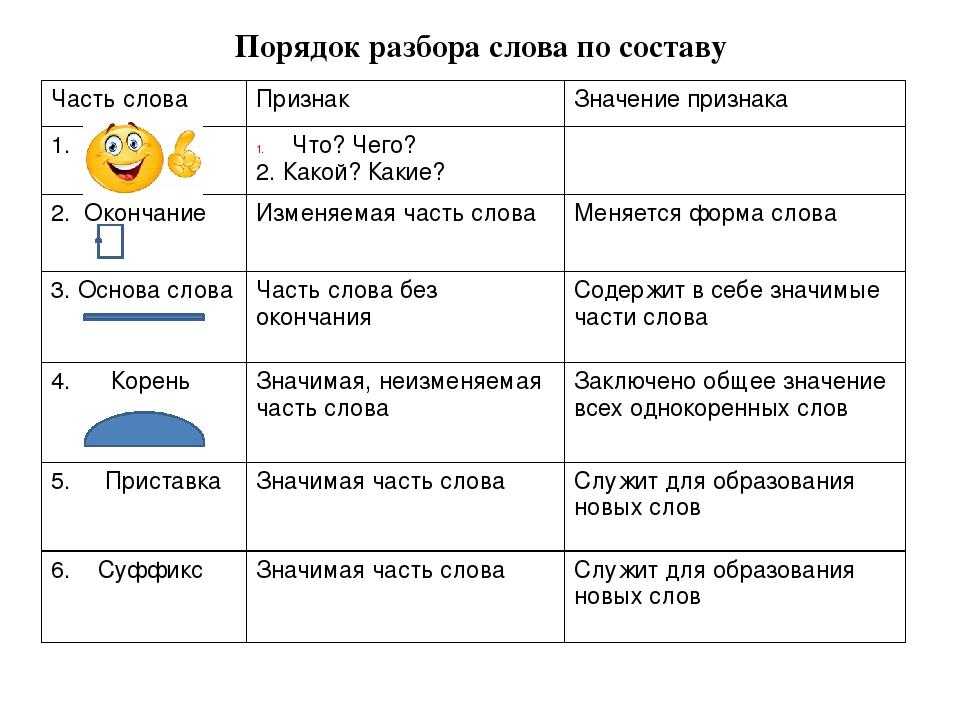 Фимбрин представляет собой белок размером 68 кД, содержащий два смежных актин-связывающих домена. Он связывается с актиновыми филаментами как мономер, удерживая две параллельные филаменты близко друг к другу.
Фимбрин представляет собой белок размером 68 кД, содержащий два смежных актин-связывающих домена. Он связывается с актиновыми филаментами как мономер, удерживая две параллельные филаменты близко друг к другу.
Рисунок 11.7
Белки, связывающие актин. Актиновые филаменты связаны в два типа пучков различными белками, связывающими актин. Фимбрин имеет два смежных актин-связывающих домена (ABD) и сшивает актиновые филаменты в плотно упакованные параллельные пучки, в которых (далее…)
Рисунок 11.15
Электронная микрофотография микроворсинок. Микроворсинки (стрелки) эпителиальных клеток кишечника представляют собой пальцевидные выступы плазматической мембраны. Они поддерживаются пучками актина, закрепленными в плотной области коры, называемой терминальной паутиной. (Fred E. (подробнее…)
Рисунок 11.16
Организация микроворсинок. Коровые актиновые филаменты микроворсинок сшиты в плотно упакованные пучки фимбринами и виллинами. Они прикрепляются к плазматической мембране по своей длине латеральными ответвлениями. , состоящий из миозина I и кальмодулина (далее…)
, состоящий из миозина I и кальмодулина (далее…)
Второй тип актиновых пучков состоит из филаментов, которые расположены более свободно и способны к сокращению, например, актиновые пучки сократительного кольца, которое делит клетки на две части после митоза. Более рыхлая структура этих пучков (которые называются сократительными пучками ) отражает свойства сшивающего белка α-актинина . В отличие от фимбрина, α-актинин связывается с актином в виде димера, каждая субъединица которого представляет собой белок массой 102 кДа, содержащий единственный сайт связывания актина. Следовательно, филаменты, сшитые α-актинином, разделены большим расстоянием, чем сшитые фимбрином (40 нм вместо 14 нм). Увеличенное расстояние между филаментами позволяет моторному белку миозину взаимодействовать с актиновыми филаментами в этих пучках, что (как обсуждается позже) позволяет им сокращаться.
Актиновые филаменты в сетях удерживаются вместе большими актин-связывающими белками, такими как филамин (). Филамин (также называемый актин-связывающим белком или ABP-280) связывает актин в виде димера из двух субъединиц по 280 кДа. Актин-связывающие домены и домены димеризации находятся на противоположных концах каждой субъединицы, поэтому димер филамина представляет собой гибкую V-образную молекулу с актин-связывающими доменами на концах каждого плеча. В результате филамин образует поперечные связи между ортогональными актиновыми филаментами, создавая рыхлую трехмерную сеть. Как обсуждается в следующем разделе, такие сети актиновых филаментов лежат под плазматической мембраной и поддерживают поверхность клетки.
Филамин (также называемый актин-связывающим белком или ABP-280) связывает актин в виде димера из двух субъединиц по 280 кДа. Актин-связывающие домены и домены димеризации находятся на противоположных концах каждой субъединицы, поэтому димер филамина представляет собой гибкую V-образную молекулу с актин-связывающими доменами на концах каждого плеча. В результате филамин образует поперечные связи между ортогональными актиновыми филаментами, создавая рыхлую трехмерную сеть. Как обсуждается в следующем разделе, такие сети актиновых филаментов лежат под плазматической мембраной и поддерживают поверхность клетки.
Рисунок 11.8
Актиновые сети и филамины. Филамин представляет собой димер двух больших (280 кДа) субъединиц, образующих гибкую V-образную молекулу, которая сшивает актиновые филаменты в ортогональные сети. Карбоксиконцевой домен димеризации отделен от аминоконцевого (подробнее…)
Ассоциация актиновых филаментов с плазматической мембраной
Актиновые филаменты сильно сконцентрированы на периферии клетки, где они образуют трехмерную сеть под плазматической мембраной (см. ). Эта сеть актиновых филаментов и связанных с ними актин-связывающих белков (называемая клеточной корой) определяет форму клетки и участвует во множестве действий клеточной поверхности, включая движение. Таким образом, ассоциация актинового цитоскелета с плазматической мембраной играет центральную роль в клеточной структуре и функции.
). Эта сеть актиновых филаментов и связанных с ними актин-связывающих белков (называемая клеточной корой) определяет форму клетки и участвует во множестве действий клеточной поверхности, включая движение. Таким образом, ассоциация актинового цитоскелета с плазматической мембраной играет центральную роль в клеточной структуре и функции.
Красные кровяные тельца (эритроциты) оказались особенно полезными для изучения как плазматической мембраны (обсуждается в следующей главе), так и коркового цитоскелета. Основным преимуществом эритроцитов для этих исследований является то, что они не содержат ядра или внутренних органелл, поэтому их плазматическая мембрана и связанные с ней белки могут быть легко выделены без загрязнения различными внутренними мембранами, которыми изобилуют другие типы клеток. Кроме того, в эритроцитах человека отсутствуют другие компоненты цитоскелета (микротрубочки и промежуточные филаменты), поэтому кортикальный цитоскелет является основным фактором, определяющим их отличительную форму в виде двояковогнутых дисков.
Рисунок 11.9
Морфология эритроцитов. Сканирующая электронная микрофотография эритроцитов, показывающая их двояковогнутую форму. (Omikron/Photo Researchers, Inc.)
Основным белком, составляющим структурную основу кортикального цитоскелета эритроцитов, является актин-связывающий белок спектрин, который родственен филамину (). Спектрин эритроцитов представляет собой тетрамер, состоящий из двух различных полипептидных цепей, называемых α и β, с молекулярной массой 240 и 220 кДа соответственно. Р-цепь имеет один актин-связывающий домен на амино-конце. Цепи α и β связываются латерально, образуя димеры, которые затем соединяются друг с другом, образуя тетрамеры с двумя актин-связывающими доменами, разделенными примерно 200 нм. Затем концы спектриновых тетрамеров связываются с короткими актиновыми филаментами, образуя спектрин-актиновую сеть, которая формирует кортикальный цитоскелет эритроцитов. Основная связь между спектрин-актиновой сетью и плазматической мембраной обеспечивается белком, называемым 9. 0013 анкирин , который связывается как со спектрином, так и с цитоплазматическим доменом распространенного трансмембранного белка, называемого полосой 3. Дополнительная связь между спектрин-актиновой сетью и плазматической мембраной обеспечивается белком 4.1, который связывается со спектрин-актиновыми соединениями как а также узнавание цитоплазматического домена гликофорина (еще одного распространенного трансмембранного белка).
0013 анкирин , который связывается как со спектрином, так и с цитоплазматическим доменом распространенного трансмембранного белка, называемого полосой 3. Дополнительная связь между спектрин-актиновой сетью и плазматической мембраной обеспечивается белком 4.1, который связывается со спектрин-актиновыми соединениями как а также узнавание цитоплазматического домена гликофорина (еще одного распространенного трансмембранного белка).
Рисунок 11.10
Структура спектрина. Спектрин представляет собой тетрамер, состоящий из двух α- и двух β-цепей. Каждая β-цепь имеет один актин-связывающий домен (ABD) на амино-конце. И α-, и β-цепи содержат множественные повторы α-спирали (подробнее…)
Рисунок 11.11
Ассоциация коркового цитоскелета эритроцитов с плазматической мембраной. Плазматическая мембрана связана с сетью тетрамеров спектрина, сшитых короткими актиновыми филаментами в ассоциации с белком 4.1. Спектрин-актиновая сеть связана (подробнее…)
Другие типы клеток содержат связи между корковым цитоскелетом и плазматической мембраной, подобные тем, которые наблюдаются в эритроцитах. Белки, родственные спектрину (неэритроидный спектрин также называют fodrin ), анкирин и белок 4.1 экспрессируются в широком диапазоне типов клеток, где они выполняют функции, аналогичные описанным для эритроцитов. Например, семейство белков, родственных белку 4.1 ( белков ERM ), связывает актиновые филаменты с плазматическими мембранами многих различных типов клеток, а родственный спектрину белок филамин (см. плазматическая мембрана тромбоцитов. Другим представителем этой группы спектриновых белков является 9.0013 дистрофин , представляющий особый интерес, поскольку он является продуктом гена, ответственного за два типа мышечной дистрофии (дистрофию Дюшенна и болезнь Беккера). Эти Х-сцепленные наследственные заболевания приводят к прогрессирующей дегенерации скелетных мышц, и пациенты с более тяжелой формой заболевания (мышечная дистрофия Дюшенна) обычно умирают в подростковом возрасте или в начале двадцатых годов. Молекулярное клонирование гена, ответственного за это заболевание, показало, что он кодирует крупный белок (427 кДа), который либо отсутствует, либо является аномальным у пациентов с мышечной дистрофией Дюшенна или Беккера соответственно.
Белки, родственные спектрину (неэритроидный спектрин также называют fodrin ), анкирин и белок 4.1 экспрессируются в широком диапазоне типов клеток, где они выполняют функции, аналогичные описанным для эритроцитов. Например, семейство белков, родственных белку 4.1 ( белков ERM ), связывает актиновые филаменты с плазматическими мембранами многих различных типов клеток, а родственный спектрину белок филамин (см. плазматическая мембрана тромбоцитов. Другим представителем этой группы спектриновых белков является 9.0013 дистрофин , представляющий особый интерес, поскольку он является продуктом гена, ответственного за два типа мышечной дистрофии (дистрофию Дюшенна и болезнь Беккера). Эти Х-сцепленные наследственные заболевания приводят к прогрессирующей дегенерации скелетных мышц, и пациенты с более тяжелой формой заболевания (мышечная дистрофия Дюшенна) обычно умирают в подростковом возрасте или в начале двадцатых годов. Молекулярное клонирование гена, ответственного за это заболевание, показало, что он кодирует крупный белок (427 кДа), который либо отсутствует, либо является аномальным у пациентов с мышечной дистрофией Дюшенна или Беккера соответственно. Последовательность дистрофина также указывает на то, что он родственен спектрину, с одним актин-связывающим доменом на его амино-конце и мембраносвязывающим доменом на его карбокси-конце. Подобно спектрину, дистрофин образует димеры, которые связывают актиновые филаменты с трансмембранными белками плазматической мембраны мышечной клетки. Эти трансмембранные белки, в свою очередь, связывают цитоскелет с внеклеточным матриксом, который играет важную роль в поддержании стабильности клеток во время мышечного сокращения.
Последовательность дистрофина также указывает на то, что он родственен спектрину, с одним актин-связывающим доменом на его амино-конце и мембраносвязывающим доменом на его карбокси-конце. Подобно спектрину, дистрофин образует димеры, которые связывают актиновые филаменты с трансмембранными белками плазматической мембраны мышечной клетки. Эти трансмембранные белки, в свою очередь, связывают цитоскелет с внеклеточным матриксом, который играет важную роль в поддержании стабильности клеток во время мышечного сокращения.
В отличие от однородной поверхности эритроцитов, большинство клеток имеют специализированные области плазматической мембраны, которые образуют контакты с соседними клетками, тканевыми компонентами или другими субстратами (такими как поверхность чашки для культивирования). Эти области также служат местами прикрепления пучков актиновых филаментов, которые прикрепляют цитоскелет к областям клеточного контакта. Эти прикрепления актиновых филаментов особенно очевидны в фибробластах, поддерживаемых в тканевой культуре. Такие культивируемые фибробласты секретируют белки внеклеточного матрикса (обсуждаемые в главе 12), которые прилипают к пластиковой поверхности чашки для культивирования. Затем фибробласты прикрепляются к культуральной чашке посредством связывания трансмембранных белков (называемых интегринами) с внеклеточным матриксом. Места прикрепления представляют собой отдельные области (называемые фокальными спайками), которые также служат местами прикрепления больших пучков актиновых филаментов, называемых 9.0013 стрессовые волокна .
Такие культивируемые фибробласты секретируют белки внеклеточного матрикса (обсуждаемые в главе 12), которые прилипают к пластиковой поверхности чашки для культивирования. Затем фибробласты прикрепляются к культуральной чашке посредством связывания трансмембранных белков (называемых интегринами) с внеклеточным матриксом. Места прикрепления представляют собой отдельные области (называемые фокальными спайками), которые также служат местами прикрепления больших пучков актиновых филаментов, называемых 9.0013 стрессовые волокна .
Рис. 11.12
Напряженные волокна и фокальные спайки. Флуоресцентная микроскопия фибробластов человека, в которых актиновые филаменты были окрашены флуоресцентным красителем. Стрессовые волокна представляют собой пучки актиновых филаментов, закрепленных в местах прикрепления клеток к (подробнее…)
Стрессовые волокна представляют собой сократительные пучки актиновых филаментов, сшитых α-актинином, которые закрепляют клетку и оказывают натяжение на субстрат . Они прикрепляются к плазматической мембране при фокальных спайках посредством взаимодействия с интегрином. Эти сложные и недостаточно изученные ассоциации могут быть опосредованы несколькими другими белками, в том числе талин и винкулин (). Например, и талин, и α-актинин связываются с цитоплазматическими доменами интегринов. Талин также связывается с винкулином, который, в свою очередь, взаимодействует с актином. Другие белки, обнаруженные в фокальных спайках, могут также участвовать в прикреплении актиновых филаментов, и комбинация этих взаимодействий может отвечать за сцепление актиновых филаментов с плазматической мембраной.
Они прикрепляются к плазматической мембране при фокальных спайках посредством взаимодействия с интегрином. Эти сложные и недостаточно изученные ассоциации могут быть опосредованы несколькими другими белками, в том числе талин и винкулин (). Например, и талин, и α-актинин связываются с цитоплазматическими доменами интегринов. Талин также связывается с винкулином, который, в свою очередь, взаимодействует с актином. Другие белки, обнаруженные в фокальных спайках, могут также участвовать в прикреплении актиновых филаментов, и комбинация этих взаимодействий может отвечать за сцепление актиновых филаментов с плазматической мембраной.
Рисунок 11.13
Прикрепление стрессовых волокон к плазматической мембране при фокальных спайках. Очаговые спайки опосредованы связыванием интегринов с белками внеклеточного матрикса. Стрессовые волокна (пучки актиновых филаментов, сшитых α-актинином) тогда (далее…)
Актиновый цитоскелет аналогичным образом прикрепляется к областям межклеточных контактов, называемым адгезивными соединениями (). В пластах эпителиальных клеток эти соединения образуют непрерывную лентоподобную структуру (называемую адгезивным поясом ) вокруг каждой клетки, в которой нижележащий сократительный пучок актиновых филаментов связан с плазматической мембраной. Контакт между клетками в местах слипчивых соединений обеспечивается трансмембранными белками, называемыми кадгеринами, которые обсуждаются далее в главе 12. Кадгерины образуют комплекс с цитоплазматическими белками, называемыми 9.0013 катенины , которые связаны с актиновыми филаментами.
В пластах эпителиальных клеток эти соединения образуют непрерывную лентоподобную структуру (называемую адгезивным поясом ) вокруг каждой клетки, в которой нижележащий сократительный пучок актиновых филаментов связан с плазматической мембраной. Контакт между клетками в местах слипчивых соединений обеспечивается трансмембранными белками, называемыми кадгеринами, которые обсуждаются далее в главе 12. Кадгерины образуют комплекс с цитоплазматическими белками, называемыми 9.0013 катенины , которые связаны с актиновыми филаментами.
Рисунок 11.14
Прикрепление актиновых филаментов к слипчивым соединениям. Межклеточные контакты в соединениях адгезивов опосредуются кадгеринами, которые служат местами прикрепления пучков актина. В слоях эпителиальных клеток эти соединения образуют непрерывный пояс актина (подробнее…)
Выпячивания клеточной поверхности
Поверхности большинства клеток имеют разнообразные выпячивания или расширения, участвующие в клеточном движении, фагоцитозе, или специализированные функции, такие как поглощение питательных веществ. Большинство этих расширений клеточной поверхности основаны на актиновых филаментах, которые организованы либо в относительно постоянные, либо в быстро перестраивающиеся пучки или сети.
Большинство этих расширений клеточной поверхности основаны на актиновых филаментах, которые организованы либо в относительно постоянные, либо в быстро перестраивающиеся пучки или сети.
Наиболее характерными из этих основанных на актине выпячиваний клеточной поверхности являются микроворсинок, пальцевидных отростков плазматической мембраны, которые особенно многочисленны на поверхности клеток, участвующих в абсорбции, таких как эпителиальные клетки, выстилающие кишечник (). Микроворсинки этих клеток образуют слой на апикальной поверхности (называемый щеточной каймой ), который состоит примерно из тысячи микроворсинок на клетку и увеличивает открытую площадь поверхности, доступную для абсорбции, в 10–20 раз. Помимо их роли в абсорбции, специализированные формы микроворсинок, 9Стереоцилии 0013 слуховых волосковых клеток отвечают за слух, обнаруживая звуковые колебания.
Их обилие и легкость выделения облегчили детальный структурный анализ кишечных микроворсинок, которые содержат плотно упакованные параллельные пучки из 20-30 актиновых филаментов (4). Филаменты в этих пучках частично сшиты фимбрином, белком, связывающим актин (обсуждавшийся ранее), который присутствует в поверхностных выступах различных типов клеток. Однако основным связывающим актин белком микроворсинок кишечника является 9.0013 villin, белок массой 95 кДа, присутствующий в микроворсинках только нескольких специализированных типов клеток, таких как клетки, выстилающие кишечник и почечные канальцы. По своей длине актиновые пучки микроворсинок прикрепляются к плазматической мембране латеральными ответвлениями, состоящими из кальцийсвязывающего белка кальмодулина в ассоциации с миозином I, который может участвовать в движении плазматической мембраны по актиновому пучку микроворсинок. В своей основе актиновые пучки закрепляются в богатой спектрином области актиновой коры, называемой терминальной паутиной, которая сшивает и стабилизирует микроворсинки.
Филаменты в этих пучках частично сшиты фимбрином, белком, связывающим актин (обсуждавшийся ранее), который присутствует в поверхностных выступах различных типов клеток. Однако основным связывающим актин белком микроворсинок кишечника является 9.0013 villin, белок массой 95 кДа, присутствующий в микроворсинках только нескольких специализированных типов клеток, таких как клетки, выстилающие кишечник и почечные канальцы. По своей длине актиновые пучки микроворсинок прикрепляются к плазматической мембране латеральными ответвлениями, состоящими из кальцийсвязывающего белка кальмодулина в ассоциации с миозином I, который может участвовать в движении плазматической мембраны по актиновому пучку микроворсинок. В своей основе актиновые пучки закрепляются в богатой спектрином области актиновой коры, называемой терминальной паутиной, которая сшивает и стабилизирует микроворсинки.
В отличие от микроворсинок, многие поверхностные выпячивания представляют собой временные структуры, формирующиеся в ответ на внешние раздражители. Несколько типов этих структур отходят от переднего края движущейся клетки и участвуют в клеточной локомоции. Псевдоподии представляют собой отростки умеренной ширины, основанные на актиновых филаментах, сшитых в трехмерную сеть, которые отвечают за фагоцитоз и движение амеб по поверхности. Ламеллиподии представляют собой широкие листовидные расширения на переднем крае фибробластов, которые также содержат сеть актиновых филаментов. Многие клетки также расширяют микрошипы или filopodia , тонкие выступы плазматической мембраны, поддерживаемые пучками актина. Формирование и ретракция этих структур основаны на регулируемой сборке и разборке актиновых филаментов, как обсуждается в следующем разделе.
Несколько типов этих структур отходят от переднего края движущейся клетки и участвуют в клеточной локомоции. Псевдоподии представляют собой отростки умеренной ширины, основанные на актиновых филаментах, сшитых в трехмерную сеть, которые отвечают за фагоцитоз и движение амеб по поверхности. Ламеллиподии представляют собой широкие листовидные расширения на переднем крае фибробластов, которые также содержат сеть актиновых филаментов. Многие клетки также расширяют микрошипы или filopodia , тонкие выступы плазматической мембраны, поддерживаемые пучками актина. Формирование и ретракция этих структур основаны на регулируемой сборке и разборке актиновых филаментов, как обсуждается в следующем разделе.
Рисунок 11.17
Примеры выступов клеточной поверхности, участвующих в фагоцитозе и движении. (A) Сканирующая электронная микрофотография, показывающая псевдоподии макрофага, поглощающего опухолевые клетки во время фагоцитоза. (B) Амеба с несколькими расширенными псевдоподиями. (C) Салфетка (далее…)
(C) Салфетка (далее…)
Коробка
Молекулярная медицина: мышечная дистрофия и цитоскелет.
Словарь | Колледж Состав
Введение
Цели обучения
- определить стратегии определения слов из контекста
- определить дополнительные инструменты для определения слов (например, словари)
- определить стратегии сохранения новых слов в рабочем словаре
Английский язык включает более 1 025 000 слов. Средний англоговорящий взрослый имеет рабочий словарный запас около 20 000 слов. Это означает, что у большинства из нас есть около миллиона слов, которые мы потенциально могли бы добавить в свой словарный запас!
Богатый словарный запас делает чтение более осмысленным и приятным, а чтение помогает расширить словарный запас. Однако есть много других способов подобрать слова. Этот модуль включает в себя несколько тактик для расширения вашей силы слова.
Застрял на слове? Получите подсказки… Контекстные подсказки!
Иногда мы неправильно понимаем предложение, потому что оно содержит ключевое слово, которого мы не знаем. Когда это происходит, мы можем попробовать использовать контекстные подсказки или слова вокруг незнакомого слова, чтобы понять его значение. Как мы это делаем? Медленно прочитайте поля ниже.
Когда это происходит, мы можем попробовать использовать контекстные подсказки или слова вокруг незнакомого слова, чтобы понять его значение. Как мы это делаем? Медленно прочитайте поля ниже.
Для занятых взрослых изучение новых слов может показаться пугающим или обескураживающим. Тем не менее, многие люди считают, что изучение значения новых слов и расширение того, что они знают, — это поучительный опыт, который позволяет им лучше понимать идеи мира.
Вы знаете, что означают слова устрашающий и просвещающий ? Если нет, то как вы могли их вычислить? Попробуйте посмотреть на контекстных подсказок — окружающие слова или фразы, которые дают подсказки о значении незнакомого слова. Проверьте объяснение ниже.
Для занятых взрослых изучение новых слов может пугать или обескураживать. Тем не менее, многие люди считают, что изучение значения новых слов и расширение того, что они знают, просвещающий опыт, который делает их более осведомленными об идеях мира.
В первом предложении фраза «или обескураживающий» стоит сразу после пугающий , чтобы объяснить его значение. Другое слово для , обескураживающего , — , обескураживающего .
Как понять, что означает просветление ? Вам могут помочь контекстные подсказки «расширить свои знания» и «больше узнать об идеях мира». Судя по окружающим фразам, просвещающих 902:35 должно означать добавление новых знаний в вашу жизнь.
Словари
Должны ли вы прекратить читать, чтобы найти слова?
Это зависит. Поиск слов замедляет вас, и вы можете понять смысл их контекста без необходимости.
Вы должны решить, насколько важным кажется слово. Вы чувствуете, что упускаете что-то, не зная об этом? Он продолжает появляться? Если вы просто продолжите чтение, слово может проясняться по мере того, как вы его употребляете (в конце концов, именно так мы узнаем значение большинства слов).
Иногда сложно не одно конкретное слово, а их цепочка. Например, когда я прочитал «клиническую депрессию, профессионально оцененную с помощью опросов населения», мне пришлось притормозить. Вникнув в смысл, мне показалось, что «депрессия» — главное слово, на которое нужно обратить внимание, поэтому я его подчеркнул.
Например, когда я прочитал «клиническую депрессию, профессионально оцененную с помощью опросов населения», мне пришлось притормозить. Вникнув в смысл, мне показалось, что «депрессия» — главное слово, на которое нужно обратить внимание, поэтому я его подчеркнул.
Один из способов решить проблему с незнакомыми словами — использовать словарь. Вы можете использовать традиционный печатный словарь, онлайн-словарь или и то, и другое. Печатный словарь легко держать под рукой, где бы вы ни читали. Но онлайн-словарь имеет преимущество, когда дело доходит до быстрого поиска слов, поскольку вы можете искать слово в трех или четырех онлайн-словарях одновременно, чтобы сравнить определения, которые они предлагают.
У вас также есть выбор между использованием общего словаря или специального словаря по предмету, который вы изучаете. Насколько полезными вы найдете их, будет зависеть от вашего предмета, поэтому стоит провести небольшое исследование, чтобы выяснить это. Запишите несколько «трудных» слов из одного из ваших основных учебников.