Слова «раствор» морфологический и фонетический разбор
Объяснение правил деление (разбивки) слова «раствор» на слоги для переноса.
Онлайн словарь Soosle.ru поможет: фонетический и морфологический разобрать слово «раствор» по составу, правильно делить на слоги по провилам русского языка, выделить части слова, поставить ударение, укажет значение, синонимы, антонимы и сочетаемость к слову «раствор».
Содержимое:
- 1 Слоги в слове «раствор»
- 2 Как перенести слово «раствор»
- 3 Морфемный разбор слова «раствор» по составу
- 4 Сходные по морфемному строению слова «раствор»
- 5 Синонимы слова «раствор»
- 6 Ударение в слове «раствор»
- 7 Фонетическая транскрипция слова «раствор»
- 8 Фонетический разбор слова «раствор» на буквы и звуки (Звуко-буквенный)
- 9 Предложения со словом «раствор»
- 10 Сочетаемость слова «раствор»
- 11 Значение слова «раствор»
- 12 Склонение слова «раствор» по подежам
- 13 Как правильно пишется слово «раствор»
Слоги в слове «раствор»
Количество слогов: 2
По слогам: ра-створ
По правилам школьной программы слово «раствор» можно поделить на слоги разными способами. Допускается вариативность, то есть все варианты правильные. Например, такой:
Допускается вариативность, то есть все варианты правильные. Например, такой:
рас-твор
По программе института слоги выделяются на основе восходящей звучности:
ра-створ
Ниже перечислены виды слогов и объяснено деление с учётом программы института и школ с углублённым изучением русского языка.
с примыкает к этому слогу, а не к предыдущему, так как не является сонорной (непарной звонкой согласной)
Как перенести слово «раствор»
ра—створ
рас—твор
раст—вор
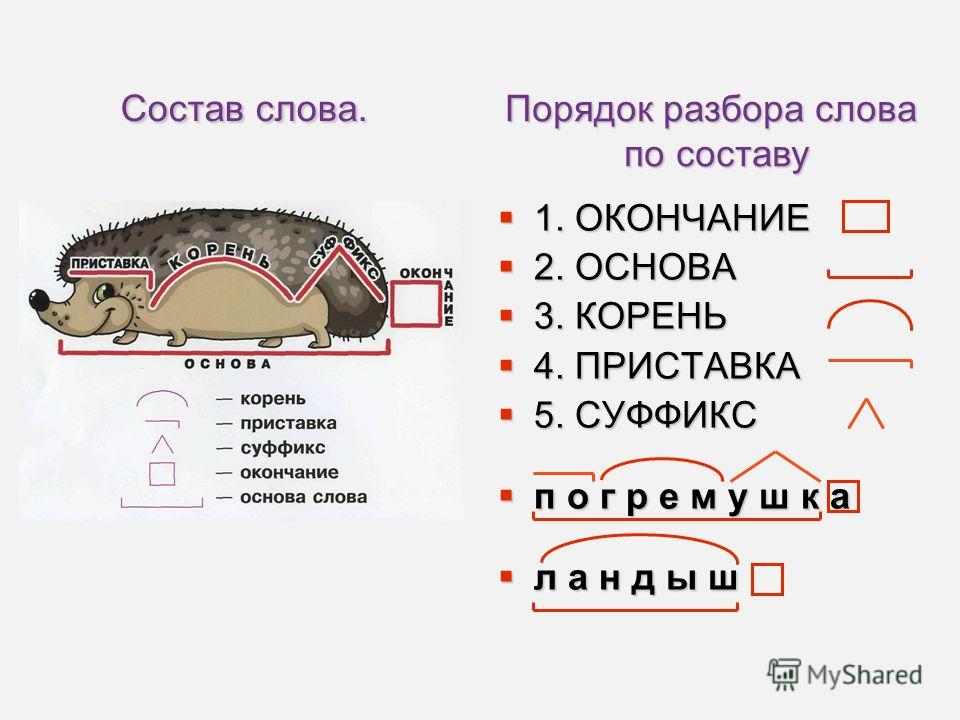
Морфемный разбор слова «раствор» по составу
| раствор | корень |
| ø | нулевое окончание |
раствор
Сходные по морфемному строению слова «раствор»
Сходные по морфемному строению слова
Синонимы слова «раствор»
1. формалин
формалин
2. вираж
3. золь
4. рапа
5. фиксаж
6. фиксатив
7. лизоформ
8. гидрораствор
9. рассол
10. сироп
11. уксус
12. эссенция
13. зольник
14. коллодий
15. угол
16. отверстие
17. жидкость
18. смесь
19. мертель
20. эмульсоид
21. подлив
22. физиораствор
23. состав
24. алкозоль
25. болтушка
26. замесь
Ударение в слове «раствор»
раство́р — ударение падает на 2-й слог
Фонетическая транскрипция слова «раствор»
[раств`ор]
Фонетический разбор слова «раствор» на буквы и звуки (Звуко-буквенный)
| Буква | Звук | Характеристики звука | Цвет |
|---|---|---|---|
| р | [р] | согласный, звонкий непарный (сонорный), твёрдый | р |
| а | [а] | гласный, безударный | а |
| с | [с] | согласный, глухой парный, твёрдый, шумный | с |
| т | [т] | согласный, глухой парный, твёрдый, шумный | т |
| в | [в] | согласный, звонкий парный, твёрдый, шумный | в |
| о | [`о] | гласный, ударный | о |
| р | [р] | согласный, звонкий непарный (сонорный), твёрдый | р |
Число букв и звуков:
На основе сделанного разбора делаем вывод, что в слове 7 букв и 7 звуков.
Буквы: 2 гласных буквы, 5 согласных букв.
Звуки: 2 гласных звука, 5 согласных звуков.
Предложения со словом «раствор»
При низкой кислотности желудка мёд в виде холодного водного раствора (1 ст.
Источник: Иван Дубровин, Все об обычном меде.
Поливы, подкормки слабыми растворами удобрений, лук многоярусный подкармливают жидкими органическими удобрениями: на 10 л воды разводят по 1 ст.
Источник:
При намерении поставить более надёжный бордюр канаву изначально можно выкопать немного глубже, чтобы заложить под бордюрные кирпичи цементный раствор.
Источник: М. С. Жмакин, Дорожки и площадки, бордюры, каменные горки, стенки, ступени из камня, плитки, гравия, гальки на вашем участке, 2012.
Сочетаемость слова «раствор»
1. цементный раствор
2. известковый раствор
3. питательный раствор
4. раствор соли
5. раствор марганцовки
6. раствор глюкозы
7. для приготовления раствора
8. слой раствора
9. состав раствора
10. раствор схватился
11. раствор остынет
12. раствор высохнет
13. залить раствором
14. приготовить раствор
15. использовать раствор
16. (полная таблица сочетаемости)
Значение слова «раствор»
РАСТВО́Р1 , -а, м. 1. Угол, образуемый раздвинутыми ножками циркуля, лезвиями ножниц и т. п. Раствор циркуля.
РАСТВО́Р2 , -а, м. Однородная жидкость, полученная растворением твердого или жидкого вещества в воде или в другой жидкости. Раствор марганца. (Малый академический словарь, МАС)
Склонение слова «раствор» по подежам
| Падеж | Вопрос | Единственное числоЕд. ч. ч. | Множественное числоМн.ч. |
|---|---|---|---|
| ИменительныйИм. | что? | раствор | растворы |
| РодительныйРод. | чего? | раствора | растворов |
| ДательныйДат. | чему? | раствору | растворам |
| ВинительныйВин. | что? | раствор | растворы |
| ТворительныйТв. | чем? | раствором | растворами |
| ПредложныйПред. | о чём? | растворе | растворах |
Как правильно пишется слово «раствор»
Правописание слова «раствор»
Орфография слова «раствор»
Правильно слово пишется: раство́р
Нумерация букв в слове
Номера букв в слове «раствор» в прямом и обратном порядке:
- 7
р
1 - 6
а
2 - 5
с
3 - 4
т
4 - 3
в
5 - 2
о
6 - 1
р
7
Оксиды — что это такое? Химические свойства и классификация
Поможем понять и полюбить химию
Начать учиться
Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э
– химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na+12O, Ca+2O, Ba+2O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al+32O3, Fe2+3O3.

Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S+6O3, N2+5O5, Mn2+7O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
Например:
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».

Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
- SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида | Бытовое (тривиальное название) | Возможное научное название |
|---|---|---|
| H2O | Вода | Оксид водорода |
| CO2 | Углекислый газ | Оксид углерода (IV), диоксид углерода |
| CO | Угарный газ | Оксид углерода (II), монооксид углерода |
| SO3 | Серный газ | Оксид серы (VI), триоксид серы |
| SO2 | Сернистый газ | Оксиды серы (IV), диоксид серы |
| SiO2 | Кварц, горный хрусталь, песок кварцевый, речной и морской | Оксид кремния |
| Al2O3 | Глинозем | Оксид алюминия |
| Fe2O3 | Гематит (крокус) | Оксид железа (III) |
| CaO | Негашеная известь | Оксид кальция |
Химические свойства основных оксидов
1.
 Взаимодействие с водой
Взаимодействие с водойС водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание Например: Na2O + H2O = 2NaOH |
|---|
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль Например: BaO + SO3 = BaSO4 Основный оксид + кислота = соль + вода Например: Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O |
|---|
3.
 Взаимодействие с амфотерными оксидами
Взаимодействие с амфотерными оксидамиВ эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль Например: Na2O + Al2O3 = NaAlO2 |
|---|
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота Например: SO3 + H2O = H2SO4 |
|---|
2.
 Взаимодействие с основными оксидами и щелочами
Взаимодействие с основными оксидами и щелочамиКислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль Например: SO3 + CuO = CuSO4 Кислотный оксид + основание = соль + вода Например: N2O5 + 2NaOH = 2NaNO3 + H2O |
|---|
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль Например: SO3 + Al2O3 = Al2(SO4)3 Кислотный оксид + амфотерный оксид = соль + вода Например: SO3 + Al(OH)3 = Al2(SO4)3 + H2O |
|---|
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠ |
|---|
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль Например: Al2O3 + N2O5 = 2Al(NO3)3 Амфотерный оксид + кислота = соль + вода Например: Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|---|
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль Например: Al2O3 + Na2O = 2NaAlO2 |
|---|
4.
 Взаимодействие со щелочами
Взаимодействие со щелочамиПродукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль Например: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Амфотерный оксид + щелочь (расплав) = средняя соль + вода Например: ZnO + 2KOH = K2ZnO2 + H2O |
|---|
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Например: 4Al + 3O2 = 2Al2O3
Исключение
Не взаимодействуют с кислородом: платина, золото и палладий.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
4Cr + 3O2 = 2Cr2O3
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
4P + 5O2 (избыток) = 2P2O5
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
4P + 3O2 (недостаток) = 2P2O3
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
S + O2 = SO2
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
N2 + O2 = 2NO
Запомнить
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Например:
H2SO3 = SO2↑ + H2O
H2CO3 = CO2↑ + H2O
Ag(OH) = Ag2O + H2O
NH4OH = NH3↑ + H2O
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
Например:
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Например:
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
д.
Например, Li2CO3 = Li2O + CO2↑
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Татьяна Сосновцева
К предыдущей статье
Ковалентные неполярные и полярные связи
К следующей статье
Химические свойства металлов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
РАЗБОРКА | английское значение — Cambridge Dictionary
Охлаждение веретена , разборка и восстановление после нагревания живых яиц человека (аннотация).
Из Кембриджского корпуса английского языка
Эти события включают миграцию шпинделя, разборка микротрубочек, разделение гомологичных хромосом, образование и выдавливание полярного тельца.
Из Кембриджского корпуса английского языка
Однако в некоторых работах также изучались более поздние этапы проектирования, в частности, этап сборки и разборка конструкций.
Из Кембриджского корпуса английского языка
Дело не в том, что такая музыка невосприимчива к механической разборке .
Из Кембриджского корпуса английского языка
Почти невозможно сгенерировать и оценить все последовательности разборки , чтобы найти оптимальную, используя подход на основе графа.
Из Кембриджского корпуса английского языка
С другой стороны, 9Методы 0003 разборки и подходы на основе нейронных сетей могут справиться с более крупными частями, но обычно находят локальные оптимальные решения.
Из Кембриджского корпуса английского языка
Последовательность -разборки невозможна, не говоря уже об оптимальности, если не выполняются некоторые жесткие ограничения, такие как ограничения геометрического приоритета.
Из Кембриджского корпуса английского языка
Во время межпланетного переноса может произойти какая-то разборка , но за ней может последовать сборка по прибытии в менее враждебную экологическую нишу.
Из Кембриджского корпуса английского языка
Актуальность и общий вклад этой статьи в том, что здесь впервые представлен и реализован новый алгоритм муравьиной колонии для выборочной разборки .
Из Кембриджского корпуса английского языка
В процессе муравьи, возможно, находят лучшие последовательности с наименьшим количеством разборка стоимость отнесения к их стохастическим поисковым характеристикам.
Из Кембриджского корпуса английского языка
Цель состоит в том, чтобы свести к минимуму затраты на разборку , связанные с переориентацией продуктов и удалением компонентов для одного или нескольких целевых компонентов.
Из Кембриджского корпуса английского языка
Их система также поддерживает разборку более чем за один шаг.
Из Кембриджского корпуса английского языка
Разборка Генерация последовательности с использованием подхода нейронной сети.
Из Кембриджского корпуса английского языка
Основная цель оборудования на месте для разборки состоит в том, чтобы избежать затрат энергии на транспортировку оборудования во время поэтапного процесса усадки.
Из Кембриджского корпуса английского языка
Потенциальная роль митоген-активируемой протеинкиназы в сборке пронуклеарной оболочки и разборке после оплодотворения яиц мышей.
Из Кембриджского корпуса английского языка
Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Кембриджского словаря, издательства Кембриджского университета или его лицензиаров.
Любые мнения в примерах не отражают мнение редакторов Кембриджского словаря, издательства Кембриджского университета или его лицензиаров.
Разбавления и концентрации – Введение в химию – 1-е канадское издание
Глава 11. Растворы
- Научитесь разбавлять и концентрировать растворы.
Часто рабочему необходимо изменить концентрацию раствора, изменив количество растворителя. Разбавление – это добавление растворителя, который снижает концентрацию растворенного вещества в растворе. Концентрация является удалением растворителя, что увеличивает концентрацию растворенного вещества в растворе. (Не путайте два употребления слова концентрация здесь!)
Как при разбавлении, так и при концентрировании количество растворенного вещества остается неизменным. Это дает нам способ рассчитать, каким должен быть новый объем раствора для желаемой концентрации растворенного вещества. Из определения молярности, которое составляет:
мы можем найти количество молей растворенного вещества:
Более простой способ записи состоит в том, чтобы использовать M для представления молярности и V для представления объема.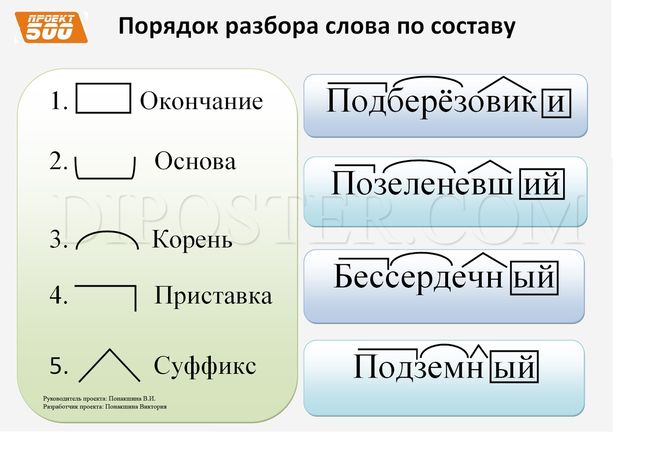 Таким образом, уравнение становится:
Таким образом, уравнение становится:
Поскольку это количество не меняется до и после изменения концентрации, продукт MV должен быть одинаковым до и после изменения концентрации. Используя числа для представления начальных и конечных условий, мы имеем:
как уравнение разбавления . Объемы должны быть выражены в одних и тех же единицах. Обратите внимание, что это уравнение дает только начальные и конечные условия, а не величину изменения. Величина изменения определяется вычитанием.
Если 25,0 мл 2,19 М раствора разбавить до 72,8 мл, какова конечная концентрация?
Решение
Неважно, какой набор условий помечен номером 1 или 2, если условия правильно объединены в пары. Используя уравнение разбавления, мы имеем:
Решение для второй концентрации (учитывая, что единицы миллилитров отменяются):
Концентрация раствора уменьшилась. При переходе от 25,0 мл к 72,8 мл необходимо добавить 72,8 — 25,0 = 47,8 мл растворителя.
Проверь себя
К 0,885 М раствору KBr, начальный объем которого составляет 76,5 мл, добавляют воду до тех пор, пока его концентрация не достигнет 0,500 М. Каков новый объем раствора?
Ответ
135,4 мл
Концентрация растворов включает удаление растворителя. Обычно это делают выпариванием или кипячением, предполагая, что теплота кипения не влияет на растворенное вещество. Уравнение разбавления используется и в этих случаях.
В отделении неотложной помощи больницы врач назначает внутривенное (в/в) введение 100 мл 0,5% KCl пациенту, страдающему гипокалиемией (низкий уровень калия). Помощник бежит к шкафу с припасами и достает пакет для внутривенных вливаний, содержащий эту концентрацию KCl?
Маловероятно. Более вероятно, что ассистент должен сделать правильный раствор из внутривенного пакета стерильного раствора и более концентрированного стерильного раствора, называемого маточным раствором , KCl. Ожидается, что помощник будет использовать шприц, чтобы набрать немного исходного раствора, ввести его в ожидающий пакет для внутривенных вливаний и разбавить его до нужной концентрации. Таким образом, помощник должен выполнить расчет разбавления.
Таким образом, помощник должен выполнить расчет разбавления.
Если исходный раствор содержит 10,0 % KCl, а конечный объем и концентрация должны составлять 100 мл и 0,50 % соответственно, то можно легко рассчитать, сколько исходного раствора следует использовать:
Конечно, добавление исходного раствора влияет на общий объем разбавленного раствора, но конечная концентрация, вероятно, достаточно близка даже для медицинских целей.
Медицинский и фармацевтический персонал постоянно имеет дело с дозировками, требующими измерения концентрации и разбавления. Это важная ответственность: вычисление неправильной дозы может быть бесполезным, вредным или даже смертельным!
- Рассчитайте новую концентрацию или объем для разбавления или концентрации раствора.
- В чем разница между разбавлением и концентрацией?
- Какое количество остается постоянным при разбавлении раствора?
- 1,88 М раствор NaCl имеет начальный объем 34,5 мл.
 Какова конечная концентрация раствора, если его разбавить до 134 мл?
Какова конечная концентрация раствора, если его разбавить до 134 мл? - 0,664 М раствор NaCl имеет начальный объем 2,55 л. Какова конечная концентрация раствора, если его разбавить до 3,88 л?
- Если 1,00 мл 2,25 М H 2 SO 4 раствор необходимо развести до 1,00 М, каков будет его конечный объем?
- Если 12,00 л 6,00 М раствора HNO 3 необходимо разбавить до 0,750 М, каков будет его конечный объем?
- Если 665 мл 0,875 М раствора KBr осторожно кипятят для концентрирования растворенного вещества до 1,45 М, каков будет его конечный объем?
- Если 1,00 л раствора LiOH уварить до 164 мл и его начальная концентрация равна 0,00555 М, какова его конечная концентрация?
- Сколько воды нужно добавить к 75,0 мл 0,332 М FeCl 3 (водн.), чтобы снизить его концентрацию до 0,250 М?
- Сколько воды нужно добавить к 1,55 л 1,65 М Sc(NO 3 ) 3 (водн.), чтобы уменьшить его концентрацию до 1,00 М?
- Разбавление — это уменьшение концентрации раствора, тогда как концентрация — это увеличение концентрации раствора.



 Какова конечная концентрация раствора, если его разбавить до 134 мл?
Какова конечная концентрация раствора, если его разбавить до 134 мл?