Слова «батарейка» морфологический и фонетический разбор
Объяснение правил деление (разбивки) слова «батарейка» на слоги для переноса.
Онлайн словарь Soosle.ru поможет: фонетический и морфологический разобрать слово «батарейка» по составу, правильно делить на слоги по провилам русского языка, выделить части слова, поставить ударение, укажет значение, синонимы, антонимы и сочетаемость к слову «батарейка».
Содержимое:
- 1 Слоги в слове «батарейка» деление на слоги
- 2 Как перенести слово «батарейка»
- 3 Морфологический разбор слова «батарейка»
- 4 Разбор слова «батарейка» по составу
- 5 Сходные по морфемному строению слова «батарейка»
- 6 Синонимы слова «батарейка»
- 7 Ударение в слове «батарейка»
- 8 Фонетическая транскрипция слова «батарейка»
- 9 Фонетический разбор слова «батарейка» на буквы и звуки (Звуко-буквенный)
- 10 Предложения со словом «батарейка»
- 11 Сочетаемость слова «батарейка»
- 12 Значение слова «батарейка»
- 13 Склонение слова «батарейка» по подежам
- 14 Как правильно пишется слово «батарейка»
- 15 Ассоциации к слову «батарейка»
Слоги в слове «батарейка» деление на слоги
Количество слогов: 4
По слогам: ба-та-рей-ка
й всегда примыкает к предшествующей гласной
й — непарная звонкая согласная (сонорная), примыкает к текущему слогу
Как перенести слово «батарейка»
ба—тарейка
бата—рейка
батарей—ка
Морфологический разбор слова «батарейка»
Часть речи:
Имя существительное
Грамматика:
часть речи: имя существительное;
одушевлённость: неодушевлённое;
род: женский;
число: единственное;
падеж: именительный;
отвечает на вопрос: (есть) Что?
Начальная форма:
батарейка
Разбор слова «батарейка» по составу
| батарей | корень |
| к | суффикс |
| а | окончание |
батарейка
Сходные по морфемному строению слова «батарейка»
Сходные по морфемному строению слова
Синонимы слова «батарейка»
1. микробатарейка
микробатарейка
2. батарея
Ударение в слове «батарейка»
батаре́йка — ударение падает на 3-й слог
Фонетическая транскрипция слова «батарейка»
[батар’`эй’ка]
Фонетический разбор слова «батарейка» на буквы и звуки (Звуко-буквенный)
| Буква | Звук | Характеристики звука | Цвет |
|---|---|---|---|
| б | [б] | согласный, звонкий парный, твёрдый, шумный | б |
| а | [а] | гласный, безударный | а |
| т | [т] | согласный, глухой парный, твёрдый, шумный | т |
| а | [а] | гласный, безударный | а |
| р | [р’] | согласный, звонкий непарный (сонорный), мягкий | р |
| е | [`э] | гласный, ударный | е |
| й | [й’] | согласный, звонкий непарный (сонорный), мягкий | й |
| к | [к] | согласный, глухой парный, твёрдый, шумный | к |
| а | [а] | гласный, безударный | а |
Число букв и звуков:
На основе сделанного разбора делаем вывод, что в слове 9 букв и 9 звуков.
Буквы: 4 гласных буквы, 5 согласных букв.
Звуки: 4 гласных звука, 5 согласных звуков.
Предложения со словом «батарейка»
Так что я пишу при свете фонарика, только батарейка
Источник: Жаклин Уилсон, История Трейси Бикер, 1991.
Вы часом не вызываете мастера, чтобы поменять батарейку в электрическом фонарике?
Источник: Д. Н. Колисниченко, Очень хороший самоучитель пользователя компьютером. Как самому устранить 90% неисправностей в компьютере и увеличить его возможности, 2008.
Девушка принялась распаковывать игру — так принято: вставить батарейки, проверить, всё ли работает.
Источник: Ю. Е. Гельман, Зал ожидания (сборник), 2015.
Сочетаемость слова «батарейка»
1. новые батарейки
2. запасные батарейки
3. на солнечных батарейках
4. батарейка села
5. батарейки фонарика
6. заряд батарейки
7. запас батареек
8. пара батареек
9. батарейки сели
10. батарейка разрядилась
11. батарейки кончились
12. работать на батарейках
13. вынуть батарейку
14. вставить батарейки
15. (полная таблица сочетаемости)
Значение слова «батарейка»
БАТАРЕ́ЙКА , -и, род. мн. -ре́ек, дат. -ре́йкам, ж. Уменьш. к батарея (в 3 и 4 знач.). (Малый академический словарь, МАС)
Склонение слова «батарейка» по подежам
| Падеж | Вопрос | Единственное числоЕд.ч. | Множественное числоМн.ч. |
|---|---|---|---|
| ИменительныйИм. | что? | батарейка | батарейки |
РодительныйРод. | чего? | батарейки | батареек |
| ДательныйДат. | чему? | батарейке | батарейкам |
| ВинительныйВин. | что? | батарейку | батарейки |
| ТворительныйТв. | чем? | батарейкой, батарейкою | батарейками |
| ПредложныйПред. | о чём? | батарейке | батарейках |
Как правильно пишется слово «батарейка»
Правописание слова «батарейка»
Орфография слова «батарейка»
Правильно слово пишется: батаре́йка
Нумерация букв в слове
Номера букв в слове «батарейка» в прямом и обратном порядке:
- 9
б
1 - 8
а
2 - 7
т
3 - 6
а
4 - 5
р
5 - 4
е
6 - 3
й
7 - 2
к
8 - 1
а
9
Ассоциации к слову «батарейка»
Фонарик
Аккумулятор
Диктофон
Будильник
Лампочка
Питание
Айя
Комплект
Магнитофон
Мобильник
Фонарь
Розетка
Упаковка
Фотоаппарат
Передатчик
Провод
Индикатор
Крона
Скотч
Кассета
Электричество
Протез
Детектор
Заряд
Видеокамера
Рация
Катушка
Презерватив
Подключение
Взрывчатка
Консервы
Рюкзак
Ток
Пластырь
Ноутбук
Машинка
Пульт
Генератор
Наушник
Бритва
Приставка
Паста
Игрушка
Фен
Устройство
Нажатие
Циферблат
Громкость
Спичка
Выключатель
Экономия
Коробочка
Запасный
Карманный
Портативный
Электрический
Миниатюрный
Слуховой
Игрушечный
Сотовый
Одноразовый
Запасной
Компактный
Мобильный
Плазменный
Атомный
Пластмассовый
Самодельный
Пластиковый
- Дистанционный
Взрывной
Сигнальный
Переносной
Зубной
Электронный
Селить
Экономить
Поберечь
Заряжать
Сдохнуть
Прилагаться
Подсесть
Подключить
Зарядить
Вставлять
Встроить
Разрядить
Вставить
Поменять
Выдохнуться
Иссякнуть
Расходовать
Отключать
Питаться
Садиться
Выключить
Выключать
Сэкономить
Заменить
Сконструировать
Страница не найдена
wordmap
Данная страница не найдена или была удалена.
Только что искали:
несуткляп только что
горько-солёная вода только что
самсун только что
известные личности 1 секунда назад
нитинол 1 секунда назад
дифенил 1 секунда назад
марксистски 1 секунда назад
оформляемая 1 секунда назад
зарезервированную 2 секунды назад
камсу 2 секунды назад
рявкнувшими 2 секунды назад
иаснк 3 секунды назад
шамсуар 3 секунды назад
шамсулхак 3 секунды назад
мамсурова 3 секунды назад
Последние игры в словабалдучепуху
| Имя | Слово | Угадано | Время | Откуда |
|---|---|---|---|---|
| Игрок 1 | гидротурбина | 94 слова | 1 час назад | 91.132.23.36 |
| Игрок 2 | мир | 0 слов | 13 часов назад | 109.252.179.160 |
| Игрок 3 | мир | 0 слов | 13 часов назад | 109. 252.179.160 252.179.160 |
| Катя | устойчивость | 13 слов | 16 часов назад | 128.204.71.104 |
| Катя | лессирование | 47 слов | 17 часов назад | 128.204.71.104 |
| Игрок 6 | подкаблучник | 91 слово | 18 часов назад | 91.132.23.36 |
| Игрок 7 | замок | 0 слов | 18 часов назад | 109.63.140.139 |
| Играть в Слова! | ||||
| Имя | Слово | Счет | Откуда | |
|---|---|---|---|---|
| Игрок 1 | часок | 4:0 | 47 секунд назад | 176.109.36.76 |
| Игрок 2 | пересол | 62:69 | 1 час назад | 5. 141.147.113 141.147.113 |
| Игрок 3 | капор | 20:22 | 1 час назад | 93.170.175.206 |
| Игрок 4 | топик | 50:46 | 3 часа назад | 176.109.36.76 |
| Игрок 5 | влага | 50:51 | 3 часа назад | 176.109.36.76 |
| Игрок 6 | порос | 57:57 | 4 часа назад | 213.234.251.26 |
| Игрок 7 | сатир | 52:49 | 4 часа назад | 213.234.251.26 |
| Играть в Балду! | ||||
| Имя | Игра | Вопросы | Откуда | |
|---|---|---|---|---|
| Ханни | На одного | 10 вопросов | 13 часов 58 секунд назад | 31. 173.87.71 173.87.71 |
| Да | На одного | 10 вопросов | 19 часов назад | 91.122.10.93 |
| Мелжжж | На одного | 20 вопросов | 21 час назад | 188.186.204.15 |
| Ваничкин | На одного | 20 вопросов | 21 час назад | 85.26.232.134 |
| Света | На одного | 10 вопросов | 1 день назад | 95.154.74.80 |
| Оля | На одного | 10 вопросов | 1 день назад | 95.154.74.80 |
| Мария | На двоих | 10 вопросов | 1 день назад | 128.204.64.63 |
| Играть в Чепуху! | ||||
DOE объясняет.
 ..Батареи | Министерство энергетики
..Батареи | Министерство энергетикиОфис Наука
Аккумуляторы и аналогичные устройства принимают, хранят и отдают электроэнергию по требованию. Батареи используют химию в форме химического потенциала для хранения энергии, как и многие другие повседневные источники энергии. Например, бревна и кислород хранят энергию в своих химических связях до тех пор, пока горение не преобразует часть этой химической энергии в тепло. Смеси бензина и кислорода накапливают химическую потенциальную энергию до тех пор, пока она не преобразуется в механическую энергию в двигателе автомобиля. Точно так же, чтобы батареи работали, электричество должно быть преобразовано в форму химического потенциала, прежде чем его можно будет легко хранить. Батареи состоят из двух электрических выводов, называемых катодом и анодом, разделенных химическим материалом, называемым электролитом. Для приема и высвобождения энергии батарея подключается к внешней цепи. Электроны движутся по цепи, в то время как ионы (атомы или молекулы с электрическим зарядом) движутся по электролиту. В перезаряжаемой батарее электроны и ионы могут двигаться в любом направлении по цепи и электролиту. Когда электроны движутся от катода к аноду, они увеличивают химическую потенциальную энергию, тем самым заряжая батарею; когда они движутся в другом направлении, они преобразуют эту химическую потенциальную энергию в электричество в цепи и разряжают батарею. Во время зарядки или разрядки противоположно заряженные ионы перемещаются внутри батареи через электролит, чтобы сбалансировать заряд электронов, движущихся по внешней цепи, и создать устойчивую перезаряжаемую систему. После зарядки батарею можно отключить от цепи, чтобы сохранить химическую потенциальную энергию для последующего использования в качестве электричества.
Электроны движутся по цепи, в то время как ионы (атомы или молекулы с электрическим зарядом) движутся по электролиту. В перезаряжаемой батарее электроны и ионы могут двигаться в любом направлении по цепи и электролиту. Когда электроны движутся от катода к аноду, они увеличивают химическую потенциальную энергию, тем самым заряжая батарею; когда они движутся в другом направлении, они преобразуют эту химическую потенциальную энергию в электричество в цепи и разряжают батарею. Во время зарядки или разрядки противоположно заряженные ионы перемещаются внутри батареи через электролит, чтобы сбалансировать заряд электронов, движущихся по внешней цепи, и создать устойчивую перезаряжаемую систему. После зарядки батарею можно отключить от цепи, чтобы сохранить химическую потенциальную энергию для последующего использования в качестве электричества.
Батарейки были изобретены в 1800 году, но их сложные химические процессы все еще изучаются. Ученые используют новые инструменты, чтобы лучше понять электрические и химические процессы в батареях, чтобы создать новое поколение высокоэффективных накопителей электроэнергии. Например, они разрабатывают улучшенные материалы для анодов, катодов и электролитов в батареях. Ученые изучают процессы в перезаряжаемых батареях, потому что они не полностью меняются местами при зарядке и разрядке батареи. Со временем отсутствие полного реверсирования может изменить химический состав и структуру материалов батареи, что может снизить производительность и безопасность батареи.
Например, они разрабатывают улучшенные материалы для анодов, катодов и электролитов в батареях. Ученые изучают процессы в перезаряжаемых батареях, потому что они не полностью меняются местами при зарядке и разрядке батареи. Со временем отсутствие полного реверсирования может изменить химический состав и структуру материалов батареи, что может снизить производительность и безопасность батареи.
Вклад Управления науки Министерства энергетики США в исследования в области хранения электроэнергии
Исследования, проведенные при поддержке Управления науки Министерства энергетики США, Управления фундаментальных наук об энергетике (BES), привели к значительным улучшениям в области накопления электроэнергии. Но мы все еще далеки от комплексных решений для хранения энергии следующего поколения с использованием совершенно новых материалов, которые могут значительно увеличить количество энергии, которое может хранить батарея. Это хранилище имеет решающее значение для интеграции возобновляемых источников энергии в наше электроснабжение. Поскольку совершенствование аккумуляторных технологий необходимо для широкого использования подключаемых к сети электромобилей, хранение также является ключом к снижению нашей зависимости от нефти в качестве транспорта.
Поскольку совершенствование аккумуляторных технологий необходимо для широкого использования подключаемых к сети электромобилей, хранение также является ключом к снижению нашей зависимости от нефти в качестве транспорта.
BES поддерживает исследования отдельных ученых и междисциплинарных центров. Крупнейшим центром является Объединенный центр исследований в области хранения энергии (JCESR), центр инноваций в области энергетики Министерства энергетики. Этот центр изучает электрохимические материалы и явления на атомном и молекулярном уровне и использует компьютеры для разработки новых материалов. Это новое знание позволит ученым разработать более безопасное хранилище энергии, которое прослужит дольше, быстрее заряжается и имеет большую емкость. По мере того, как ученые, поддерживаемые программой BES, добиваются новых успехов в науке об аккумуляторах, эти достижения используются прикладными исследователями и промышленностью для улучшения приложений в области транспорта, электросетей, связи и безопасности.
Хранение электроэнергии Факты
- Нобелевская премия по химии 2019 года была присуждена совместно Джону Б. Гуденафу, М. Стэнли Уиттингему и Акире Йошино «за разработку литий-ионных аккумуляторов».
- Электролитный геном в JCESR создал вычислительную базу данных с более чем 26 000 молекул, которые можно использовать для расчета основных свойств электролита для новых усовершенствованных аккумуляторов.
Ресурсы и соответствующие термины
- Потребности в фундаментальных исследованиях для хранения электроэнергии следующего поколения Проект материалов
- и геном электролита
- Скрытая архитектура накопителя энергии
- Заглядывая в аккумуляторы: рентгеновские лучи раскрывают тайны литий-ионных аккумуляторов
- Активизация разработки литий-ионных аккумуляторов
- Научное открытие: двоюродный брат поваренной соли может сделать накопление энергии более быстрым и безопасным
Научные термины могут сбивать с толку. Объяснения DOE предлагают простые объяснения ключевых слов и понятий в фундаментальной науке. В нем также описывается, как эти концепции применяются к работе, которую проводит Управление науки Министерства энергетики, помогая Соединенным Штатам преуспеть в исследованиях по всему научному спектру.
Объяснения DOE предлагают простые объяснения ключевых слов и понятий в фундаментальной науке. В нем также описывается, как эти концепции применяются к работе, которую проводит Управление науки Министерства энергетики, помогая Соединенным Штатам преуспеть в исследованиях по всему научному спектру.
Как работает батарея — Любопытно
Представьте себе мир без батареек. Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, если их проткнуть зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons. Вольта, поначалу впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючков, на которых висят лягушки, и другого металла зонда) и просто передается через них, а не через них. из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. ‘ (мера электрического потенциала) названа в его честь.
Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра, да и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Электроды
Чтобы создать поток электронов, вам нужно куда-то, чтобы электроны текли из , и куда-то, чтобы электроны текли в . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.
Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией. Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов из чистого элемента или химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля).
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 подскажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 отдаст свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном является напряжением ячейки.
Итак, если вы возьмете литий и фтор и сумеете соединить их, чтобы сделать элемент батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996).
 .
.Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водный) + e − Li(s) –3,040 Be 2+ (водный) + 2e − Be(s) –1,99 Al 3+ (водн.) + 3e − Al(s) –1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(т) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн.  )
)–0,356 Ni 2+ (водн.) + 2e − Ni(т) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 2909 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.) + 2e − Sn(s) −0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водный) 0,159 AgCl(тв) + e − Ag(тв) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(л) + 4e − 4OH − (водн.  )
)0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(s) + 3H 2 O(l) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.) + 2H 2 O(ж) + 2e − MnO 2 (т) + 90a (3−902) 0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водный) + 4H + + 4e − Se(s) + 3H 2 O(l) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водн.) + e − Ag(s) 0,7996 NO 3 − (водн.  ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1,087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.) + 2H 2 O(л) 1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 CR 2 O 7 2– (AQ) + 14H + (AQ) + 6E — 2CR 3+ (AQ) + 7H 2 9093 (AQ) + 7H 2 2 3+ (AQ) + 7. 2 2 3+ (AQ) + 700168 2 3 (AQ) + 70093 — 2 3+ (AQ) + 70093 — 2 3+ (AQ). 1,36 Cl 2 (г) + 2e − 2Cl − (водн.) 1,396 Се 4+ (водн.  )+е − Се 3+ (водный)
)+е − Се 3+ (водный)1,44 PBO 2 (S) + HSO 4 — (AQ) + 3H + (aq) + 2E — PBSO 4 (S) + 2H 2H 2h) + 2H 2h) + 2H 2h) + 2H 2h) + 2H 2H) + 2H 2H) + 2H 2H) + 2H 2H) + 2H 2H 2H) + 2H — PBSO 4 9019 (S) + 2H 2H) + 2E — PBSO 4 9094 (S) — PBSO 4 (S) — PBSO 4 + 2 1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2е − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, которые реагируют с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого. Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе. Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и, поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств. Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Теперь, если позволить всем ионам, выпущенным в электролит, полностью свободно перемещаться через электролит, они закончат тем, что покроют поверхности электродов и засорят всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации Начать анимацию
При использовании батареи возникает ситуация, при которой происходит непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и дело сделано и запылено. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь.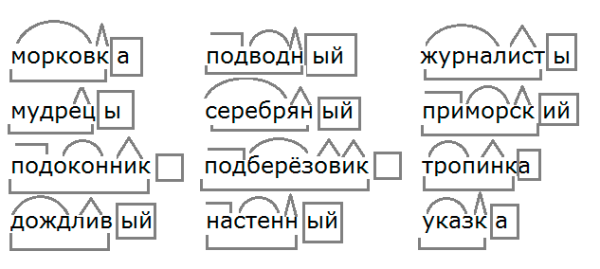 . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
. Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а электроны, которые принял катод, также возвращаются к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально. Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/перезаряжается с высокой скоростью, например, если вы едете на своем электромобиле большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти». Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
Еще один аспект перезаряжаемых батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.
Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.
Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане. Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в элемент батареи.
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах. .
. )
) )
) ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l) )+е − Се 3+ (водный)
)+е − Се 3+ (водный)