Слова «веществ» морфологический и фонетический разбор
Фонетический морфологический и лексический анализ слова «веществ». Объяснение правил грамматики.
Онлайн словарь Soosle.ru поможет: фонетический и морфологический разобрать слово «веществ» по составу, правильно делить на слоги по провилам русского языка, выделить части слова, поставить ударение, укажет значение, синонимы, антонимы и сочетаемость к слову «веществ».
Содержимое:
- 1 Слоги в слове «веществ» деление на слоги
- 2 Как перенести слово «веществ»
- 3 Морфологический разбор слова «веществ»
- 4 Разбор слова «веществ» по составу
- 5 Сходные по морфемному строению слова «веществ»
- 6 Синонимы слова «веществ»
- 7 Ударение в слове «веществ»
- 8 Фонетическая транскрипция слова «веществ»
- 9 Фонетический разбор слова «веществ» на буквы и звуки (Звуко-буквенный)
- 10 Предложения со словом «веществ»
- 11 Сочетаемость слова «веществ»
- 12 Значение слова «веществ»
- 13 Как правильно пишется слово «веществ»
- 14 Ассоциации к слову «веществ»
Слоги в слове «веществ» деление на слоги
Количество слогов: 2
По слогам: ве-ществ
Как перенести слово «веществ»
ве—ществ
Морфологический разбор слова «веществ»
Часть речи:
Имя существительное
Грамматика:
часть речи: имя существительное;
одушевлённость: неодушевлённое;
род: средний;
число: множественное;
падеж: родительный;
отвечает на вопрос: (нет/около) Чего?
Начальная форма:
вещество
Разбор слова «веществ» по составу
| вещ | корень |
| еств | суффикс |
| о | окончание |
вещество
Сходные по морфемному строению слова «веществ»
Сходные по морфемному строению слова
Синонимы слова «веществ»
1. материя
материя
2. фенилон
3. сов
4. субстанция
5. мускон
6. биссус
7. цибетон
8. ацетилхолин
9. налоксон
10. фенилтиомочевина
11. нигари
12. абсорбтив
13. автомутаген
14. адреноблокатор
15. адонидин
16. азарон
17. азибензил
18. алкилбензолсульфонат
19. эритролитмин
20. фенил
21. кумаранон
22. фенетидин
23. анетол
24. медуллин
25. альгарит
26. антифермент
27. антипироген
28. антимутаген
30. отдушка
31. биликсантин
Ударение в слове «веществ»
веще́ств — ударение падает на 2-й слог
Фонетическая транскрипция слова «веществ»
[в’ищ’`эстф]
Фонетический разбор слова «веществ» на буквы и звуки (Звуко-буквенный)
| Буква | Звук | Характеристики звука | Цвет |
|---|---|---|---|
| в | [в’] | согласный, звонкий парный, мягкий | в |
| е | [и] | гласный, безударный | е |
| щ | [щ’] | согласный, глухой непарный, мягкий, шипящий | щ |
| е | [`э] | гласный, ударный | е |
| с | [с] | согласный, глухой парный, твёрдый, шумный | с |
| т | [т] | согласный, глухой парный, твёрдый, шумный | т |
| в | [ф] | согласный, глухой парный, твёрдый, шумный | в |
Число букв и звуков:
На основе сделанного разбора делаем вывод, что в слове 7 букв и 7 звуков.
Буквы: 2 гласных буквы, 5 согласных букв.
Звуки: 2 гласных звука, 5 согласных звуков.
Предложения со словом «веществ»
У папы и мамы обмен веществ активнее, чем у бабушки и дедушки.
Евгений Комаровский, 36 и 6 вопросов о температуре. Как помочь ребенку при повышении температуры тела. Книга для мам и пап, 2008.
В перегное развиваются почвенные бактерии, помогающие растениям усваивать питательные вещества минеральных удобрений.
Максим Жмакин, Всё об удобрении, 2011.
Группа авторов, Чистотел и алоэ. Чудо-целители семьи, 2008.
Сочетаемость слова «веществ»
1. питательные вещества
2. взрывчатые вещества
3. химические вещества
химические вещества
4. вещество мозга
5. вещество тела
6. вещество вселенной
7. обмен веществ
8. количество вещества
9. нарушение обмена веществ
10. содержать вещества
11. состоять из веществ
12. выделять вещества
13. (полная таблица сочетаемости)
Значение слова «веществ»
ВЕЩЕСТВО́ , -а́, ср. Качественная сущность материи; то, из чего состоит физическое тело. Органические вещества. Отравляющие вещества. (Малый академический словарь, МАС)
Как правильно пишется слово «веществ»
Правописание слова «веществ»
Орфография слова «веществ»
Правильно слово пишется:
Нумерация букв в слове
Номера букв в слове «веществ» в прямом и обратном порядке:
Ассоциации к слову «веществ»
Выброс
Витамин
Углерод
Концентрация
Азот
Обмен
Молекула
Кислота
Синтез
Загрязнение
Раствор
Атом
Водород
Организм
Выделение
Поглощение
Электрон
Бактерия
Разложение
Гормон
Примесь
Частица
Кислород
Удобрение
Потребление
Химик
Химия
Волокно
Препарат
Излучение
Кишечник
Свойство
Плазма
Соединение
Компонент
Микроб
Мембрана
Отравление
Накопление
Взаимодействие
Ртуть
Спирт
Очистки
Плотность
Минерал
Распад
Смола
Добавка
Превращение
Употребление
Динамит
Воздействие
Субстанция
Взрывчатый
Питательный
Наркотический
Органический
Радиоактивный
Химический
Неорганический
Кристаллический
Растворимый
Лекарственный
Минеральный
Вредный
Горючий
Мозговой
Растительный
Пахучий
Молекулярный
Пищевой
Эфирный
Атмосферный
Синтетический
Ядовитый
Однородный
Производный
Жидкий
Твёрдый
Физиологический
Связующий
Микроскопический
Мышечный
Безвредный
Маслянистый
Вязкий
Тепловой
Электромагнитный
Отравлять
Растворить
Вырабатывать
Смесить
Выделять
Разлагаться
Стимулировать
Содержаться
Взаимодействовать
Содержать
Накапливаться
Улучшать
Разбор состава косметики: активные вещества, которые действительно работают
Почему один косметический продукт эффективнее другого? Очевидно, дело в составе. Разными могут быть не только ингредиенты, но и их количество, соотношение, а также комбинации.
Разными могут быть не только ингредиенты, но и их количество, соотношение, а также комбинации.
Чтобы проверить состав косметики, не обязательно относить образцы на анализ в лабораторию, достаточно научиться правильно его читать. Так вы поймете, насколько средство безопасно и эффективно.
Есть несколько групп активных веществ в косметике: антиоксиданты, пептиды, гиалуроновая кислота, масла и др. Разберем состав на примере увлажняющего крема-геля для лица DiVina Bellezza MOISTURISING GEL CREAM.
Содержание
АнтиоксидантыВозрастные процессы, воздействие ультрафиолетовых лучей и других неблагоприятных факторов — все это приводит к разрушительному действию свободных радикалов. Каждая клетка кожи состоит из цепочки стабильных молекул с положительным и отрицательным электроном — их количество четное. Такая клетка работает полноценно.
Но есть и «неправильные» молекулы — без одного электрона. Они забирают недостающий электрон у здоровой молекулы, становясь положительными. Патологическому процессу подвержена вся цепочка молекул, возникает цепная реакция.
Патологическому процессу подвержена вся цепочка молекул, возникает цепная реакция.
В нормальных условиях организм справляется с этими процессами и регулирует количество свободных радикалов. Но неблагоприятные факторы могут этому мешать — нехватка кислорода, вредные привычки, солнечные лучи, недостаток полноценного сна. В этом случае количество свободных радикалов увеличивается, а они провоцируют старение кожи.
Антиоксиданты — биологически активные вещества в косметике, которые необходимы для борьбы со свободными радикалами. Они могут быть растительного и животного происхождения. Содержат лишний электрон, что позволяет заместить недостающий в свободном радикале и защитить остальные электроны, таким образом помочь клеткам кожи работать нормально.
Любое средство для борьбы с возрастными изменениями должно содержать антиоксиданты. Так, в креме DiVina Bellezza эту роль выполняет активный комплекс (Wine, Vitis Vinifera Fruit Meristem Cell Culture, Vitis Vinifera (Grape) Leaf Extract), полифенолы, в том числе ресвератрол.
Пептиды улучшают внешний вид кожи, устраняют видимые проявления старения. По сути, это небольшие фрагменты молекул белка — цепочка из определенного количества аминокислот, до 50 аминокислот.
Пептиды могут быть натуральными и синтетическими. Работают они по-разному и решают разные задачи. Например, пептиды протеинов сои подавляют активность ферментов, разрушающих эластин. Сохраняют упругость и используются в косметических продуктах для молодой кожи.
Другие пептиды способствуют разглаживанию кожи — устранению уже имеющихся морщин. Одним из таких пептидов является аргирелин (Acetyl Hexapeptide 8) — субстрат ботулинического токсина. Он уменьшает глубину заломов и эффективен в том числе против мимических морщин.
Гиалуроновая кислотаГиалуроновая кислота — одно из основных активных веществ в косметике. Это увлажнитель, который используется и в продуктах anti-age, и в увлажняющих кремах, эмульсиях, сыворотках.
В составе косметики можно встретить высоко- и низкомолекулярную гиалуроновую кислоту. Первая не проникает в глубокие слои кожи, так как ее молекулы слишком велики. Поэтому она применяется в составе препаратов для инъекций в косметологии.
Первая не проникает в глубокие слои кожи, так как ее молекулы слишком велики. Поэтому она применяется в составе препаратов для инъекций в косметологии.
Низкомолекулярная может присутствовать в следующих формах:
Важно понимать, что это не аналоги, а производные гиалуроновой кислоты, которые работают в глубоких слоях кожи. В увлажняющем крем-геле для лица MOISTURISING GEL CREAM от DiVina Bellezza содержится гиалуронат натрия (Sodium Hyaluronate).
Растительные маслаИстория косметики началась с растительных масел. Они естественны для кожи, потому что похожи по составу с ее липидами. В маслах есть множество активных веществ — витаминов, флавоноидов, органических фруктовых кислот и др. Состав каждого вида масла уникален, и сегодня наиболее популярными являются следующие:
Важно понимать, что использовать масла в чистом виде не рекомендуется. Лучше предпочесть готовый продукт со сбалансированным составом.
В увлажняющем крем-геле для лица MOISTURISING GEL CREAM содержится масло ши (Butyrospermum Parkii (Shea) Butter). Оно является источником комплекса кислот, содержит триглицериды, фитостеролы (каристеролы), что позволяет применять масло в качестве защитного и питательного компонента для кожи лица.
Оно является источником комплекса кислот, содержит триглицериды, фитостеролы (каристеролы), что позволяет применять масло в качестве защитного и питательного компонента для кожи лица.
При разборе состава косметики важно обращать внимание на растительные экстракты — составляющие лекарственных растений, цветов, фруктов. Они используются для решения определенных задач, таких как регулирование работы сальных желез, насыщение кожи витаминами, восстановление здорового цвета лица и пр.
В увлажняющий крем-гель для лица MOISTURISING GEL CREAM от DiVina Bellezza входят экстракты органического красного винограда, ромашки, мальвы, шиповника, цветков календулы (Vitis Vinifera (Grape) Leaf Extract, Chamomilla Recutita (Matricaria) Flower Extract, Malva Sylvestris Extract, Calendula Officinalis Flower Extract).
В основе формулы средства — вино Piemaggio, стволовые клетки винограда и экстракт красного органического винограда. Это обеспечивает антиоксидантный эффект, позволяет стабилизировать коллаген кожи, ускорить процессы ее восстановления.
Уравнения химических реакций: свойства, коэффициенты и схемы
Что такое химические уравнения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
<<Форма демодоступа>>
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
- Соединение.
 Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:
Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:
- Обмен.
 Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
10 вредных компонентов в составе крема: читай этикетку внимательно!
Что добавляют в крем производители, чтобы он лучше пах, легче наносился и дольше хранился? Обращаете ли вы внимание на состав косметики? Чего стоит бояться — названий, цифр или мифов? Как правильно читать состав крема, и чем опасны входящие в него вещества, рассказывает Катерина, косметолог Перфектория.
При чтении состава важно учитывать порядок упоминания ингредиентов. Первое вещество в списке занимает наибольший процент от общего объема. Обычно это вода. Второй компонент занимает не менее 40%, и далее по убыванию. Таким образом дозировка последнего составляющего столь мала, что его влияние на кожу незначительно.
В составе крема встречаются группы веществ, выполняющие разные функции. Среди них текстурообразователи, силиконы, консерванты, ароматизаторы, красители и активные компоненты. Они могут быть полезными, вредными и нейтральными для кожи. Рассмотрим подробнее 10 веществ в косметике, которые входят в различные рейтинги опасных ингредиентов.
Почему эти вещества считаются вредными, в какой концентрации и так ли это на самом деле?
Формалин или формальдегид (Formaldehyde, Formalin, Formic aldehyde, Oxomethane, Oxymethylene)
Недопустимый компонент, применяется только в дешевой косметике. ВОЗ официально признала, что он вызывает онкологические заболевания: формальдегид включен в список канцерогенных веществ (Гигиенические нормативы ГН 1. 1.725-98, под данным сайта «Охрана труда»).
1.725-98, под данным сайта «Охрана труда»).
Парабены (Methylparaben, Ethylparaben, Propylparaben, Butylparaben)
Консерванты, вызывающие аллергию. По данным американских Центров по контролю и предотвращению болезней (Centers for Deasese and Prevention Control), парабены могут накапливаться в организме. Старайтесь избегать этих сомнительных компонентов. По современным стандартам Евросоюза, концентрация парабенов не должна превышать 0,4% (для одного вещества) или 0,8% при использовании нескольких парабенов.
Минеральное масло (Mineral Oil)
Минеральноe масло — продукт нефтепереработки. Из-за своего происхождения в СМИ компонент имеет сомнительную репутацию, однако вредное влияние минеральных масел на кожу научно не подтверждено.
Пропиленгликоль (Methylethylene glycol, Monopropylene glycol, PG 12, Propane-1,2-diol)
Пропиленгликоль – пищевая добавка E1520. В кремах используется как текстурообразователь и безвреден для человека. Только злоупотребление продуктами с E1520 может привести к негативным последствиям.
Алкоголь денатурат (Alcohol Denat.)
Высокая концентрация этого компонента в креме недопустима, если бренд позиционирует себя как производителя гипоаллергенной продукции. Даже 3-7 % спирта может вызывать сухость кожи. Обращайте внимание на содержание алкоголя с денатуратом в составе, если у вас чувствительная кожа.
Силиконы
Чаще всего используются водорастворимый диметикон кополиол (Dimethicone copolyol) и циклометикон (Cyclomethicone), который испаряется с поверхности кожи. Силиконы в составе легко узнать по окончаниям на «-cone», «-conol» и «-siloaxane». Содержание силиконов в уходовой косметике – до 8% процентов – не вызывает негативного эффекта.
Красители
Пигменты необходимы в косметике. Без них кремы выглядели бы, как коричневая или жёлтая жижа, и вряд ли бы вы захотели нанести её на лицо. Но надо помнить, что красители могут провоцировать аллергию. Большинство производителей гипоаллергенной косметики не использует химические пигменты. Они применяют минеральные красители: мелкомолотую горную породу, химически инертную к коже.
Вазелин (Petrolatum)
Используется для увлажнения. СМИ полагают, что вазелин провоцирует рак. На сомнительную репутацию в прессе влияет и факт запрещения вазелина в ЕС. Но по данным FDA, компонент признан безопасным даже в пищевой промышленности.
Тальк (Talc)
В косметологии используется как абсорбент и заполнитель. В 1993 году появилось исследование US National Toxicology Program о связи талька с раком яичников. Но в данных указывается, что опухоли образовывались у крыс, которые вдыхали тальк по 6 часов в день 5 дней неделю на протяжении 113 недель. Последние американские исследования по тальку подтверждают, что он безопасен, когда используется по назначению.
Ацетат алюминия (Aluminum Acetate)
В формулу кремов добавляется в качестве вяжущего средства. При длительном использовании вызывает шелушение кожи.
На самом деле, всё не так страшно. Содержание химических компонентов в кремах строго контролируется. Производители соблюдают международные стандарты производства косметики, регламентирующие их состав. Только после проверок качества и надлежащего содержания различных веществ косметика поступает в продажу. Даже ингредиенты, вызывающие негативные реакции, содержатся в низкой концентрации. Поэтому опасности для здоровья качественная косметика не представляет. В отдельных случаях аллергическую реакцию способен вызвать любой компонент. Обладателям склонной к раздражению кожи косметологи рекомендует гипоаллергенную косметику. Она разрабатывается специально для чувствительной кожи, к ее составу предъявляются еще более жёсткие требования.
Только после проверок качества и надлежащего содержания различных веществ косметика поступает в продажу. Даже ингредиенты, вызывающие негативные реакции, содержатся в низкой концентрации. Поэтому опасности для здоровья качественная косметика не представляет. В отдельных случаях аллергическую реакцию способен вызвать любой компонент. Обладателям склонной к раздражению кожи косметологи рекомендует гипоаллергенную косметику. Она разрабатывается специально для чувствительной кожи, к ее составу предъявляются еще более жёсткие требования.
Итог: из десяти наиболее вредных ингредиентов крема по-настоящему опасными оказались лишь два: формальдегид и парабены. При длительном использовании или большой концентрации в сочетании с чувствительной кожей ущерб могут нанести алкоголь денатурат и ацетат алюминия. Теперь вы знаете, как читать этикетку крема и на что обращать внимание в его составе.
Остерегайтесь сомнительных ингредиентов, выбирайте качественную французскую косметику и не забывайте слова мудрого Парацельса: «Все — яд и все — лекарство; то и другое определяет доза».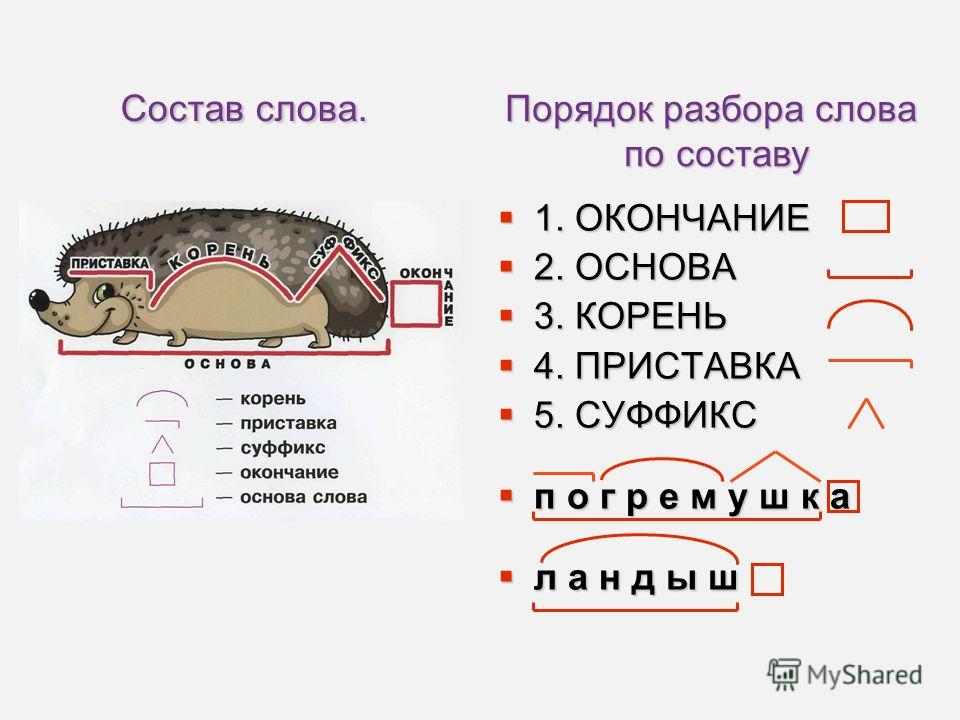
Разбор состава. КРЕМ С ПРЕБИОТИКАМИ «ОБЕРЕЖЕК»
Мыловарня Живица
КРЕМ С ПРЕБИОТИКАМИ «ОБЕРЕЖЕК»
Состав:
Гидролат розмарина,
Вода,
Натуральный увлажняющий фактор (бетаин, NaPCA, сорбитол, комплекс амино-кислот),
Лизат лактобактерий,
Биолин*,
Экстракт кипрея узколистного,
Д-пантенол,
Масло черного тмина нераф.,
Масло лавра нераф.,
Масло чаульмугры нераф.,
Соевый лецитин,
Цитрат серебра,
СО2 экстракты хвои, крапивы, розмарина и тепло наши рук в подарок!
*Имеет органически-сертифицированные компоненты ECOCERT и COSMOS
Состав крема Обережек практически идеален, если не считать цитрата серебра – он может накапливаться в организме. Загрязняет окружающую среду (EPA (U.S. Environmental Protection Agency)). Запрещен стандартом Cosmos, но разрешен Ecocert, ICEA. Поэтому, если вы полностью расшифровываете этикетку и вам важен каждый ингредиент – обратите на это внимание. А мы тем временем проанализируем другие компоненты.
А мы тем временем проанализируем другие компоненты.
Самое интересное и загадочное в составе – НУФ, или Натуральный увлажняющий фактор. Что же в него входит? Во-первых, БЕТАИН. Витаминоподобное вещество бетаин относится к классу аминокислот и является химическим производным аминокислоты глицина. Бетаин представляет собой молекулу глицина с тремя присоединенными к ней метильными группами, на языке химиков это звучит как триметилглицин.
Включение бетаина в состав косметики несет огромную пользу для кожи. Данное вещество действует сразу по нескольким направлениям:
-смягчает,
-заживляет мелкие повреждения эпидермиса,
-снимает раздражение,
-придает коже гладкость и упругость,
-улучшает цвет лица.
Однако самым главным достоинством бетаина в этом случае является его способность поддерживать электролитный баланс в эпидермисе. Удерживая молекулы воды в клетках, и не позволяя им просачиваться через клеточные мембраны, бетаин защищает кожу от пересушивания и преждевременного увядания.
КИСЛОТА ПИРРОЛИДОНКАРБОНОВАЯ (Na — PCA, Sodium PCA, натрия пирролидон карбоксилат) — естественный увлажняющий компонент кожи, который борется со старением. Образуется в клетках в процессе кератинизации из белка филагрина. В косметике используется как увлажняющий ингредиент.
Натрий PCA активно связывает воду в коже, поддерживает оптимальный уровень влажности, увеличивает содержание воды в верхних слоях кожи, извлекает влагу из окружающего воздуха.
При нанесении на кожу всасывается в ограниченной степени. Na-PCA некомедогенен, не раздражает глаза и кожу — даже в концентрациях до 50%, не способствует фототоксичности или сенсибилизации. Он быстро поддается биологическому разложению. Растворимый в воде и этаноле и нерастворимый в маслах, он используется для мощного увлажнения во многих средствах по уходу за кожей и за волосами.
Свойства:
— Смягчает и кондиционирует кожу.
— Обладает водосберегающими свойствами.
— Чрезвычайно гигроскопичен, придает влажность коже
— Предохраняет кожу от потери влаги
— Ускоряет клеточный метаболизм
— Увеличивает сопротивляемость негативным воздействиям окружающей среды
— Восстанавливает водно-липидный баланс
— Повышает естественные защитные свойства кожи
— Обеспечивает здоровый вид кожи
— Увеличивает мягкость и эластичность кожи
СОРБИТОЛ – это вещество сорбит, известное так же как глюцит, относится к классу спиртов, применяется во многих сферах – в пищевой промышленности, медицине, косметике.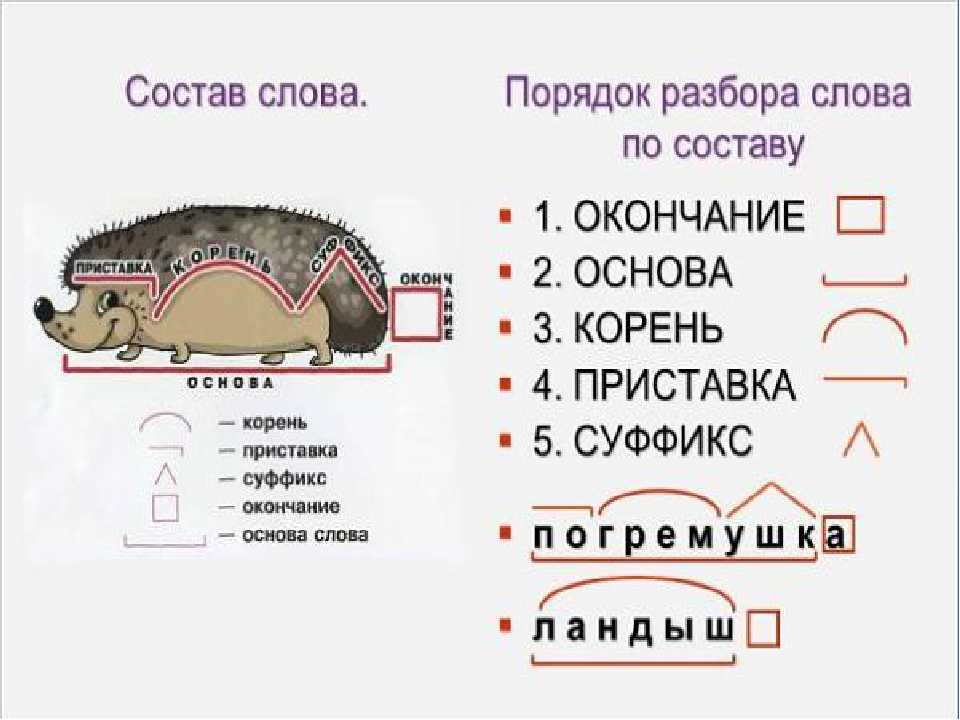 Это вещество получают химическим путем из глюкозы, но и в чистом виде оно встречается в природе, в основном, в водорослях, рябине.
Это вещество получают химическим путем из глюкозы, но и в чистом виде оно встречается в природе, в основном, в водорослях, рябине.
В косметике сорбитол выступает более качественным заменителем глицерина, так как обладает похожими физическими свойствами – сгущает смесь, выступает прозрачной основной и наделен гигроскопичностью. Последнее означает, что сорбитол способен вытягивать влагу из воздуха, не просто не высыхая, но даже становясь более влажным. Большинство косметических средств содержит какой-либо гигроскопичный компонент, иначе они бы высыхали даже стоя в закрытой банке. Чаще всего таким компонентом выступает уже упоминавшийся глицерин как более дешевая добавка, но сорбитол имеет ряд преимуществ: от сладкого вкуса, если его нужно использовать в зубной пасте, до благоприятного воздействия на кожу, если говорить о кремах.
Таким образом, мы видим, что НУФ в данном креме является идеальным сочетанием нескольких сильных и безопасных увлажнителей.
ЛИЗАТЫ ПРОБИОТИЧЕСКИХ КУЛЬТУР:
-Осуществляют мощную биодетоксикацию кожи.
-Оказывают выраженное омолаживающее и лифтинговое действие: повышают способность кожи к процессам репарации и регенерации.
-Нормализуют естественный баланс кожи.
-Восстанавливают иммунитет клеток кожи.
-Способствуют профилактике возрастных изменений.
-Глубоко увлажняют кожу.
-Повышают тонус кожи.
-Усиливают микроциркуляцию.
-Оказывают противоотечное действие.
-Активизируют синтез коллагена.
Растительные экстракты и масла восстанавливают кожный иммунитет, устраняют застойные воспалительные процессы кожи, нормализуют себорегуляцию, проявляют сильную антимикробную активность.
Крем подходит для ухода за молодой кожей, за кожей, склонной к жирности и проблемной
Как и зачем читать этикетку на бытовой химии – 4fresh блог
Любовь Вдовых
Специалист международной и экологической сертификации. Химик, научный сотрудник лаборатории трансдермальных технологий ИНХС РАН, исследователь-изобретатель, автор двух патентов, аспирант.

Изучение состава и заявленных свойств косметических продуктов – привычка полезная. Она может уберечь от появления аллергии, помочь сделать выбор в сторону натурального или органического продукта.
Чтение состава бытовой химии не всегда поможет разобраться в том, что конкретно находится под упаковкой, и безопасно ли средство в целом.
Разобраться, почему это так, и на что действительно стоит обратить внимание на этикетке, нам поможет Любовь Вдовых, наш новый эксперт в категории ДЛЯ ДОМА.
Чего нет на этикетке
В международном стандарте косметики есть четкое определение, что в составе должен быть указан каждый компонент продукта по международной номенклатуре (INCI) на английском или русском языке.
Нормативным документом к товарам бытовой химии является единое санитарное требование Таможенного союза, и в нем нет обязательных условий по тому, как производитель должен указывать состав товаров бытовой химии.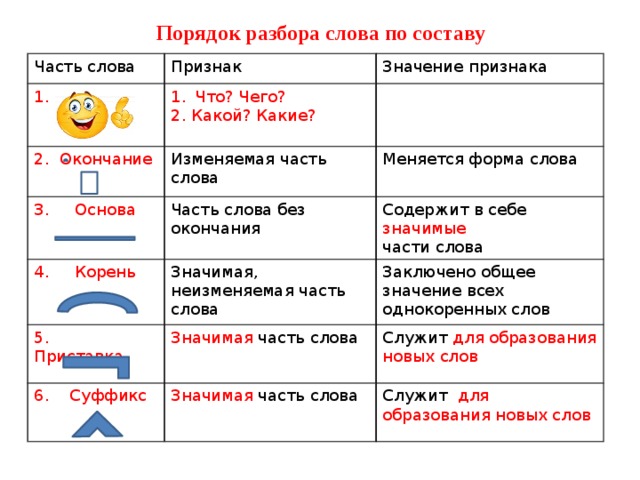 Согласно этому требованию в нем могут быть указаны как отдельные вещества, так и группы веществ с указанием их процентного содержания.
Согласно этому требованию в нем могут быть указаны как отдельные вещества, так и группы веществ с указанием их процентного содержания.
Например, содержание анионных поверхностно-активных веществ (аПАВ) в составе производитель может показать в процентном соотношении. Обычно на этикетке это выглядит вот так:
«Состав: 5% или более, но менее 15%: анионные ПАВ; менее 5 %: неионогенные ПАВ, мыло (соли жирных кислот), отбеливающие вещества на основе кислорода, поликарбоксилаты, фосфонаты, энзимы, оптический отбеливатель, ароматизирующая добавка».
Какие конкретно вещества этой группы входят в состав средства, производитель расшифровывать не обязан. Компоненты, которые не входят в перечень обязательно включаемых, изготовитель может вообще не выносить на этикетку. Размещать на этикетке все компоненты, которые входят в состав, регулятор тоже не запрещает. Любой вариант написания состава соответствует правилам и нарушением не является.
Часто производители продуктов бытовой химии не используют возможность описывать состав полностью, ссылаясь на сохранение коммерческой тайны.
Это не позволяет потребителю самостоятельно провести анализ состава продукта.
Полный перечень ингредиентов знают только производитель и эксперт Роспотребнадзора, который выдает свидетельство государственной регистрации (СГР) — нормативный документ, разрешающий продажу средств бытовой химии на рынке.
Российское законодательство требует, чтобы эксперт при выдаче документов на разрешение регистрации нового продукта оценивал сам состав, сколько именно каждого ингредиента входит в продукт в процентном соотношении и то, как это будет отображаться на этикетке.
Запрещенные и опасные для здоровья человека компоненты не пройдут этот этап. Но вещества, которые при применении продукта могут нанести вред окружающей среде или вызвать раздражение на чувствительной коже, могут входить в состав бытовой химии. Это происходит потому, что моющими средствами предполагается пользоваться в перчатках и респираторе, так непосредственного воздействия на кожу, органы дыхания не происходит.
Это происходит потому, что моющими средствами предполагается пользоваться в перчатках и респираторе, так непосредственного воздействия на кожу, органы дыхания не происходит.
Но часто люди делают уборку без средств защиты и напрямую контактируют с компонентами средств для уборки разных зон дома. Известковый налет, нагар, жирные пятна, загрязнения одежды и разводы на зеркалах убирают ингредиенты различной интенсивности и они могут вызвать раздражение при прямом соприкосновении с кожей. Стоит помнить, что наша кожа гораздо более уязвимее стеклокерамической поверхности плиты, лучше приберечь её для нежных объятий с близкими.
Что читать на этикетке
Хоть состав продукта бытовой химии и не всегда вынесен на этикетку полностью, это не значит, что ее совсем не нужно читать. Стоит обратить внимание на надписи и маркировки, внесенные производителем на упаковку продукта.
В первую очередь это знаки добровольной экосертификации.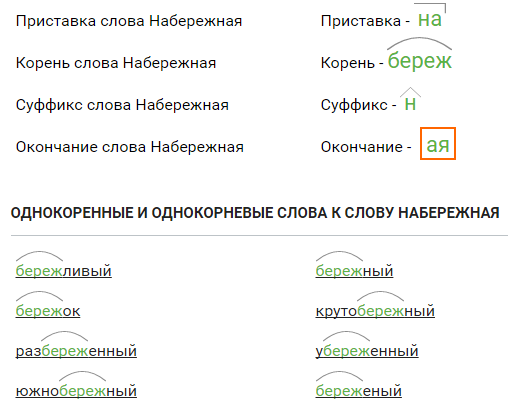 Они говорят о наличии сертификатов и экомаркировок, которые свидетельствуют о том, что бренд прошел добровольную сертификацию продукта в независимых и авторитетных международных экспертных организациях.
Они говорят о наличии сертификатов и экомаркировок, которые свидетельствуют о том, что бренд прошел добровольную сертификацию продукта в независимых и авторитетных международных экспертных организациях.
Запомните эти маркировки:
— российский экосертификат «Листок жизни»
— сертификат итальянского института ICEA;
— европейская экологическая маркировка — EU Ecolabel.
Наличие этих маркировок на этикетке гарантирует безопасность и экологичность средств по жизненному циклу. Специалисты сертификационных органов оценивают порядка сотни критериев согласно строгим критериям стандартов — от происхождения сырьевых компонентов до пригодности упаковки к вторичной переработке. Состав сертифицированных продуктов бытовой химии должен отразить все содержащиеся ингредиенты по международной номенклатуре INCI.
Экосертификация — единственный способ документально подтвердить экологичность и безопасность продукта, отстроиться от недобросовестного зелёного маркетинга — гринвошинга.
Пример.
Биоразлагаемый концентрированный гель для стирки SYNERGETIC PURE. Состав INCI: Aqua, Sodium Laureth Sulfate, Plant-Derived Methyl Ester Sulphonate, Sodium Chloride, Plant-Derived Fatty Ethoxylated Alcohol, Ethoxyl-Propoxyl Terpene, Lauryl Glucoside, Glycerin, Tetrasodium Glutamate Diacetate, Polyvinylpyrrolidone, Sodium Salt of Carboxymethyl Inulin, Bio Polyethyleneglycol Propyleneglycol Oligo Ester, Nonallergic Parfume with Natural Oils, Enzymes (without GMO), Sodium Formate, Sodium Benzoate, Citric Acid.
Продукт имеет международный сертификат ICEA. Наличие сертификата гарантирует регулярные ежегодные аудиты производства и неизменность состава. Специалисты института оценивают эффективность продуктов, запрашивают документы на сырье, проводят проверку производства, подтверждают эффективность и безопасность продуктов.
Бытовая химия может быть безопасной и без наличия международной экомаркировки, потому что ответственный подход закладывается производителем в философию и концепцию на этапе создания бренда.
Продукты, которые не имеют сертификата на сегодняшний день, но при этом безопасные для природы и здоровья человека.
Пятновыводитель экологичный, без запаха 4fresh HOME. Состав: Очищенная вода, 5%-15%: анионные ПАВ на основе кокосового масла, биоразлагаемый комплексообразователь на основе L-глутаминовой кислоты, неионогенные ПАВ на основе кокосового масла и глюкозы; менее 5% консервант (бензоат натрия), консервант (сорбат калия).
Состав продукта биоразлагаемый, растительное происхождение компонентов гарантирует безопасность и мягкость формулы по отношению к природе, человеку и ткани.
Ниже мы приводим названия компонентов, на которые можно ориентироваться, чтобы выбрать безопасные средства для уборки дома.
Cмягчители воды
Цеолиты или поликарбоксилаты
Природные смягчители воды, хорошо вымываются при стирке и не вызывают аллергических реакций.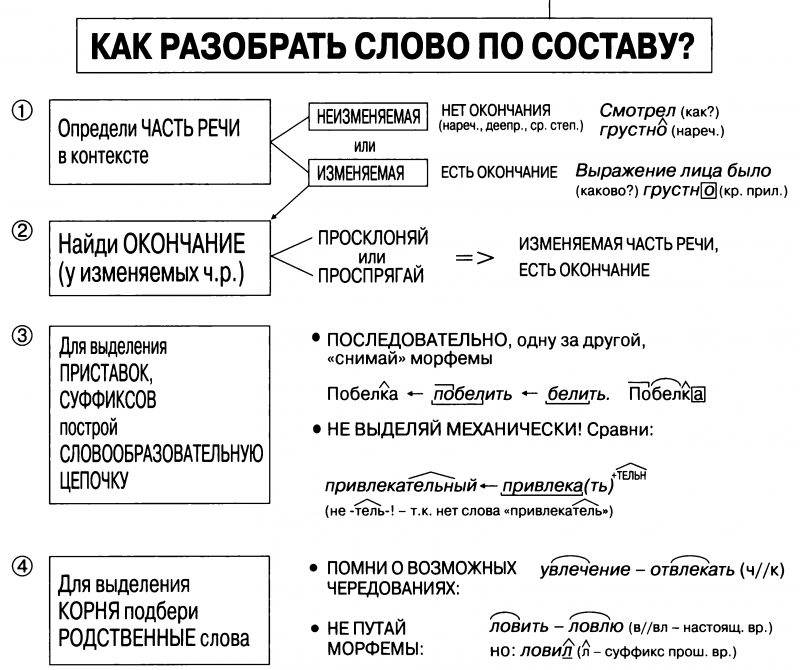 Производятся из песка и соды.
Производятся из песка и соды.
Полифосфаты (фосфаты / фосфонаты)
Содержат фосфор, смягчают воду, при попадании в окружающую среду наносят ей непоправимый вред. В составе средства могут скрываться под такими названиями: дикалий фторфосфат, динатрий фторфосфат, триполифосфат натрия и монофторфосфат кальция.
Дезинфицирующие вещества
Атомарный кислород
Действующее вещество кислородсодержащего отбеливателя. Не раздражает органы дыхания.
Выбирайте чистящие средства на основе соды, четвертично-аммониевых соединений, третичных аминов, альдегидов или полигуанидов.
Хлор
В составе бытовой химии опасен, может накапливаться в жировых тканях организма, вызывать раздражения кожи и органов дыхания.
Токсичные вещества в составе бытовой химии
Аммиак: часто используют в средствах для мытья стекол.
Формальдегид: может содержаться в средствах для мытья посуду и чистки ковров.
Бутилгликоль: содержится в растворителях, может скрываться под названиями 2-бутоксиэтанол, бутилцеллозольв, монобутиловый эфир этиленгликоля, бутилэфир.
О чем ещё расскажет этикетка
Этикетка — один из способов производителя пообщаться с покупателем и донести нужную информацию. Здесь он оставляет рекомендации о том, как правильно использовать продукт, чтобы не навредить себе, не испортить вещи или поверхности в доме.
Если производитель рекомендует пользоваться средством в перчатках — это не значит, что в составе обязательно присутствуют небезопасные ингредиенты. Иногда это растительные кислоты и щелочи, которые помогают справиться с загрязнениями в доме, но при длительном контакте с кожей могут приводить к раздражению.
Если производитель пишет на порошке, что он подходит только для белого, не стоит пробовать стирать им цветные ткани, они могут потерять цвет или покрыться пятнами.
Средства для плитки не стоит использовать на деревянных поверхностях.
Соблюдайте требования инструкции, не пытайтесь использовать больше порошка или средства для мытья полов. Производитель выносит рекомендации исходя из испытаний и концентрации активных веществ в составе продукта: и малое, и большее количество продукта может не дать нужный эффект.
Самые лучшие и самые эффективные средства уже на сайте — выбирайте здесь!
#Экодом
#ТОПы
Подписка
Полезные рассылки у вас на почте. Осталось только подписаться
Обработка данных при подписке
Читайте по теме
Экодом
Ни капли больше: 4 совета для экономии воды
Экодом
ТОП-10 натуральных кондиционеров для белья
События
Почему мусоросжигание не решит проблему мусора?
Экодом
Почему пора перейти на экологичные стиральные порошки?
Как анализировать химический состав?
Биомолекулы можно определить как углеродсодержащие интенсификаторы, имеющиеся как в живых, так и в неживых существах. Они занимаются поддержкой и метаболическими циклами живых существ. Усиливается каждый из компонентов, имеющихся в составе каждого живого животного. Биомолекулы — это спящие и сложные природные частицы, которые встречаются совершенно недвусмысленным образом, чтобы создать новую жизнь или наблюдать за естественными событиями. Углеводы, липиды, нуклеиновые кислоты и белки являются примерами биомолекул. Биосфера Земли включает в себя необычайный набор доступных живых видов. Все живые существа состоят из клеток, в зависимости от того, формирует ли клетка материю, предметы вокруг нас устроены как живые или неживые. Неорганические и природные вещества существуют вместе в клетке. Углерод, водород, кислород и другие компоненты можно извлечь из растительной ткани, ткани живого существа или микробной пасты. Как показывает оценка неживой материи, кусок камня создает смесь неразличимых смесей. На основе химического анализа мы можем отследить химический состав биомолекул.
Они занимаются поддержкой и метаболическими циклами живых существ. Усиливается каждый из компонентов, имеющихся в составе каждого живого животного. Биомолекулы — это спящие и сложные природные частицы, которые встречаются совершенно недвусмысленным образом, чтобы создать новую жизнь или наблюдать за естественными событиями. Углеводы, липиды, нуклеиновые кислоты и белки являются примерами биомолекул. Биосфера Земли включает в себя необычайный набор доступных живых видов. Все живые существа состоят из клеток, в зависимости от того, формирует ли клетка материю, предметы вокруг нас устроены как живые или неживые. Неорганические и природные вещества существуют вместе в клетке. Углерод, водород, кислород и другие компоненты можно извлечь из растительной ткани, ткани живого существа или микробной пасты. Как показывает оценка неживой материи, кусок камня создает смесь неразличимых смесей. На основе химического анализа мы можем отследить химический состав биомолекул.
Важность и необходимость анализа
Аналитические методы дают данные в отношении различных смесей как органических, так и неорганических веществ. Клетка показывает, что она состоит из различных компонентов, таких как углерод, водород, кислород, хлор и так далее. Приведите данные об их молекулярной формуле и структуре. Кроме того, они помогают нам изолировать и очищать одно соединение от другого. Все соединения углерода, которые мы получаем из живых тканей, называются биомолекулами.
Клетка показывает, что она состоит из различных компонентов, таких как углерод, водород, кислород, хлор и так далее. Приведите данные об их молекулярной формуле и структуре. Кроме того, они помогают нам изолировать и очищать одно соединение от другого. Все соединения углерода, которые мы получаем из живых тканей, называются биомолекулами.
Как анализировать химический состав биомолекулы
Анализ органических соединений
Возьмите кусок живой ткани, затем растолките и смешайте его с кислотой. После его фильтрации получаем два бита. Часть, полученная в виде фильтрата, является кислоторастворимой частью. В то время как другая часть нерастворима в кислоте, которая удерживает пленку канала. Это показывает, что внутри тканей есть как минимум две смеси, обладающие разными свойствами.
Анализ неорганического соединения
Возьмите еще один кусок ткани и сожгите его. Когда вся вода в нем испарится. Получаем сухую массу. Благодаря этому процессу все углеродные смеси будут окисляться при потреблении. Оставшийся мусор дает нам неорганические соединения, такие как кальций, магний, сульфат, фосфат и т. д. в тканях.
Оставшийся мусор дает нам неорганические соединения, такие как кальций, магний, сульфат, фосфат и т. д. в тканях.
Часто задаваемые вопросы о химическом составе
Вопрос 1: Что такое химический анализ в биологии?
Ответ:
Химический анализ – это изучение химического состава и строения вещества. Проверка компонентов и смесей, содержащихся в образце малоизвестного материала, известна как качественный анализ. Количественное исследование решает, сколько каждого компонента или соединения присутствует по весу.
Вопрос 2: Что означает биологическая молекула?
Ответ:
Биомолекула, также известная как биологическая молекула, представляет собой любую из многих смесей, образуемых клетками и живыми животными. Биомолекулы бывают самых разных форм и размеров, и они реализуют различные возможности. Биомолекулы делятся на четыре класса: углеводы, липиды, нуклеиновые кислоты и белки.
Вопрос 3: Что такое биомикромолекулы?
Ответ:
Биомикромолекулы — это малоизмеримые простые химические вещества, которые имеют малую субатомную массу, более высокую растворимость и базовую податливость. Они могут быть природными или неорганическими и включать минералы, сахара, аминокислоты и нуклеотиды.
Вопрос 4: На каком уровне начинается биологическая организация?
Ответ:
Биологическая организация начинается на сверхмалом молекулярном уровне, где четыре вида частиц, т. е. углеводы, липиды, белки и нуклеиновые кислоты, координируются в органеллы клетки. Следовательно, биологическая ассоциация начинается на субмикроскопическом молекулярном уровне.
Вопрос 5: Что такое биомакромолекулы?
Ответ:
Биомакромолекулы представляют собой огромные сложные химические вещества.
Биомакромолекулы имеют большой субатомный вес и низкую растворимость. Кроме того, они имеют сложную настройку. Они присутствуют в сахарах, липидах, белках и нуклеиновых коррозионных веществах.
Вопрос 6: Какова структура биомолекул?
Ответ:
Углерод, азот, водород, кислород, сера и фосфор составляют большинство биомолекул. Белки, нуклеиновые кислоты и липиды формируются в результате скоординированного сбора этих компонентов.
Вопрос 7: Что такое органические и неорганические соединения?
Ответ:
Химические соединения в клетке можно разделить на две основные группы: природные и неорганические соединения. Органические соединения представляют собой интенсификаторы веществ, содержащие компонент углерод. Органические соединения в клетке включают крахмалы, белки, липиды и нуклеиновые кислоты. Часть этих смесей смешивается самой клеткой.
Вода – это неорганическое соединение, состоящее из водорода и кислорода. Это важное соединение в клетке.
Как проводится химический анализ материалов
| Ежемесячная техническая подсказка от Тони ХансенаSignUp | Нет отслеживания ! Нет объявлений ! Вот почему эта страница загружается быстро! |
Все товары
Недорогой тестер текучести расплава глазури
Односкоростной лабораторный или студийный миксер для суспензии
Учебник Конус 6 Матовая глазурь с проблемами
Регулировка расширения глазури путем расчета для устранения дрожи
Alberta Slip, 20 лет замены Albany Slip
Обзор керамических красителей
Контролируете ли вы свой производственный процесс?
Безопасны ли ваши глазури для пищевых продуктов или они выщелачиваются?
Атака на стекло: механизмы коррозионного воздействия
Глазури, массы, ангобы для шаровой мельницы
Связующие для керамических масс
Выявление больших пушек в борьбе с безумием: MgO (G1215U) Изменение нашего взгляда на глазурь
Химия и смешивание матриц для создания глазури из натуральных материалов
Сконцентрируйтесь на одной хорошей глазури
Конус 6 Рецепт плавающей синей глазури
Медно-красная глазурь
Растрескивание и бактерии: есть ли опасность?
Растрескивание керамических глазурей: устранение причин, а не симптомов
Создание неглазурованного керамического шликера или ангоба
Создание собственной бюджетной глазури
Кристаллические глазури: понимание процесса и материалов
Дефлокулянты: подробный обзор
Демонстрация проблем прилегания глазури к Студенты
Диагностика проблем литья на заводе сантехники
Сушка керамики без трещин
Дублирование шликера Albany
Дублирование AP Green Fireclay
Электрические хобби-печи: что нужно знать Посуда в печи для обжига
Сначала вы это видите, потом нет: Стабильность глазури Raku
Закрепление глазури, которая не остается в суспензии
Приготовление массы с использованием глины, характерной для вашего региона
Приготовление прозрачной глазури, совместимой с хромо-оловянными красителями
Приготовление рецептуры фарфора
Приготовление рецептуры глазури из пепла и натуральных материалов
G1214M Конус 5-7 20×5 Глянцевая базовая глазурь
G1214W Конус 6 Прозрачная базовая глазурь
G1214Z Конус 6 Матовая базовая глазурь 9162 G1162 Глазурь
G1214M Конус 5-7 20×5 Глянцевая базовая глазурь 06-04 Базовая глазурь
G1947U/G2571A Конус 10/10R Базовая матовая/глянцевая глазурь
Получение желаемого цвета глазури: Работа с красителями
Глазурь и телесные пигменты и красители в производстве керамической плитки
Основы химии глазури – формула, анализ, Моль%, единица
Химия глазури с использованием фритты приблизительного анализа
Рецепты глазури: составляйте свои собственные рецепты
Типы глазури, рецептура и применение в плиточной промышленности
Проверка глазури на выделение токсичных металлов
Высокоглянцевые глазури
Как проводится химический анализ материала
Как ПО INSIGHT для настольных ПК работает с Unity, LOI и Formula Weight
Как найти и протестировать собственные глины
Я всегда поступал так!
Струйное украшение керамической плитки
Безопасна ли ваша обожженная посуда?
Конус для выщелачивания 6 Пример использования глазури
Предельные формулы и целевые формулы
Малобюджетное тестирование свойств сырой и обожженной глазури
Изготовление собственного стенда для шаровой мельницы
Изготовление конусов для тестирования глазури
Монопороза или плитка для стен однократного обжига
Органические вещества в глине : Подробный обзор
Наружная атмосферостойкая керамика
Окрашивание глазурью вместо погружения или распыления
Распределение размеров частиц керамических порошков
Фарфоровая плитка, стекловидная плитка
Рационализация противоречивых мнений о пластичности
Ravenscrag Slip is Born
Переработка лома глины
Снижение температуры обжига глазури с конуса 10 до 6
Простое физическое испытание глины
Одиночное огнеупорное остекление
Растворимые соли в минералах: подробный обзор Рецепты литья тела
Замена корнуоллского камня
Сверхочищенный камень Terra Sigillata
Химия, физика и производство глазури фритт
Влияние глазури на прочность изделий при обжиге
Четыре уровня, на которых можно увидеть керамическую глазурь
Процесс гончарного производства майолики
Молитва гончара
Правильная химия для конуса 6 MgO Matte
Испытания быть единственным техническим специалистом в клубе
На этом нытье прекращается: реалистичный взгляд в глиняных телах
Эти немаркированные мешки и ведра
Плитка и мозаика для гончаров
Токсичность огнеупорных кирпичей, используемых в печах
Торговля рецептами глазури
Общие сведения о керамических материалах
Общие сведения о оксидах керамики
Понимание свойств глазури
Понимание процесса дефлокуляции при шликерном литье
Понимание рецептов шликерного литья терракоты в Северной Америке
Понимание теплового расширения керамических глазурей
Нежелательная кристаллизация в конусе 6 глазури
Вулканический пепел
Что определяет температуру обжига глазури?
Что такое крот, проверка крота
Что такое глазурованный дракон?
С чего начать знакомство с глазурью?
Почему глазурь для учебников так сложна
Работа с детьми
Описание
Майкл Бэнкс и Стюарт Альтманн рассказывают о методах химического анализа, их преимуществах и недостатках. Также информация о тестовых лабораториях, которые вы можете использовать.
Также информация о тестовых лабораториях, которые вы можете использовать.
Артикул
Современные удобства изолируют нас от материалов, которые мы используем. Точно так же удобство компьютеров и программного обеспечения для расчетов изолирует нас от тяжелой работы, проделанной для того, чтобы предоставить нам числа формул материала для работы. Большинство людей не знают, как лаборатория анализирует материал, чтобы определить его химический состав. Ниже приведены комментарии двух уважаемых участников дискуссионной группы Clayart по этому вопросу.
Методы, используемые в химическом анализе керамического сырья
От: Michael Banks
Здесь мы обычно используем рентгенофлуоресцентную спектрометрию (XRF) и атомно-абсорбционную спектроскопию (AAS) при анализе сырья. AAS идеально подходит для количественного анализа в правильных руках! 🙂 Эти методы сообщают об элементном составе. Молярный состав соответствующих оксидов можно определить с помощью компьютерных программ, управляющих обоими аналитическими методами.
Рентгенофлуоресцентный
Образец диаграммы из XRF-аппарата
Наиболее распространенным химическим аналитическим методом является рентгенофлуоресцентная спектрометрия (XRF), которая может определять пропорции и идентичность основных оксидов материалов с самым разным составом, таких как силикаты, карбонаты, сульфаты и фосфаты от ниже 0,01% до 100%. Анализ быстрый и неразрушающий, но, как правило, непрактичный для определения элементов легче фтора. Образцы, содержащие легкие элементы, такие как, например, литий и бор, часто анализируют с помощью атомно-абсорбционной спектроскопии (ААС) или колориметрических методов.
Анализ основных оксидов с помощью XRF можно проводить всего на 0,5 г материала. Материал образца может быть проанализирован как спрессованный порошок, сплавленный в стеклянный диск с использованием подходящего флюса, такого как тетраборат лития. Использование сплавленных образцов позволяет получить равномерно диспергированный твердый раствор, что позволяет точно определить широкий диапазон матричных составов за счет нормализации как размера частиц, так и межэлементных (матричных) эффектов.
XRF работает, направляя рентгеновские лучи на образец, который возбуждает некоторые из электронов, вращающихся вокруг атомных ядер (внутри атомов присутствующих элементов), для перехода на более высокие энергетические орбитали. Пустое место в соответствующей орбитальной оболочке заменяется другим электроном, опускающимся с более высокого энергетического уровня. Электрон излучает рентгеновский фотон, чтобы перейти на более низкий энергетический уровень. Этот процесс испускания атомами вторичного рентгеновского излучения в ответ на возбуждение первичным источником рентгеновского излучения называется рентгеновской флуоресценцией. Вторичные рентгеновские фотоны испускаются атомами элементов в образце в виде характерных дискретных частотных пиков, отпечатков их линейчатых спектров.
XRF-аппарат в работе
Держатели образцов расположены слева на переднем плане
Таким образом, элементы в образце можно идентифицировать по их спектральным длинам волн для качественного анализа, а интенсивность испускаемых спектральных линий позволяет провести количественный анализ.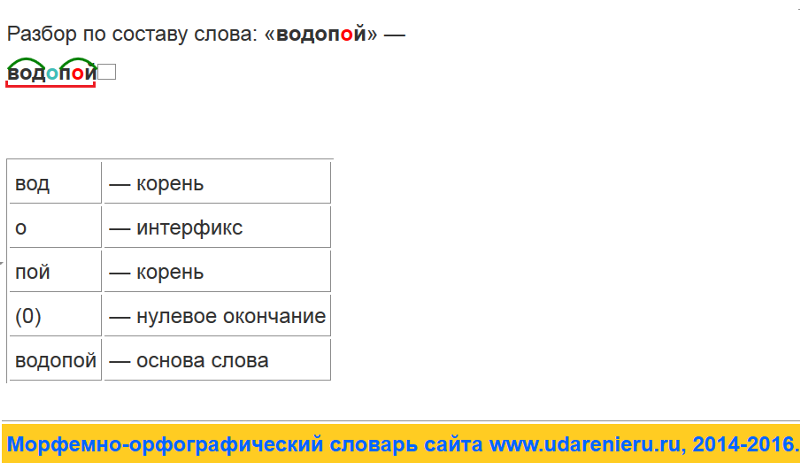 Это достигается путем направления вторичного (флуоресцентного) излучения образца в узкий пучок щелевым коллиматором на кристаллическую пластину. Кристалл обычно представляет собой фторид лития. Различные длины волн в луче преломляются атомами кристаллической решетки в пластине под различными углами, пропорциональными их частоте (аналогично прохождению белого света через призму). Детектор излучения поворачивается на градусы вокруг точной дорожки (гониометра) и таким образом измеряются отдельные частоты и их интенсивности. Затем бортовой компьютер преобразует эти данные в значения концентрации элементов или оксидов.
Это достигается путем направления вторичного (флуоресцентного) излучения образца в узкий пучок щелевым коллиматором на кристаллическую пластину. Кристалл обычно представляет собой фторид лития. Различные длины волн в луче преломляются атомами кристаллической решетки в пластине под различными углами, пропорциональными их частоте (аналогично прохождению белого света через призму). Детектор излучения поворачивается на градусы вокруг точной дорожки (гониометра) и таким образом измеряются отдельные частоты и их интенсивности. Затем бортовой компьютер преобразует эти данные в значения концентрации элементов или оксидов.
Атомно-абсорбционная спектрометрия:
Для этого метода измельченный образец обычно разлагают (растворяют в растворе) смесями сильных кислот, обычно хлорной и плавиковой кислотой. AAS работает, излучая свет заданной частоты через газовое пламя (ацетилен-кислород или ацетилен-закись азота), в котором испаряется водный раствор образца. В этом случае (аналогично XRF) орбитальные электроны в плазме пламени поглощают определенные кванты света из луча, чтобы перейти на более высокие энергетические уровни. Но, в отличие от XRF, детектор, расположенный напротив источника света, измеряет интенсивность потери определенной частоты, а элементный (или оксидный) состав, рассчитанный по отношению к набору известных водных стандартов, попеременно проходит через AAS
Но, в отличие от XRF, детектор, расположенный напротив источника света, измеряет интенсивность потери определенной частоты, а элементный (или оксидный) состав, рассчитанный по отношению к набору известных водных стандартов, попеременно проходит через AAS
с образцами.
Элементы, присутствующие в атмосфере Солнца и звезд, также дают спектры поглощения. Для присутствующих элементов характерны многочисленные темные полосы в спектре света, излучаемого этими объектами. Темные полосы — это фотоны определенной частоты, которые были поглощены элементами атмосферы солнца (или звезд). Спектральный анализ солнечного света представляет собой практически дальний ААС.
Колориметрические методы:
Только несколько элементов не так просто определить с помощью РФА или ААС. Вероятно, единственным веществом, обычно присутствующим в керамических материалах, является бор. Это можно определить с помощью колориметрии. Это влечет за собой приготовление водного раствора образца, добавление реагента, который дает сильный цвет в присутствии ионов бора, и измерение интенсивности этого цвета по отношению к стандартам с известной концентрацией бора.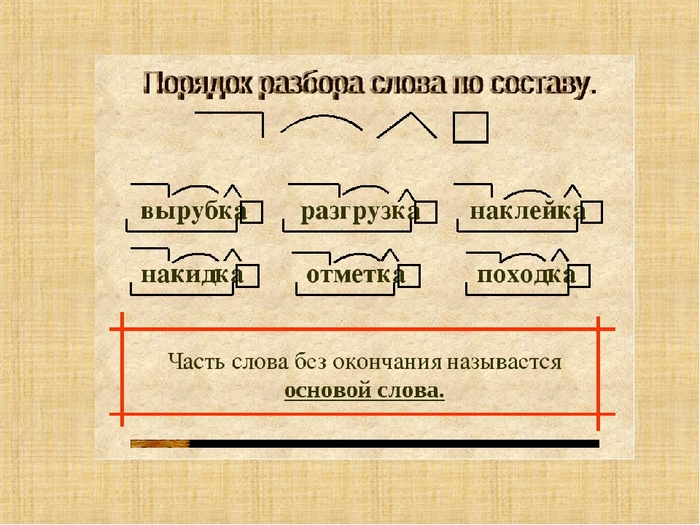 Сравнение интенсивности цвета обычно считывается машиной, но также может выполняться на глаз (как в старые времена). Надеюсь, кто-то не дальтоник!
Сравнение интенсивности цвета обычно считывается машиной, но также может выполняться на глаз (как в старые времена). Надеюсь, кто-то не дальтоник!
ICP, NAA и т. д.:
Те немногие элементы или материалы, которые не анализируются этими методами, могут быть определены с помощью других более специализированных методов, таких как спектроскопия с индуктивно-связанной плазмой (ICP) – аналогично высокотемпературному ААС, нейтронно-активационному анализу (NAA). ), или влажный химический анализ, кроме колориметрии. Отдельные микроскопические минералы могут быть проанализированы на месте в породе с помощью электронного микрозонда или рентгеновского микрозонда, который фактически представляет собой микро-РФА.
От: Стюарт Альтманн [email protected]>
Химический анализ проводится с точки зрения массы (так называемый «вес», хотя на самом деле это не так).
Но благодаря числу Авогадро мы можем легко преобразовать массу в число атомов или молекул. Число молекул в одном грамм-моле вещества, определяемое как молекулярная масса в граммах, равно 6,022 умножить на 10 в 23-й степени — это число Авогадро. 23 молекул. Разве это преобразование не удивительно?
23 молекул. Разве это преобразование не удивительно?
Многие методы используются для анализа химических элементов, в зависимости от требуемого уровня точности, имеющегося оборудования и т.д. Хорошее описание доступных методов см. в Macropedia Британской энциклопедии в разделе «Анализ и измерение». Обычный, относительно недорогой анализ дает значения с точностью до двух (или трех) значащих цифр, и это, вероятно, вся точность, которую вы можете ожидать — или в которой нуждаетесь — для большинства гончарных работ.
Наиболее точным прибором, используемым в настоящее время для рутинного химического анализа, является масс-спектроскоп высокого разрешения, который может разрешить разницу всего в одну часть на 10 000 000. С такой точностью вы можете определить массы не только химических элементов, но и различных изотопов элемента, например углерод-12 против углерода-14 или водород против дейтерия против трития.
Единичная формула не указывает количество молекул или частей молекул. В нем указаны относительные количества (доли) перечисленных оксидов. Этой распространенной путаницы можно было бы избежать, если бы формулы единства выражались в процентах, а не в пропорциях, но это, вероятно, привело бы к другой путанице, если бы вы думали, что это проценты оксидов в вашем рецепте.
В нем указаны относительные количества (доли) перечисленных оксидов. Этой распространенной путаницы можно было бы избежать, если бы формулы единства выражались в процентах, а не в пропорциях, но это, вероятно, привело бы к другой путанице, если бы вы думали, что это проценты оксидов в вашем рецепте.
Вот таблица, показывающая, что предоставляет лаборатория. Они включены в ряд каталогов гончарных изделий, и многие компании, производящие их, размещают их на своих веб-страницах. Вот, например, опубликованный корпорацией Feldspar анализ полевого шпата G200. Обратите внимание, что анализ дан с точки зрения оксидов различных элементов; это форма, обычно используемая при расчетах глазури и глины.
Типовой анализ
SiO 2 66,3% Ал 2 О 3 18,5% Fe 2 O 3 0,082% СаО 0,81% MgO ТРЕЙС Na 2 O 3,04% К 2 О 10,75% LOI 0,16%
Думаю, единственное, что здесь требует объяснения, это LOI, потери при прокаливании. Сюда входят летучие вещества, такие как оксиды C, S, H и N, некоторые из которых происходят из органических материалов. Анализ содержания серы, который важен (отрицательно) для гончара, обычно необходимо запрашивать отдельно.
Сюда входят летучие вещества, такие как оксиды C, S, H и N, некоторые из которых происходят из органических материалов. Анализ содержания серы, который важен (отрицательно) для гончара, обычно необходимо запрашивать отдельно.
В зависимости от оборудования, используемого в химической лаборатории, и того, что требуется, анализ может проводиться для самих элементов, а не для их оксидов. Например, анализ воды из болота в Национальном парке Амбосели, Кения, дал мне следующее:
Элемент Результат (мкг/мл) Предел обнаружения Na 12400 мкг/мл 10 Fe 18,7 0,03 Мг 73,1 73,8 (и т. д., для 32 элементов)
Чем гетерогеннее материал, тем больше размер выборки, необходимый для достижения любой заданной степени точности при оценке среднего состава. Получение репрезентативных выборок чревато потенциальными погрешностями; большое внимание уделялось методам их минимизации. Используют ли горнодобывающие компании современные методы отбора проб? Ах, тем самым висит сказка!
Чтобы найти ближайшую к вам лабораторию, наберите в поисковой системе фразу «служба химического анализа оксидов керамики» или посетите реестр Томаса по адресу http://www. thomasregister.com и найдите лаборатории, в которых используется указанный здесь тип оборудования. Digitalfire также ведет список лабораторий по адресу https://digitalfire.com/services/database.php?list=labs
thomasregister.com и найдите лаборатории, в которых используется указанный здесь тип оборудования. Digitalfire также ведет список лабораторий по адресу https://digitalfire.com/services/database.php?list=labs
Связанная информация
Ссылки
| Автор: Тони Хансен 9 Следуйте за мной на8 |
Расскажите нам, как улучшить эту страницу
Или задайте вопрос, и мы изменим эту страницу, чтобы лучше ответить на него.
Адрес электронной почты
Имя
Субъект
Сообщение
Сообщение Введите это, чтобы доказать, что вы не робот, или Обновить
Оставьте следующее пустым
https://digitalfire.com, все права защищены
Политика конфиденциальности
Что такое химический состав в химии?
Химический состав относится к точному количеству элементов на молекулу вещества. Химический состав вещества определяет его физические и химические свойства при определенных условиях.
Химический состав вещества определяет его физические и химические свойства при определенных условиях.
Вещества могут существовать во многих агрегатных состояниях, включая твердое, жидкое, газообразное, плазму и конденсат Бозе-Эйнштейна. Они также могут существовать в различных сочетаниях, таких как двухатомные элементы, соединения, растворы, суспензии, сплавы и коллоиды. Достаточно стабильное вещество в стандартных условиях определяется его элементами или соединениями.
В химии смеси могут быть гомогенными или гетерогенными.
- В гомогенной смеси составляющие вещества неразличимы, однородны по всему объему и не могут быть легко разделены.
- Вещества, входящие в состав гетерогенной смеси , различны, неоднородны и могут быть легко разделены.
Воздух является примером гомогенной смеси, тогда как коллоиды, такие как молоко, туман и масло, являются типами гетерогенных смесей. Коллоидные смеси определяются размером частиц и тем, как они рассеивают свет. Коллоиды обычно имеют размер частиц от 2 до 500 нм и рассеивают видимый свет.
Коллоиды обычно имеют размер частиц от 2 до 500 нм и рассеивают видимый свет.
В этом посте:
Как определить химический состав вещества
Вещества в основном состоят из элементов или соединений (два или более химических элемента связаны друг с другом). Таким образом, вы можете определить химический состав вещества, посмотрев, какие элементы химически связаны друг с другом.
Большинство веществ не существует в чистом виде в природе, так как всегда будут присутствовать некоторые примеси. Таким образом, процессы очистки, такие как макроскопическая фильтрация, обратный осмос, центробежное разделение и дистилляция, используются для получения более чистых форм веществ без нарушения их химического состава. Эти процессы часто используются на начальной стадии определения химического состава веществ.
Существуют различные методы, которые можно использовать для определения химического состава вещества. Они делятся на две категории – качественные методы и количественные методы.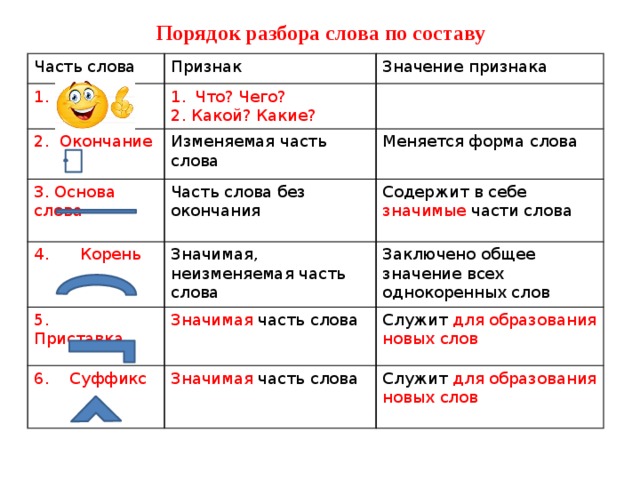
Качественные методы
Качественные методы в основном представляют собой описательные методы, используемые для определения состава неизвестного аналита. Они не требуют точных измерений или расчетов и могут выполняться в качестве предварительного шага для исключения присутствия определенных веществ.
Некоторые примеры качественных методов включают:
Количественные методы
В отличие от качественных методов количественные методы используют точные измерения и расчеты для определения пропорций и структуры вещества. Они не просто обнаруживают присутствие вещества или исключают определенные элементы или функциональные группы.
Некоторые примеры количественных методов включают:
- Титрование (объемный анализ) – обычно используется в реакциях нейтрализации между кислотами и основаниями. Пороговый объем нейтрализации используется для определения молярной концентрации аналита.
- Гравиметрический анализ – в этом методе очищенное вещество неизвестного состава взвешивается перед применением реагентов для проведения известных реакций.
 Затем массу выделенного вещества сравнивают с массой исходного вещества образца.
Затем массу выделенного вещества сравнивают с массой исходного вещества образца. - Рентгенофлуоресцентная спектроскопия – в этом методе высокоэнергетические рентгеновские или гамма-лучи направляются на неизвестное вещество. Излучение, испускаемое веществом, затем анализируется на наличие химических сигнатур элементов. Рентгенофлуоресцентная спектроскопия может использоваться для идентификации металлов, стекла, керамики и строительных материалов. Это также полезно в судебно-медицинской экспертизе, например, при определении подлинности картины.
Как рассчитать химический состав смеси
Как мы уже объясняли, существуют различные качественные и количественные методы, которые можно использовать для анализа состава неизвестной смеси. Когда дело доходит до расчета точного химического состава смеси, вам нужно смотреть на такие измерения, как молярная масса и плотность.
Молярная масса
Одним из способов расчета химического состава смеси является определение ее молярной массы. Вы можете просто записать химические формулы, а затем умножить количество атомов элемента на молекулу на атомный вес. Это даст вам молярную массу, которую вы затем сможете соотнести с массой образца. Однако важно убедиться, что у вас очень чистый образец вещества.
Вы можете просто записать химические формулы, а затем умножить количество атомов элемента на молекулу на атомный вес. Это даст вам молярную массу, которую вы затем сможете соотнести с массой образца. Однако важно убедиться, что у вас очень чистый образец вещества.
Например, вы можете рассчитать молярную массу воды следующим образом:
Вода = H 2 O
- Кислород = 1 атом x 16 единиц или 16 грамм на литр, чтобы получить молярный эквивалент
- Водород = 2 атомов x 1 ед. или 2 грамма на литр, чтобы получить молярный эквивалент
- ИТОГО: 18 граммов
Поскольку один грамм воды равен 1 мл при стандартных условиях, один моль воды равен 18 мл.
Плотность
Другой способ расчета состава вещества – через плотность. Если вы знаете массу и объем вещества, вам просто нужно разделить массу на объем.
Эта формула полезна, если вы хотите определить чистоту вещества известной плотности.
Например, золото имеет плотность 19,32 грамма на кубический сантиметр. Это означает, что металл с плотностью ниже этой не является чистым золотом. Чтобы утверждать, что образец золота имеет высокую чистоту, его плотность должна быть близка к этому значению. Принцип Архимеда использует плотность для проверки чистоты вещества.
Как написать химический состав?
Химический состав любого вещества записывается в виде формулы соединения или элемента, а иногда и их комбинации.
Если вещество представляет собой смесь, вам необходимо указать химические названия и/или соответствующие химические формулы и процентное содержание всех присутствующих веществ.
Например, керосин представляет собой сложную смесь различных углеводородов, которая обычно содержит:
- Парафины (55,2%)
- Нафтены (40,9%)
- Ароматические углеводороды (3,9%).
Вы можете дополнительно подразделить эти химические категории на конкретные соединения, но список будет очень длинным.
Примеры химических составов
Химические составы обычно записываются в виде химических формул, которые представляют собой символы элементов с нижними индексами. Они представляют собой молекулу определенного вещества. Химические составы также могут быть записаны в виде структурных формул или скелетных структур, если молекула большая и очень сложная, например органические соединения.
В некоторых случаях химические составы могут быть представлены обобщенными формулами, содержащими функциональные группы. Вот несколько примеров:
Chemical formula
- Table sugar or sucrose: C1 2 H 22 O 11
- Limestone or calcium carbonate: CaCO 3
Structural formula
- Butane:
- Этилен:
Формула скелета
- Ибупрофен:
- Эсциталопрам антидепрессант:
Каков химический состав воздуха?
Воздух представляет собой однородную смесь, химически состоящую из элементов и соединений, наибольшую долю которых составляет двухатомный азот (78,08%). Далее следует двухатомный кислород с концентрацией 20,95%. Углекислый газ и другие газообразные соединения также присутствуют в воздухе, но только в следовых количествах.
Далее следует двухатомный кислород с концентрацией 20,95%. Углекислый газ и другие газообразные соединения также присутствуют в воздухе, но только в следовых количествах.
Каков химический состав ржавчины?
Под ржавчиной обычно понимают окисление железа, обычно наблюдаемое в строительных конструкциях, мостах и автомобилях. Ржавчина по существу представляет собой гидратированный оксид железа или Fe 9.0302 2 O 3 nH 2 O. Может также содержать гидроксид железа (FeO(OH)).
Каков химический состав спирта?
Спирт обычно имеет гидроксильную или ―OH функциональную группу, присоединенную к алкильной группе, также известную как алкановый заместитель. Существуют различные типы спиртов, одним из которых является этанол, или:
C 2 H 5 OH
Этанол — это нелетальный спирт, содержащийся в алкогольных напитках, таких как вино, джин и пиво. Процентное содержание этанола зависит от типа алкогольного напитка.
Заявление об отказе от ответственности
Весь контент, опубликованный в блоге ReAgent.co.uk, предназначен только для информации. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования предоставленной информации. Кроме того, мы не рекомендуем использовать какие-либо химические вещества, не ознакомившись с Паспортом безопасности материала (MSDS), который можно получить у производителя. Вы также должны следовать всем советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть вопросы, связанные со здоровьем и безопасностью, посетите HSE.gov.uk.
Качественный анализ веществ, материалов, атомов и органических веществ
Ценность материала частично определяется веществами, из которых он состоит. Операции, необходимые для определения этого состава, известны как качественный анализ. Качественный анализ представляет собой серию тестов; ответы на эти тесты определяют элементы и соединения, из которых состоит материал.
Качественный анализ представляет собой серию тестов; ответы на эти тесты определяют элементы и соединения, из которых состоит материал.
Каждое вещество уникально. Каждый имеет, например, определенный цвет , текстуру и внешний вид. Этих свойств, однако, часто недостаточно для положительной идентификации вещества, хотя они, безусловно, способствуют его идентичности. Как правило, необходимо оценивать другие физические и химические характеристики, чтобы безошибочно определить точный состав материала. С 92 встречающихся в природе элементов и бесконечное разнообразие возможных комбинаций, непростая задача с уверенностью доказать точный состав неизвестного вещества. Если при испытании неизвестное проявляет свойства, во всех отношениях идентичные известным свойствам конкретного вещества, то это неизвестное идентично известному веществу и идентифицируется. Однако необходима осторожность, поскольку, хотя некоторые свойства могут сравниваться в пределах ошибки эксперимента , все свойства должны коррелировать, прежде чем известные и неизвестные материалы можно будет назвать идентичными.
Некоторыми из наиболее распространенных физических свойств, измеряемых для идентификации неизвестного вещества, являются: температура плавления, цвет, температура кипения , текстура, плотность, пластичность, электропроводность , пластичность, теплопроводность, показатель преломления и коэффициент преломления линейного расширения.
Большинство перечисленных свойств имеют поддающиеся измерению числовые значения, которые можно сравнить с известными значениями элементов и соединений, приведенными в таблицах в различных справочниках. Более сложные физические испытания, требующие сложного научного оборудования и обученных операторов, имеют дело с измерениями, зависящими от внутренней структуры материала. В зависимости от расположения частиц внутри вещества они взаимодействуют с электромагнитными излучение по разному. Результатом этих взаимодействий является электромагнитный спектр , графическое изображение поглощения и испускания электромагнитных излучений с различной энергией , когда они ударяются и проходят через вещество. Рентгеновский, ультрафиолетовый, видимый, инфракрасный и другие спектры при сравнении с аналогичными спектрами известных материалов дают совпадение со спектром неизвестного, если они идентичны, и несовпадение, если они не идентичны.
Рентгеновский, ультрафиолетовый, видимый, инфракрасный и другие спектры при сравнении с аналогичными спектрами известных материалов дают совпадение со спектром неизвестного, если они идентичны, и несовпадение, если они не идентичны.
Химические тесты широко используются для качественного анализа. Если неизвестное вещество дает те же результаты при взаимодействии с определенным химическим реагентом, что и вещество известного состава, они могут быть идентичными. Чтобы быть абсолютно уверенным, проводится более одного подтверждающего теста, поскольку, хотя реагент А может при добавлении как к известному, так и к неизвестному веществу давать одинаковые ответы, реагент Б, используемый для тестирования, может реагировать только с известным, а не с неизвестным веществом. . Химик-аналитик, который проводит эти тесты, должен уметь правильно выбирать тестовые реагенты и знать ожидаемые результаты.
Существуют различные схемы качественного анализа, и их изучение является частью обучения по многим программам химии колледжей. Наиболее распространенная схема, схема нерастворимых сульфидов, идентифицирует примерно 30 наиболее распространенных металлических элементов. Он использует один реагент, сероводород, для разделения растворов металлических элементов на группы из нескольких веществ со схожими химическими свойствами. Затем добавляются другие, более специфические реагенты для дальнейшего разделения внутри каждой группа . Затем проводятся подтверждающие тесты, в результате которых образуется нерастворимое окрашенное твердое вещество, называемое осадком, или растворимый продукт уникального цвета.
Наиболее распространенная схема, схема нерастворимых сульфидов, идентифицирует примерно 30 наиболее распространенных металлических элементов. Он использует один реагент, сероводород, для разделения растворов металлических элементов на группы из нескольких веществ со схожими химическими свойствами. Затем добавляются другие, более специфические реагенты для дальнейшего разделения внутри каждой группа . Затем проводятся подтверждающие тесты, в результате которых образуется нерастворимое окрашенное твердое вещество, называемое осадком, или растворимый продукт уникального цвета.
Неметаллические элементы труднее сгруппировать из-за большего количества реакций, в которых они могут участвовать. Для идентификации отдельных компонентов в каждой группе потребуются дополнительные подтверждающие тесты.
Органические материалы, основанные главным образом на структуре углерода , создают особую проблему для качественного анализа из-за присутствия большого количества углерода атомов . Различие между различными органическими соединениями основано на расположении атомов углерода и других неуглеродных атомов внутри соединения. Можно разделить органические соединения на группы на основе этих механизмов, и часто для идентификации группы достаточно качественного анализа, а не для идентификации конкретного соединения. Здесь перечислены некоторые из наиболее распространенных органических функциональных групп, как они называются, и характерное для группы расположение атомов. Символ R представляет лежащее в основе расположение атомов углерода и водорода. р 1 может быть или не быть таким же, как R 2 : кислоты R-COOH; спирты R-OH; альдегиды R-COH; амины R-NH 2 ; сложные эфиры R 1 -COO-R 2 ; простые эфиры R 1 -O-R 2 ; углеводороды R-H; кетоны R 1 -CO-R 2 .
Различие между различными органическими соединениями основано на расположении атомов углерода и других неуглеродных атомов внутри соединения. Можно разделить органические соединения на группы на основе этих механизмов, и часто для идентификации группы достаточно качественного анализа, а не для идентификации конкретного соединения. Здесь перечислены некоторые из наиболее распространенных органических функциональных групп, как они называются, и характерное для группы расположение атомов. Символ R представляет лежащее в основе расположение атомов углерода и водорода. р 1 может быть или не быть таким же, как R 2 : кислоты R-COOH; спирты R-OH; альдегиды R-COH; амины R-NH 2 ; сложные эфиры R 1 -COO-R 2 ; простые эфиры R 1 -O-R 2 ; углеводороды R-H; кетоны R 1 -CO-R 2 .
Органические вещества с различными функциональными группами растворяются или остаются нерастворимыми в различных растворителях. Они также по-разному реагируют на различные реагенты. Сравнительно легко определить группу, к которой принадлежит органическое соединение. После разделения потребуются дополнительные тесты для подтверждения наличия конкретной функциональной группы.
Идентификация конкретного органического вещества затруднена. Физические тесты часто более полезны, чем химические тесты. Например, после предварительной идентификации органического соединения часть неизвестного вещества смешивают с частью чистого известного вещества и измеряют температуру плавления. Предварительная идентификация была правильной, если температура плавления смеси идентична литературному значению точки плавления чистого вещества, но неверной, если наблюдалась значительно более низкая температура плавления.
Спектральная идентификация органических веществ, включая сложные материалы живых видов , вероятно, является лучшим средством качественной идентификации. Инфракрасный спектр органического материала имеет многочисленные пики и впадины, генерируемые взаимодействием инфракрасного излучения и атомов внутри молекулы , когда излучение проходит через вещество или отражается от его поверхности. Каждая функциональная группа взаимодействует только с инфракрасными лучами определенной энергии или частота . Пик, наблюдаемый на частоте, которая, как известно, указывает на группу спиртов , свидетельствует о том, что вещество действительно является спиртом. Опять же, следует провести подтверждающие тесты, как физические, так и химические, поскольку часто пик, генерируемый одним типом функциональной группы, перекрывает пик другого.
Инфракрасный спектр органического материала имеет многочисленные пики и впадины, генерируемые взаимодействием инфракрасного излучения и атомов внутри молекулы , когда излучение проходит через вещество или отражается от его поверхности. Каждая функциональная группа взаимодействует только с инфракрасными лучами определенной энергии или частота . Пик, наблюдаемый на частоте, которая, как известно, указывает на группу спиртов , свидетельствует о том, что вещество действительно является спиртом. Опять же, следует провести подтверждающие тесты, как физические, так и химические, поскольку часто пик, генерируемый одним типом функциональной группы, перекрывает пик другого.
Другие спектральные процедуры, не связанные с электромагнитным излучением, также вызывают специфические реакции, спектры органических соединений, основанные на расположении атомов, составляющих материал. Возможно, наиболее известной из них является техника ядерно-магнитный резонанс (ЯМР) спектроскопия . Применительно к живой ткани в качестве диагностического инструмента для наблюдения за неправильным расположением молекул в живом организме , указывающим на определенное заболевание или аномалию, этот подход известен как магнитно-резонансная томография (МРТ) спектроскопия. Образец, помещенный в сильное магнитное поле и одновременно подвергнутый сильному электрическому сигналу, из-за магнитных свойств протонов внутри его атомов будет реагировать на эти внешние силы. Результатом является ядерный магнитный спектр. Здесь, по аналогии с инфракрасным спектром, расположение генерируемых пиков указывает на то, как расположены атомы внутри молекулы. Ядерно-магнитные спектры имеют преимущество перед инфракрасными спектрами в одном отношении, поскольку они указывают на присутствие и положение атомов водорода, связанных с углеродом. Это очень трудно определить по инфракрасному спектру.
Применительно к живой ткани в качестве диагностического инструмента для наблюдения за неправильным расположением молекул в живом организме , указывающим на определенное заболевание или аномалию, этот подход известен как магнитно-резонансная томография (МРТ) спектроскопия. Образец, помещенный в сильное магнитное поле и одновременно подвергнутый сильному электрическому сигналу, из-за магнитных свойств протонов внутри его атомов будет реагировать на эти внешние силы. Результатом является ядерный магнитный спектр. Здесь, по аналогии с инфракрасным спектром, расположение генерируемых пиков указывает на то, как расположены атомы внутри молекулы. Ядерно-магнитные спектры имеют преимущество перед инфракрасными спектрами в одном отношении, поскольку они указывают на присутствие и положение атомов водорода, связанных с углеродом. Это очень трудно определить по инфракрасному спектру.
Другой спектральный метод, масс-спектрометрия , измеряет как молекулярную массу материала, так и информацию о том, как атомы соединяются друг с другом. Используя комбинацию электрических и магнитных полей в сочетании с субатомной бомбардировкой материала, вещество разбивается на фрагменты. Записывается масса каждого фрагмента, масс-спектр, и, подобно кусочкам головоломки, эта информация может быть повторно собрана для определения структуры исходного вещества.
Используя комбинацию электрических и магнитных полей в сочетании с субатомной бомбардировкой материала, вещество разбивается на фрагменты. Записывается масса каждого фрагмента, масс-спектр, и, подобно кусочкам головоломки, эта информация может быть повторно собрана для определения структуры исходного вещества.
Все эти методы, электромагнитные спектры, ядерно-магнитные спектры и масс-спектры являются сравнительными методами. Если спектр, наблюдаемый от неизвестного вещества, совпадает со спектром известного материала, можно предположить, что они идентичны.
Часто вещества, подлежащие анализу, состоят из сложных смесей, требующих предварительного разделения до того, как станут известны отдельные компоненты. Один из подходов к разделению и одновременной качественной идентификации сложных смесей использует множество родственных методов, называемых хроматографическими разделениями. Хроматография — это процесс разделения, при котором образец принудительно проходит мимо стационарного адсорбента. Каждый компонент в образце имеет различную степень притяжения к неподвижному адсорбенту: те компоненты, которые сильно притягиваются, будут прилипать к неподвижному материалу почти сразу, в то время как компоненты с меньшей степенью притяжения будут унесены дальше, прежде чем прилипнуть к неподвижному материалу. Если стационарный материал представляет собой адсорбент , бумагу , лист и образец в раствор пропускают через бумагу, метод — бумажная хроматография. Если адсорбент упакован в длинную вертикальную пробирку, а раствор пробы наливается в верхнюю часть пробирки, используется метод колоночной хроматографии. Если адсорбент набивается в длинную узкую трубку, а образец, помещенный на один конец трубы, продувается потоком газа, то метод называется газовой хроматографией. Для всех хроматографических методов расстояние от начальной точки, проходимое каждым компонентом по плоской поверхности, или время, необходимое компоненту для прохождения через наполненную трубку от одного конца до другого, является характеристикой этого компонента.
Каждый компонент в образце имеет различную степень притяжения к неподвижному адсорбенту: те компоненты, которые сильно притягиваются, будут прилипать к неподвижному материалу почти сразу, в то время как компоненты с меньшей степенью притяжения будут унесены дальше, прежде чем прилипнуть к неподвижному материалу. Если стационарный материал представляет собой адсорбент , бумагу , лист и образец в раствор пропускают через бумагу, метод — бумажная хроматография. Если адсорбент упакован в длинную вертикальную пробирку, а раствор пробы наливается в верхнюю часть пробирки, используется метод колоночной хроматографии. Если адсорбент набивается в длинную узкую трубку, а образец, помещенный на один конец трубы, продувается потоком газа, то метод называется газовой хроматографией. Для всех хроматографических методов расстояние от начальной точки, проходимое каждым компонентом по плоской поверхности, или время, необходимое компоненту для прохождения через наполненную трубку от одного конца до другого, является характеристикой этого компонента. Расстояния или времена при сопоставлении с расстояниями или временами известных компонентов указывают на качественное совпадение. Однако целесообразно провести дополнительный подтверждающий тест до того, как будет установлено положительное совпадение.
Расстояния или времена при сопоставлении с расстояниями или временами известных компонентов указывают на качественное совпадение. Однако целесообразно провести дополнительный подтверждающий тест до того, как будет установлено положительное совпадение.
Одной из областей, в которой качественная идентификация стала очень важной, является сопоставление ткани ДНК человека правоохранительными органами для доказательства присутствия или отсутствия человека на месте преступления. Детали того, как это делается, выходят за рамки этой статьи, но представляют интерес для дополнительного чтения.
5.3 Процентный состав – CHEM 1114 – Введение в химию
Глава 5. Химический состав
Цели обучения
К концу этого раздела вы сможете:
- Рассчитать процентный состав соединения на основе экспериментальных измерений массы
- Вычислить процентный состав соединения по его химической формуле
В предыдущем разделе мы обсуждали взаимосвязь между объемной массой вещества и числом содержащихся в нем атомов или молекул (молей). Зная химическую формулу вещества, мы смогли определить количество вещества (молей) по его массе, и наоборот. Но что, если химическая формула вещества неизвестна? В этом разделе мы будем begin изучение того, как химик может определить идентичность соединения на основе экспериментальных измерений массы и расчета процентного состава.
Зная химическую формулу вещества, мы смогли определить количество вещества (молей) по его массе, и наоборот. Но что, если химическая формула вещества неизвестна? В этом разделе мы будем begin изучение того, как химик может определить идентичность соединения на основе экспериментальных измерений массы и расчета процентного состава.
Процентный состав
Элементарный состав соединения определяет его химическую принадлежность, и химические формулы являются наиболее кратким способом представления этого элементного состава. Когда формула соединения неизвестна, измерение массы каждого из составляющих его элементов часто является первым шагом в процессе экспериментального определения формулы. Результаты этих измерений позволяют рассчитать процент состава , определяемый как массовый процент каждого элемента в соединении. Например, рассмотрим газообразное соединение, состоящее исключительно из углерода и водорода. Процентный состав этого соединения может быть представлен следующим образом:
[латекс]\% \;\text{H} = \frac{\text{масса H}}{\text{массовое соединение}} \times 100 \%[/latex]
[латекс]\% \;\text{C} = \frac{\text{масса C}}{\text{массовое соединение}} \times 100 \%[/latex]
Если анализ пробы этого газа массой 10,0 г показал, что он содержит 2,5 г H и 7,5 г C, процентный состав будет рассчитан как 25% H и 75% C:
[латекс]\%\;\text{H} = \frac{2,5 \;\text{g H}}{10,0 \;\text{g соединение}} \times 100 \% = 25 \%[/latex ]
[латекс]\%\;\text{C} = \frac{7,5 \;\text{g C}}{10,0 \;\text{g соединение}} \times 100 \% = 75 \%[/latex ]
Пример 1
Анализ образца жидкого соединения, состоящего из углерода, водорода и азота, массой 12,04 г показал, что оно содержит 7,34 г C, 1,85 г H и 2,85 г N. Каков процентный состав этого соединения?
Каков процентный состав этого соединения?
Решение
Чтобы рассчитать процентный состав, мы делим экспериментально полученную массу каждого элемента на общую массу соединения, а затем переводим в процентное соотношение:
[латекс]\%\;\text{C} = \frac{7.34 \;\text{g C}}{12.04 \;\text{g соединение}} \times 100\% = 61.0\%[/latex]
[латекс]\%\;\text{H} = \frac{ 1,85 \;\text{g H}}{12,04 \;\text{g соединение}} \times 100\% = 15,4\%[/latex]
[латекс]\%\;\text{N} = \frac {2,85 \;\text{g N}}{12,04 \;\text{g соединение}} \times 100\% = 23,7\%[/latex]
Результаты анализа показывают, что соединение представляет собой 61,0% С, 15,4% Н и 23,7% N по массе.
Проверь себя
Определено, что образец газообразного соединения весом 24,81 г, содержащий только углерод, кислород и хлор, содержит 3,01 г C, 4,00 г O и 17,81 г Cl. Каков процентный состав этого соединения?
Ответ
12,1% C, 16,1% O, 71,8% Cl
Определение процентного состава по химической формуле
Процентный состав также полезен для оценки относительного содержания данного элемента в различных соединениях известных формул. В качестве примера рассмотрим распространенные азотсодержащие удобрения аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевину (CH 4 N 2 O). Элемент азота является активным ингредиентом для сельскохозяйственных целей, поэтому массовое процентное содержание азота в соединении представляет собой практическую и экономическую проблему для потребителей, выбирающих среди этих удобрений. Для таких приложений процентный состав соединения легко выводится из массы его формулы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N с массой 14,0067 а.е.м. и три атома H с общей массой (3 × 1,00794 а.е.м.) = 3,02382 а.е.м. Таким образом, формула массы аммиака (14,0067 а.е.м. + 3,02382 а.е.м.) = 17,0305 а.е.м., а его процентный состав:
В качестве примера рассмотрим распространенные азотсодержащие удобрения аммиак (NH 3 ), нитрат аммония (NH 4 NO 3 ) и мочевину (CH 4 N 2 O). Элемент азота является активным ингредиентом для сельскохозяйственных целей, поэтому массовое процентное содержание азота в соединении представляет собой практическую и экономическую проблему для потребителей, выбирающих среди этих удобрений. Для таких приложений процентный состав соединения легко выводится из массы его формулы и атомных масс составляющих его элементов. Молекула NH 3 содержит один атом N с массой 14,0067 а.е.м. и три атома H с общей массой (3 × 1,00794 а.е.м.) = 3,02382 а.е.м. Таким образом, формула массы аммиака (14,0067 а.е.м. + 3,02382 а.е.м.) = 17,0305 а.е.м., а его процентный состав:
[латекс]\%\;\text{N} = \frac{14.0067 \;\text{аму N}}{17.0305 \;\text{аму NH}_3} \times 100\% = 82.2448\%[/ латекс]
[латекс]\%\;\text{H} = \frac{3,02382 \;\text{аму N}}{17,0305 \;\text{аму NH}_3} \times 100\% = 17,7553\% [/латекс]
Такой же подход можно использовать для пары молекул, дюжины молекул или моля молекул и т. д. Последнее количество наиболее удобно и просто предполагает использование молярных масс вместо атомных и формульных масс, как показано в Пример 2. Поскольку мы знаем химическую формулу рассматриваемого вещества, мы можем легко вывести процентный состав из формулы массы или молярной массы.
д. Последнее количество наиболее удобно и просто предполагает использование молярных масс вместо атомных и формульных масс, как показано в Пример 2. Поскольку мы знаем химическую формулу рассматриваемого вещества, мы можем легко вывести процентный состав из формулы массы или молярной массы.
Пример 2
Аспирин представляет собой соединение с молекулярной формулой C 9 H 8 O 4 . Каков его процентный состав?
Раствор
Для расчета процентного состава нам необходимо знать массы C, H и O в известной массе C 9 H 8 O 4 . Удобно рассматривать 1 моль C 9 H 8 O 4 и использовать его молярную массу (180,160 г/моль, определено из химической формулы) для расчета процентного содержания каждого из его элементов:
[латекс]\begin{array}{r @{{}={}} l} \%\text{C} & \frac{9 \;\text{mol C} \;\times\; \text{молярная масса C}}{\text{молярная масса} \;\text{C}_9\text{H}_{18}\text{O}_4} \times 100 = \frac{9 \times 12,011 \;\text{г/моль}}{180,159 \text{г/моль}} \times 100 = \frac{108,099 \;\text{г/моль}}{180,160 \;\text{г/моль}} \times 100 \\[1em] \%\text{C} & 60. 002\%\;\text{C} \end{массив}[/latex]
002\%\;\text{C} \end{массив}[/latex]
[латекс]\begin{массив}{r @{{ }={}} l} \%\text{H} & \frac{8 \;\text{mol H} \;\times\; \text{молярная масса H}}{\text{молярная масса} \;\text{C}_9\text{H}_{18}\text{O}_4} \times 100 = \frac{8 \times 1,00794 \;\text{г/моль}}{180,159 \text{г/моль}} \times 100 = \frac{8,06352 \;\text{г/моль}}{180,160 \;\text{г/моль}} \times 100 \\[1em] \%\text{H} & 4,47575\%\;\text {H} \end{array}[/latex]
[latex]\begin{array}{r @{{}={}} l} \%\text{O} & \frac{4 \;\text {моль О} \;\раз\; \text{молярная масса O}}{\text{молярная масса} \;\text{C}_9\text{H}_{18}\text{O}_4} \times 100 = \frac{4 \times 15,994 \;\text{г/моль}}{180,159 \text{г/моль}} \times 100 = \frac{63,9976 \;\text{г/моль}}{180,160 \;\text{г/моль}} \times 100 \\[1em] \%\text{O} & 35,5226\%\;\text{O} \ end{array}[/latex]
Обратите внимание, что сумма этих процентов равна 100,00% при соответствующем округлении.
Проверьте себя
Какова до трех значащих цифр массовая доля железа в соединении Fe 2 O 3 ?
Ответ
69,9% Fe
Пример 3
Какова массовая доля H в 5,00 г H 2 O
Раствор
Дана общая масса соединения (5,00 г). Чтобы определить процентный состав, нам нужно определить массу H в образце. Помните, что ТОЛЬКО химическая формула дает нам возможность перейти от H 2 O к H, и она относится только к частицам или молям. Таким образом, наш путь:
Чтобы определить процентный состав, нам нужно определить массу H в образце. Помните, что ТОЛЬКО химическая формула дает нам возможность перейти от H 2 O к H, и она относится только к частицам или молям. Таким образом, наш путь:
грамм H 2 O [латекс]\longrightarrow[/latex] моль H 2 O [латекс]\longrightarrow[/латекс] моль H [латекс]\longrightarrow[/латекс] грамм H
Затем применим формулу процентного состава.
[латекс]5.00\; \rule[0.5ex]{0.5em}{0.1ex}\hspace{-0.5em}\text{g of H}_2\text{O}\; \ раз \ гидроразрыва {1 \; \rule[0.25ex]{1.25em}{0.1ex}\hspace{-1.25em}\text{mol H}_2\text{O}} {18.0153\; \rule[0.25ex]{0.5em}{0.1ex}\hspace{-0.5em}\text{g H}_2\text{O}} \times \frac{2\; \rule[0.5ex]{1.25em}{0.1ex}\hspace{-1.25em}\text{mol H}}{1\;\rule[0.25ex]{1.25em}{0.1ex}\hspace{- 1.25em}\text{моль H}_2\text{O}} \times \frac{1.01\; \text{g H}}{1\;\rule[0.25ex]{1.25em}{0.1ex}\hspace{-1.25em}\text{mol H}_2\text{O}}[/latex] [ латекс] = 0,561\; \text{г H}[/latex]
[латекс]\%\;\text{H} = \frac{0,561 \;\text{g H}}{5,00 \;\text{g вода}} \times 100 \% = 11,2 \% [/latex]
Проверь себя
Какова массовая доля O в 10,0 г Cu(NO 3 ) 2 ?
Ответ
51,18%
Пример 4
Определите процентный состав H в пропаноле (C 3 H 7 OH)
Раствор
, учитывая один моль C 3 H 7 OH, % H в C 3 H 7 OH =
[Latex] \ % } = \frac{\text{масса 8 моль H}}{\text{масса 1 моль пропанола}} \times 100 \% =[/latex] [латекс]\frac{8,06352\; \text{g H}}{60. 096\; \text{g пропанол}} \times 100 \% = 13,418 \%[/latex]
096\; \text{g пропанол}} \times 100 \% = 13,418 \%[/latex]
Проверь себя
Каково процентное содержание каждого элемента в H 2 СО 4 ?
Ответ
H = 2,06%, S = 32,69%, O = 65,25%
Пример 5
Гемоглобин содержит 0,33% Fe по массе. Молярная масса гемоглобина равна 6,8 х 10 4 г/моль. Сколько граммов железа содержится в 0,020 моль гемоглобина?
Раствор
Процентный состав в основном относится к массе элемента в 100 г соединения. Таким образом, 0,33% = 0,33 г Fe в 100 г гемоглобина. Мы можем использовать это как коэффициент пересчета (но не забывайте, что он основан на 100 г соединения!) 94\; \rule[0.25ex]{0.5em}{0.1ex}\hspace{-0.5em}\text{g гемоглобин}} {1\; \rule[0.25ex]{1.25em}{0.1ex}\hspace{-1.25em}\text{моль гемоглобина}} \times \frac{0.33\; \text{g Fe}}{100\;\rule[0,25ex]{0,5em}{0,1ex}\hspace{-0,5em}\text{g гемоглобина}}[/latex] [латекс]= 4,5\; \text{г Fe}[/latex]
Проверь себя
Сколько граммов Ba 3 P 2 содержало бы 90 2 3 0 9 0 3 P 0 3 0 3 содержит 86,9% Ba по массе?
Ответ
4,87 г Ba 3 P 2
Ключевые понятия и резюме
Химическая идентичность вещества определяется типами и относительным числом атомов, составляющих его основные структуры (молекулы в случае ковалентных соединений, ионы в случае ионных соединений). Процентный состав соединения обеспечивает массовый процент каждого элемента в соединении.
Процентный состав соединения обеспечивает массовый процент каждого элемента в соединении.
Ключевые уравнения
- [латекс]\%\текст{X} = \frac{\text{масса X}}{\text{масса соединения}} \times 100\%[/latex]
Глоссарий
процентный состав: массовый процент различных элементов в соединении
3.3: Состав химических соединений
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 13788
\[2\times(1,0079\;а.е.м.) + 1\times (15,9994 \;а.е.м.) = 18,01528 \;а.е.м.\]
Если вещество существует в виде отдельных молекул (например, с атомами, которые химически связаны вместе), то химическая формула равна молекулярная формула , а формула вес равна молекулярная масса . Например, углерод, водород и кислород могут химически связываться с образованием молекулы сахара глюкозы с химической и молекулярной формулой C 6 H 12 O 6 . Таким образом, формула веса и молекулярная масса глюкозы:
Например, углерод, водород и кислород могут химически связываться с образованием молекулы сахара глюкозы с химической и молекулярной формулой C 6 H 12 O 6 . Таким образом, формула веса и молекулярная масса глюкозы:
Ионные вещества химически не связаны и не существуют в виде дискретных молекул. Однако они связываются в дискретных соотношениях ионов. Таким образом, мы можем описать их формульные веса, но не их молекулярных масс . Поваренная соль (NaCl), например, имеет формульный вес:
\[23.0\; а.е.м. + 35,5 а.е.м. = 58,5 а.е.м.]
Процентное содержание состава по формулам
В некоторых типах анализов важно знать процентное содержание по массе каждого типа элемента в соединении. Закон определенных пропорций гласит, что химическое соединение всегда содержит одну и ту же пропорцию элементов по массе; то есть процентный состав — процент каждого элемента, присутствующего в чистом веществе, — равен 9. 0021 постоянная (хотя есть и исключения из этого закона). Возьмем, к примеру, метан (\(CH_4\)) с формулой и молекулярной массой:
0021 постоянная (хотя есть и исключения из этого закона). Возьмем, к примеру, метан (\(CH_4\)) с формулой и молекулярной массой:
\[1\times (12,011 \;а.е.м.) + 4 \times (1,008) = 16,043 \;а.е.м.\]
относительных ( масса) проценты углерода и водорода составляют
\[\%C = \dfrac{1 \times (12,011\; а.е.м.)}{16,043 а.е.м.} = 0,749 = 74,9\%\]
\[\%H = \ dfrac{4 \times (1,008 \;а.е.м.)}{16,043\; amu} = 0,251 = 25,1\%\]
Более сложный пример: сахароза (столовый сахар) содержит 42,11% углерода, 6,48% водорода и 51,41% кислорода по массе. Это означает, что 100,00 г сахарозы всегда содержат 42,11 г углерода, 6,48 г водорода и 51,41 г кислорода. Сначала молекулярная формула сахарозы (C 12 H 22 O 11 ) используется для расчета массовой доли составляющих элементов; массовое процентное содержание затем можно использовать для определения эмпирической формулы .
Согласно молекулярной формуле, каждая молекула сахарозы содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода. Таким образом, моль молекул сахарозы содержит 12 моль атомов углерода, 22 моль атомов водорода и 11 моль атомов кислорода. Эту информацию можно использовать для расчета массы каждого элемента в 1 моль сахарозы, что дает молярную массу сахарозы. Затем эти массы можно использовать для расчета процентного состава сахарозы. С точностью до трех знаков после запятой расчеты следующие:
Таким образом, моль молекул сахарозы содержит 12 моль атомов углерода, 22 моль атомов водорода и 11 моль атомов кислорода. Эту информацию можно использовать для расчета массы каждого элемента в 1 моль сахарозы, что дает молярную массу сахарозы. Затем эти массы можно использовать для расчета процентного состава сахарозы. С точностью до трех знаков после запятой расчеты следующие:
\[ \text {масса С/моль сахарозы} = 12 \, моль \, С \ раз {12,011 \, г \, С \ над 1 \, моль \, С} = 144,132 \, г \, C \label{3.3.1a}\]
\[ \text {масса H/моль сахарозы} = 22 \, моль \, H \times {1,008 \, г \, H \над 1 \, моль \ , H} = 22,176 \, г \, C \label{3.3.1b}\]
\[ \text {масса O/моль сахарозы} = 11 \, моль \, O \times {15,999 \, г \, O \над 1 \, моль \, O} = 175,989 \, г \, O \label{3.3.1c}\]
Таким образом, 1 моль сахарозы имеет массу 342,297 г; отметить, что более половины массы (175,989 г) составляет кислород, а почти половину массы (144,132 г) составляет углерод.
Массовая доля каждого элемента в сахарозе представляет собой массу элемента, присутствующего в 1 моль сахарозы, деленную на молярную массу сахарозы, умноженную на 100 для получения процента. Результат представлен с точностью до двух знаков после запятой:
Результат представлен с точностью до двух знаков после запятой:
\[ \text {масса % C в сахарозе} = {\text {масса C/моль сахарозы} \over \text {молярная масса сахарозы} } \times100 = {144,132 \, г \, С \ более 342,297 \, г/моль } \ умножить на 100 = 42,12 \% \]
\[ \text {масса % H в сахарозе} = {\text {масса H/моль сахарозы} \over \text {молярная масса сахарозы}} \times100 = {22,176 \, г \, H \более 342,297 \, г/моль} \times 100 = 6,48 \% \]
\[ \text {масса % O в сахарозе} = {\text {масса O/моль сахарозы} \over \text {молярная масса сахарозы} } \times100 = {175,989 \, г \, O \более 342,297 \, г/моль} \times 100 = 51,41 \% \]
Это можно проверить, проверив, что сумма процентов всех элементов в состав 100%:
\[ 42,12\% + 6,48\% + 51,41\% = 100,01\%\]
Если сумма не равна 100%, в расчетах допущена ошибка. (Однако округление до правильного числа знаков после запятой может привести к тому, что общее количество будет немного отличаться от 100%. ) Таким образом, 100,00 г сахарозы содержат 42,12 г углерода, 6,48 г водорода и 51,41 г кислорода; до двух знаков после запятой процентный состав сахарозы действительно составляет 42,12% углерода, 6,48% водорода и 51,41% кислорода.
) Таким образом, 100,00 г сахарозы содержат 42,12 г углерода, 6,48 г водорода и 51,41 г кислорода; до двух знаков после запятой процентный состав сахарозы действительно составляет 42,12% углерода, 6,48% водорода и 51,41% кислорода.
Также возможно рассчитать массовые проценты, используя атомные массы и молекулярные массы, с атомными единицами массы. Поскольку ответ представляет собой отношение, выраженное в процентах, единицы массы отменяют, являются ли они граммами (с использованием молярных масс) или атомными единицами массы (с использованием атомных и молекулярных масс).
Пример \(\PageIndex{1}\)
Аспартам — искусственный подсластитель, продаваемый как NutraSweet и Equal. Его молекулярная формула C 14 H 18 N 2 O 5 .
- Рассчитайте массовую долю каждого элемента в аспартаме.
- Рассчитайте массу углерода в упаковке Equal массой 1,00 г, предполагая, что это чистый аспартам.

Дано : молекулярная формула и масса образца
Запрошено : массовая доля всех элементов и масса одного элемента в образце молярная масса аспартама.
Раствор :
а.
A Рассчитаем массу каждого элемента в 1 моль аспартама и молярную массу аспартама, здесь до трех знаков после запятой:
\[ 14 \,С (14 \, моль \, С)(12,011 \, г/моль \, С) = 168,154 \, г\]
\[ 18 \,Н (18 \, моль \, Н)(1,008 \, г/моль \, Н) = 18,114 \, г\]
\[ 2 \,N (2 \, моль \, N)(14,007 \, г/моль \, N) = 28,014 \, г\]
\[ +5 \,O (5 \, моль \, O)(15,999 \, г/моль \, O) = 79,995 \, г\]
\[C_{14}H_ {18}N_2O_5 \text {молярная масса аспартама} = 294,277 \, г/моль \]
Таким образом, более половины массы 1 моля аспартама (294,277 г) составляет углерод (168,154 г).
B Чтобы вычислить массовый процент каждого элемента, мы делим массу каждого элемента в соединении на молярную массу аспартама, а затем умножаем на 100, чтобы получить проценты, здесь представленные с точностью до двух знаков после запятой:
\[ масса \%\, C = {168,154 \, г \, C \ более 294,277 \, г \, аспартам } \times 100 = 57,14 \% C\]
\[масса \% \, H = {18,114 \, г \, H \свыше 294,277 \, г \, аспартам } \times 100 = 6,16 \% H\]
\[масса \% \, N = {28,014 \, г \, N \свыше 294,277 \, г \, аспартам } \× 100 = 9,52 \% \]
\[масса \% \, O = {79,995 \, г \, O \свыше 294,277 \, г \, аспартам } \× 100 = 27.18 \% \]
В качестве проверки, мы можем сложить проценты вместе:
\[ 57.14\% + 6.16\% + 9.52\% + 27.18\% = 100.00\% \]
Если получится сумма которое отличается от 100% более чем на ±1%, где-то в расчете должна быть ошибка.
б. C Масса углерода в 1,00 г аспартама рассчитывается следующим образом:
\[ \text {масса С} = 1,00 \, г \, аспартам \ раз {57,14 \, г \, С \ более 100 \, г \, аспартам} = 0,571 \, г \, С \]
Упражнение \(\PageIndex{1}\): Оксид алюминия
Рассчитайте массовую долю каждого элемента в оксиде алюминия (Al 2 O 3 ). Затем рассчитайте массу алюминия в образце чистого оксида алюминия массой 3,62 г.
Затем рассчитайте массу алюминия в образце чистого оксида алюминия массой 3,62 г.
Ответ : 52,93% алюминия; 47,08% кислорода; 1,92 г Al
Процент Состав: https://youtu.be/HNS6lItns10
Определение эмпирической формулы пенициллина
Точно так же, как эмпирическая формула вещества может быть использована для определения его процентного состава, процентный состав образца может быть использован для определения его эмпирической формулы, которая затем может быть использована для определения его молекулярная формула. Такая процедура фактически использовалась для определения эмпирической и молекулярной формул первого открытого антибиотика: пенициллина.
Антибиотики представляют собой химические соединения, избирательно убивающие микроорганизмы, многие из которых вызывают заболевания. Хотя сегодня антибиотики часто воспринимаются как нечто само собой разумеющееся, пенициллин был открыт всего около 80 лет назад. Последующая разработка широкого спектра других антибиотиков для лечения многих распространенных заболеваний в значительной степени способствовала существенному увеличению ожидаемой продолжительности жизни за последние 50 лет. Открытие пенициллина — исторический детектив, в котором ключевую роль сыграло использование массовых процентов для определения эмпирических формул.
Последующая разработка широкого спектра других антибиотиков для лечения многих распространенных заболеваний в значительной степени способствовала существенному увеличению ожидаемой продолжительности жизни за последние 50 лет. Открытие пенициллина — исторический детектив, в котором ключевую роль сыграло использование массовых процентов для определения эмпирических формул.
В 1928 году Александр Флеминг, молодой микробиолог из Лондонского университета, работал с распространенной бактерией, вызывающей фурункулы и другие инфекции, такие как заражение крови. Для лабораторных исследований бактерии обычно выращивают на поверхности геля, содержащего питательные вещества, в небольших плоских культуральных чашках. Однажды Флеминг заметил, что одна из его культур была заражена голубовато-зеленой плесенью, похожей на ту, что встречается на испорченном хлебе или фруктах. Такие несчастные случаи случаются довольно часто, и большинство лаборантов просто выбросило бы культуры. Флеминг, однако, заметил, что бактерии росли повсюду на геле, за исключением области, загрязняющей плесень (часть (а) на рис. \(\PageIndex{2}\)), и предположил, что плесень должна производить вещество, которое либо убили бактерии или предотвратили их рост. Чтобы проверить эту гипотезу, он вырастил плесень в жидкости, а затем профильтровал жидкость и добавил ее к различным культурам бактерий. Жидкость убила не только бактерии, которые первоначально изучал Флеминг, но и широкий спектр других болезнетворных бактерий. Поскольку плесень принадлежала к семейству Penicillium (названному так из-за их карандашевидных ответвлений под микроскопом) (часть (b) на рисунке \(\PageIndex{2}\)), Флеминг назвал активный ингредиент бульона пенициллином.
\(\PageIndex{2}\)), и предположил, что плесень должна производить вещество, которое либо убили бактерии или предотвратили их рост. Чтобы проверить эту гипотезу, он вырастил плесень в жидкости, а затем профильтровал жидкость и добавил ее к различным культурам бактерий. Жидкость убила не только бактерии, которые первоначально изучал Флеминг, но и широкий спектр других болезнетворных бактерий. Поскольку плесень принадлежала к семейству Penicillium (названному так из-за их карандашевидных ответвлений под микроскопом) (часть (b) на рисунке \(\PageIndex{2}\)), Флеминг назвал активный ингредиент бульона пенициллином.
Рисунок \(\PageIndex{2}\) Penicillium. (a) Плесень Penicillium растет в чашке для культивирования; фото показывает его влияние на рост бактерий. (б) На этой микрофотографии Penicillium видны его палочковидные и карандашевидные ветви. Название происходит от латинского penicillus, что означает «кисть».
Хотя Флемингу не удалось выделить пенициллин в чистом виде, медицинское значение его открытия стимулировало исследователей в других лабораториях. Наконец, в 1940, два химика из Оксфордского университета, Говард Флори (1898–1968) и Эрнст Чейн (1906–1979), смогли выделить активный продукт, который они назвали пенициллином G. В течение трех лет пенициллин G стал широко использоваться для лечения пневмония, гангрена, гонорея и другие заболевания, и его применение значительно увеличило выживаемость раненых солдат во Второй мировой войне. В результате своей работы Флеминг, Флори и Чейн разделили Нобелевскую премию по медицине в 1945 году. далее в этом разделе), чтобы определить, какие элементы присутствовали и в каких количествах. Результаты таких анализов обычно представляют в виде массовых процентов. Они обнаружили, что типичный образец пенициллина G содержит 53,9% углерода, 4,8% водорода, 7,9% азота, 9,0% серы и 6,5% натрия по массе. Сумма этих чисел составляет всего 82,1%, а не 100,0%, что означает, что должен быть один или несколько дополнительных элементов. Разумным кандидатом является кислород, который является обычным компонентом соединений, содержащих углерод и водород; не думайте, что «недостающая» масса всегда связана с кислородом.
Наконец, в 1940, два химика из Оксфордского университета, Говард Флори (1898–1968) и Эрнст Чейн (1906–1979), смогли выделить активный продукт, который они назвали пенициллином G. В течение трех лет пенициллин G стал широко использоваться для лечения пневмония, гангрена, гонорея и другие заболевания, и его применение значительно увеличило выживаемость раненых солдат во Второй мировой войне. В результате своей работы Флеминг, Флори и Чейн разделили Нобелевскую премию по медицине в 1945 году. далее в этом разделе), чтобы определить, какие элементы присутствовали и в каких количествах. Результаты таких анализов обычно представляют в виде массовых процентов. Они обнаружили, что типичный образец пенициллина G содержит 53,9% углерода, 4,8% водорода, 7,9% азота, 9,0% серы и 6,5% натрия по массе. Сумма этих чисел составляет всего 82,1%, а не 100,0%, что означает, что должен быть один или несколько дополнительных элементов. Разумным кандидатом является кислород, который является обычным компонентом соединений, содержащих углерод и водород; не думайте, что «недостающая» масса всегда связана с кислородом. Это может быть любой другой элемент. Однако по техническим причинам провести прямой анализ на содержание кислорода затруднительно. Если предположить, что вся недостающая масса приходится на кислород, то пенициллин G содержит (100,0% — 82,1%) = 17,9% кислорода. Из этих массовых процентов можно определить эмпирическую формулу и, в конечном итоге, молекулярную формулу соединения.
Это может быть любой другой элемент. Однако по техническим причинам провести прямой анализ на содержание кислорода затруднительно. Если предположить, что вся недостающая масса приходится на кислород, то пенициллин G содержит (100,0% — 82,1%) = 17,9% кислорода. Из этих массовых процентов можно определить эмпирическую формулу и, в конечном итоге, молекулярную формулу соединения.
Чтобы определить эмпирическую формулу из массовых процентов элементов в таком соединении, как пенициллин G, массовые проценты должны быть преобразованы в относительное число атомов. Для удобства предположим, что образец соединения весит 100,0 г, хотя размеры образцов, используемых для анализа, обычно намного меньше, обычно в миллиграммах. Это предположение упрощает арифметику, поскольку 53,9% массового процента углерода соответствует 53,9 г углерода в 100,0 г образца пенициллина G; аналогично 4,8% водорода соответствует 4,8 г водорода в 100,0 г пенициллина G; и так далее для других элементов. Затем каждую массу делят на молярную массу элемента, чтобы определить, сколько молей каждого элемента присутствует в образце массой 100,0 г:
\[ { масса \, (г) \над молярной \,\, масса \,\ , (г/моль)} = (г) \влево ({моль \над г } \вправо ) = моль \label{3. 3.2a}\]
3.2a}\]
\[ 53,9\, г \, C \left ({1 \, моль \, C \более 12,011 \, г \, C} \right ) = 4,49 \, моль \, C \label{3.3.2b}\]
\ [ 4,8 \, г \, H \left ({1 \, моль \, H \более 1,008 г \, H} \right ) = 4,8 \, моль \, H \label{3.3.2c}\]
\ [ 7,9 \, г \, N \ влево ({1 \, моль \, N \ более 14,007 \, г \, N} \ вправо ) = 0,56 \, моль \, N \label{3.3.2d}\]
\[ 9 \, г \, S \слева ({1 \, моль \, S \свыше 32,065 \, г \, S} \справа ) = 0,28 \, моль \, S \label{3.3.2e}\ ]
\[ 6,5 \, г \, Na \ левый ({1 \, моль \, Na \ более 22,990 \, г \, Na} \right ) = 0,28 \, моль \, Na \label{3.3.2f}\]
Таким образом, в 100,0 г пенициллина G содержится 4,49 моль углерода, 4,8 моль водорода, 0,56 моль азота, 0,28 моль серы, 0,28 моль натрия и 1,12 моль кислорода (при условии, что вся недостающая масса была кислородом). Число значащих цифр в числах молей элементов колеблется от двух до трех, поскольку некоторые аналитические данные сообщались только с двумя значащими цифрами.
Эти результаты дают соотношение молей различных элементов в образце (4,49моль углерода к 4,8 моль водорода к 0,56 моль азота и т. д.), но они не являются целочисленными отношениями, необходимыми для эмпирической формулы — эмпирическая формула выражает относительное число атомов в наименьших возможных целых числах. Чтобы получить целые числа, разделите количество молей всех элементов в образце на количество молей элемента, присутствующего в наименьшем относительном количестве, которым в данном примере является сера или натрий. Результаты будут индексами элементов в эмпирической формуле. До двух значащих цифр результаты следующие:
\[C: {4,49 \более 0,28} = 16 \, \, \, \, \, H: {4,8 \более 0,28} = 17 \, \, \, \, \, N: {0,56 \более 0,28} = 2,0 \label{3.3.3a}\]
\[S: {0,28 \более 0,28 } = 1,0 \, \, \, \, \, Na: {0,28 \более 0,28 } = 1,0 \, \ , \, \, \, O: {1,12 \over 0,28} = 4,0 \label{3.3.3b}\]
Таким образом, эмпирическая формула пенициллина G будет C 16 H 17 N 2 NaO 4 S. Другие эксперименты показали, что пенициллин G на самом деле является ионным соединением, содержащим Na 9катионы 0949 + и анионы [C 16 H 17 N 2 O 4 S] − в соотношении 1:1. Сложная структура пенициллина G (рисунок \(\PageIndex{3}\)) не была определена до 1948 года.
Другие эксперименты показали, что пенициллин G на самом деле является ионным соединением, содержащим Na 9катионы 0949 + и анионы [C 16 H 17 N 2 O 4 S] − в соотношении 1:1. Сложная структура пенициллина G (рисунок \(\PageIndex{3}\)) не была определена до 1948 года.
В некоторых случаях один или несколько индексов в формуле, рассчитанной с помощью этой процедуры, могут не быть целыми числами. Означает ли это, что интересующее соединение содержит нецелое число атомов? Нет; ошибки округления в расчетах, а также экспериментальные ошибки в данных могут привести к нецелочисленным отношениям. Когда это происходит, следует проявлять осторожность при интерпретации результатов, как показано в примере 6. В частности, отношения 1,50, 1,33 или 1,25 предполагают, что вы должны умножить все индексы в формуле на 2, 3 или 4 соответственно. Только если отношение находится в пределах 5% от целочисленного значения, следует рассмотреть возможность округления до ближайшего целого числа.
Пример \(\PageIndex{2}\): фосфат кальция в зубной пасте
Рассчитайте эмпирическую формулу ионного соединения фосфата кальция, основного компонента удобрения и полирующего агента в зубных пастах. Элементный анализ показывает, что он содержит 38,77% кальция, 19,97% фосфора и 41,27% кислорода.
Дано : состав в процентах
Запрошено : эмпирическая формула
Стратегия :
- Возьмем образец весом 100 г и рассчитаем число молей каждого элемента в этом образце.
- Получите относительное количество атомов каждого элемента в соединении, разделив количество молей каждого элемента в 100-граммовой пробе на количество молей элемента, присутствующего в наименьшем количестве.
- Если отношения не являются целыми числами, умножьте все индексы на одно и то же число, чтобы получить целые значения.
- Поскольку это ионное соединение, определите анион и катион и напишите формулу так, чтобы заряды были сбалансированы.

Решение :
A Образец 100 г фосфата кальция содержит 38,77 г кальция, 19,97 г фосфора и 41,27 г кислорода. Разделив массу каждого элемента в 100-граммовой пробе на его молярную массу, мы получим число молей каждого элемента в пробе:
\[ \text {моль Ca} = 38,77 \, г \, Ca \times {1 \ , моль \, Ca \свыше 40,078 \, г \, Ca} = 0,9674 \, моль \, Ca\]
\[ \text {моль P} = 19,97 \, г \, P \times {1 \, моль \, P \свыше 30,9738 \, г \, P} = 0,6447 \, моль \, Ca\]
\[ \text {моль О} = 41,27 \, г \, О \ раз {1 \, моль \, О \свыше 15,9994 \, г \, О} = 2,5800 \, моль \, О\]
B Чтобы получить относительное количество атомов каждого элемента в соединении, разделите количество молей каждого элемента в 100-граммовой пробе на количество молей элемента в наименьшем количестве, в данном случае фосфора:
\[P: {0,6447 \, моль\, P \более 0,6447 \, моль\, P} = 1,000 \, \, \, \, Ca: {0,9674 \более 0,6447} = 1,501\, \, \, \ , О: {2,5800\более 0,6447}= 4,002\]
C Мы могли бы записать эмпирическую формулу фосфата кальция как Ca 1,501 P 1,000 O 4,002 , но эмпирическая формула должна показывать отношения элементов в виде небольших целых чисел. Чтобы преобразовать результат в интегральную форму, умножьте все индексы на 2, чтобы получить Ca 3,002 P 2,000 O 8,004 . Отклонение от интегральных атомных отношений невелико и может быть объяснено небольшими экспериментальными ошибками; следовательно, эмпирическая формула Ca 3 Р 2 О 8 .
Чтобы преобразовать результат в интегральную форму, умножьте все индексы на 2, чтобы получить Ca 3,002 P 2,000 O 8,004 . Отклонение от интегральных атомных отношений невелико и может быть объяснено небольшими экспериментальными ошибками; следовательно, эмпирическая формула Ca 3 Р 2 О 8 .
D Ион кальция (Ca 2 + ) является катионом, поэтому для поддержания электронейтральности фосфор и кислород должны образовывать многоатомный анион. Из главы 2 «Молекулы, ионы и химические формулы» мы знаем, что фосфор и кислород образуют ион фосфата (PO 4 3 − ; см. Таблицу 2.4). Поскольку в эмпирической формуле два атома фосфора, должны присутствовать два иона фосфата. Поэтому запишем формулу фосфата кальция как Ca 3 (ПО 4 ) 2 .
Упражнение \(\PageIndex{2}\): Бомбардировка в Оклахома-Сити
Рассчитайте эмпирическую формулу нитрата аммония, ионного соединения, содержащего 35,00 % азота, 5,04 % водорода и 59,96 % кислорода по массе. Хотя аммиачная селитра широко используется в качестве удобрения, она может быть взрывоопасной. Например, это был основной компонент взрывчатки, использованной при взрыве в Оклахома-Сити в 1995 году.
Хотя аммиачная селитра широко используется в качестве удобрения, она может быть взрывоопасной. Например, это был основной компонент взрывчатки, использованной при взрыве в Оклахома-Сити в 1995 году.
Федеральное здание имени Альфреда П. Мурра, разрушенное в Оклахома-Сити в результате бомбардировки химическими взрывчатыми веществами (быстрые химические реакции, в результате которых выделяется огромное количество газов).
Answer
N 2 H 4 O 3 is NH 4 + NO 3 − , written as NH 4 NO 3
Determining Эмпирическая и молекулярная формулы от % состава: https://youtu.be/E-MxBYw1TSI
От эмпирической формулы к молекулярной формуле
Эмпирическая формула дает только относительное число атомов в веществе в наименьшем возможном соотношении. Для ковалентного вещества химиков обычно больше интересует молекулярная формула, которая дает фактическое количество атомов каждого вида, присутствующих в молекуле. Однако без дополнительной информации невозможно узнать, является ли формула пенициллина G, например, C 16 H 17 N 2 NaO 4 S or an integral multiple, such as C 32 H 34 N 4 Na 2 O 8 S 2 , C 48 H 51 N 6 Na 3 O 12 S 3 , or (C 16 H 17 N 2 NaO 4 S) n , where n is целое число. (Фактическая структура пенициллина G показана на рисунке \(\PageIndex{3}\)).
Для ковалентного вещества химиков обычно больше интересует молекулярная формула, которая дает фактическое количество атомов каждого вида, присутствующих в молекуле. Однако без дополнительной информации невозможно узнать, является ли формула пенициллина G, например, C 16 H 17 N 2 NaO 4 S or an integral multiple, such as C 32 H 34 N 4 Na 2 O 8 S 2 , C 48 H 51 N 6 Na 3 O 12 S 3 , or (C 16 H 17 N 2 NaO 4 S) n , where n is целое число. (Фактическая структура пенициллина G показана на рисунке \(\PageIndex{3}\)).
Возьмем глюкозу, сахар, который циркулирует в нашей крови и служит топливом для тела и мозга. Результаты анализа сгорания глюкозы показывают, что глюкоза содержит 39,68% углерода и 6,58% водорода. Поскольку горение происходит в присутствии кислорода, невозможно напрямую определить процентное содержание кислорода в соединении с помощью анализа горения; необходимы другие более сложные методы. Если предположить, что оставшийся процент приходится на кислород, то глюкоза будет содержать 53,79% кислорода. Таким образом, образец глюкозы массой 100,0 г будет содержать 39,68 г углерода, 6,58 г водорода и 53,79 г кислорода. Чтобы рассчитать количество молей каждого элемента в пробе массой 100,0 г, разделите массу каждого элемента на его молярную массу:
Если предположить, что оставшийся процент приходится на кислород, то глюкоза будет содержать 53,79% кислорода. Таким образом, образец глюкозы массой 100,0 г будет содержать 39,68 г углерода, 6,58 г водорода и 53,79 г кислорода. Чтобы рассчитать количество молей каждого элемента в пробе массой 100,0 г, разделите массу каждого элемента на его молярную массу:
\[ моль \, C = 39,68 \, г \, C \ раз {1 \, моль \ , C \более 12,011 \, г \, C } = 3,304 \, моль \, C \label{3.3.4a}\]
\[ молей \, H = 6,58 \, г \, H \times {1 \ , моль \, H \более 1,0079 \, г \, H } = 6,53 \, моль \, H \label{3.3.4b}\]
\[ моль \, O = 53,79 \, г \, O \times {1 \, моль \, O \более 15,9994 \, г \, O } = 3,362 \, моль \, O \label{3.3.4c } \]
Еще раз, индексы элементов в эмпирической формуле находятся путем деления числа молей каждого элемента на число молей элемента, присутствующего в наименьшем количестве:
\[ C: {3.304 \более 3,304} = 1,000 \, \, \, \, H: {6,53 \более 3,304} = 1,98 \, \, \, \, O: {3,362 \более 3,304} = 1,018 \]
Кислород:углерод отношение равно 1,018 или приблизительно 1, а отношение водорода к углероду равно приблизительно 2. Таким образом, эмпирическая формула глюкозы представляет собой CH 2 O, но какова его молекулярная формула?
Таким образом, эмпирическая формула глюкозы представляет собой CH 2 O, но какова его молекулярная формула?
Многие известные соединения имеют эмпирическую формулу CH 2 O, включая формальдегид, который используется для сохранения биологических образцов и обладает свойствами, сильно отличающимися от сахара, циркулирующего в крови. На данный момент неизвестно, является ли глюкоза CH 2 O, C 2 H 4 O 2 или какой-либо другой (CH 2 O) n . Однако экспериментально определенная молярная масса глюкозы (180 г/моль) может быть использована для решения этой дилеммы.
Сначала вычислите формульную массу, молярную массу формульной единицы, которая представляет собой сумму атомных масс элементов в эмпирической формуле, умноженную на их соответствующие индексы. Для глюкозы
\[ \text {формульная масса} CH_2O = \left [ 1 \, моль C \left ( {12.011 \, g \over 1 \, моль \, C} \right ) \right ] + \ влево [ 2 \, моль \, H \влево ({1,0079 \, г \над 1 \, моль \, H }\вправо )\вправо ] + \влево [ 1 \, моль \, O \влево ( {15,5994 \ , моль \, O \над 1 \, моль \, O} \right ) \right ] = 30,026 г \label{3. 3.5}\]
3.5}\]
Это намного меньше наблюдаемой молекулярной массы 180 г/моль.
Во-вторых, определите количество формульных единиц на моль. Для глюкозы рассчитайте количество (CH 2 O) единиц, то есть n в (CH 2 O) n , путем деления молярной массы глюкозы на формулу массы CH 2 O. :
\[n={180 \, г \свыше 30,026\, г/CH_2O} = 5,99 \приблизительно 6 CH_2O \, \text {формульные единицы} \label{3.3.6}\]
Каждая глюкоза содержит шесть Ч. 2 O формульные единицы, что дает молекулярную формулу глюкозы (CH 2 O) 6 , которая чаще записывается как C 6 H 12 O 6 . Молекулярные структуры формальдегида и глюкозы, оба из которых имеют эмпирическую формулу CH 2 O, показаны на рисунке \(\PageIndex{4}\).
Рисунок \(\PageIndex{4}\) Структурные формулы и шарико-стержневые модели формальдегида (a) и глюкозы (b)Пример \(\PageIndex{3}\): кофеин
Рассчитайте молекулярную формулу кофеина, соединения, содержащегося в кофе, чае и напитках колы, которое оказывает заметное стимулирующее действие на млекопитающих. Химический анализ кофеина показывает, что он содержит 49,18 % углерода, 5,39 % водорода, 28,65 % азота и 16,68 % кислорода по массе, а его экспериментально определенная молярная масса составляет 196 г/моль.
Химический анализ кофеина показывает, что он содержит 49,18 % углерода, 5,39 % водорода, 28,65 % азота и 16,68 % кислорода по массе, а его экспериментально определенная молярная масса составляет 196 г/моль.
Дано : состав в процентах и молярная масса
Запрошено : молекулярная формула
Стратегия :
- Предположим, 100 г кофеина. Используя данные проценты, используйте процедуру, приведенную в примере 6, для расчета эмпирической формулы кофеина.
- Рассчитайте формульную массу, а затем разделите экспериментально определенную молярную массу на формульную массу. Это дает количество присутствующих формульных единиц.
- Умножьте каждый нижний индекс в эмпирической формуле на количество формульных единиц, чтобы получить молекулярную формулу.
Решение :
A Начнем с деления массы каждого элемента в 100,0 г кофеина (49,18 г углерода, 5,39 г водорода, 28,65 г азота, 16,68 г кислорода) на его молярную массу. Это дает количество молей каждого элемента в 100 г кофеина.
Это дает количество молей каждого элемента в 100 г кофеина.
\[моль\, С=49,18\,г\,С\раз{1\,моль\,С\более 12,011\,г\,С} = 4,095\,моль\,С\]
\[ моль \, H = 5,39 \, г \, H \times {1 \, моль \, H \более 1,0079 \, г \, H} = 5,35 \, моль \, H \]
\[ моль \, N = 28,65 \, г \, Н \ раз {1 \, моль \, Н \ более 14,0067 \, г \, N} = 2,045 \, моль \, Н \]
\[моль\, О=16,68\,г\,О\раз{1\,моль\,О\свыше 15,9994\,г\,О} = 1,043\,моль\,О\]
Для получения относительное количество атомов каждого присутствующего элемента, разделить количество молей каждого элемента на количество молей элемента, присутствующего в наименьшем количестве:
\[O: {1,043 \over 1,043} = 1,000 \, \, \, \, C: {4,095 \более 1,043} = 3,926 \, \, \, \, H: {5,35 \более 1,043} = 5,13 \, \, \, \, N: {2,045 \более 1,043} = 1,960 \]
Эти результаты довольно типичны для реальных экспериментальных данных. Ни одно из атомных соотношений не является точно целым, но все они находятся в пределах 5% от интегральных значений. Так же, как и в примере 6, разумно предположить, что такие небольшие отклонения от интегральных значений связаны с незначительными экспериментальными ошибками, поэтому округлить до ближайшего целого числа. Эмпирическая формула кофеина, таким образом, C 4 H 5 N 2 O.
Так же, как и в примере 6, разумно предположить, что такие небольшие отклонения от интегральных значений связаны с незначительными экспериментальными ошибками, поэтому округлить до ближайшего целого числа. Эмпирическая формула кофеина, таким образом, C 4 H 5 N 2 O.
B Молекулярная формула кофеина может быть C 4 H 5 N 2 O. Чтобы определить реальную молекулярную формулу, мы должны разделить экспериментально определенную молярную массу на формульную массу. Формула массы вычисляется следующим образом:
\[ 4С \, \, \, ( 4 \, атомов \, С) (12,011 \, г/ атом \, С) = 48,044 \, г \]
\[ 5H \, \, \, ( 5 \, атомы \, H ) (1,0079\, г/ атом \, Н) = 5,0395 \, г \]
\[ 2N \, \, \, (2 \, атом \, N) (14,0067 \, г/ атом \, N) = 28,0134 \ , г \]
\[ +1O \, \, \, (1 \, атом \, О) (15,9994 \, г/атом \, О) = 15,9994 \, г \]
\[ C_4H_5N_2O \, \, \, \, \text {формульная масса кофеина} = 97,096 \, г \]
Деление измеренной молярной массы кофеина (196 г/моль) на расчетную формульную массу дает
\[ {196 г/ моль \свыше 97,096 г/C_4H_5N_2O } = 2,02 \ок 2\, C_4H_5N_2O \, \text {эмпирические формульные единицы} \]
C В кофеине две формульные единицы C 4 H 5 N 2 O, поэтому молекулярная формула должна быть (C 4 H 5 N 2 30 O) 2 90 8 Н 10 Н 4 О 2 . Структура кофеина следующая:
Структура кофеина следующая:
Упражнение \(\PageIndex{3}\): Фреон-114
Рассчитайте молекулярную формулу фреона-114, который содержит 13,85% углерода, 41,89% хлора и 44,06% фтора. Экспериментально измеренная молярная масса этого соединения составляет 171 г/моль. Как и фреон-11, фреон-114 является широко используемым хладагентом, который способствует разрушению озонового слоя.
Ответ :
\[C_2Cl_2F_4\]
Анализ горения
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализом горения. Небольшой тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и/или серу, сжигают в атмосфере кислорода. Другие элементы, например металлы, можно определить другими методами. и количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 соответственно) определяют одним из нескольких возможных способов. Одна процедура, используемая при анализе горения, схематично показана на рисунке \(\PageIndex{5}\), а типичный анализ горения проиллюстрирован в примере \(\PageIndex{4}\).
Одна процедура, используемая при анализе горения, схематично показана на рисунке \(\PageIndex{5}\), а типичный анализ горения проиллюстрирован в примере \(\PageIndex{4}\).
Рисунок \(\PageIndex{5}\): Этапы получения эмпирической формулы из анализа горения
Пример \(\PageIndex{4}\)
Нафталин, активный соединение, содержащее только углерод и водород. Полное сгорание образца нафталина массой 20,10 мг в кислороде дало 690,00 мг СО 2 и 11,30 мг Н 2 О. Определите эмпирическую формулу нафталина.
Дано : масса пробы и масса продуктов сгорания
Запрошено : эмпирическая формула 2 O, для расчета масс углерода и водорода, присутствующих в исходной пробе нафталина.
Раствор :
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль CO 2 . Аналогично, 1 моль H 2 O образуется на каждые 2 моля атомов водорода, присутствующих в образце. Из этих соотношений можно рассчитать массы углерода и водорода в исходном образце, массы CO 9{-3}}= 1,250\]
Аналогично, 1 моль H 2 O образуется на каждые 2 моля атомов водорода, присутствующих в образце. Из этих соотношений можно рассчитать массы углерода и водорода в исходном образце, массы CO 9{-3}}= 1,250\]
Таким образом, нафталин содержит отношение молей углерода к молям водорода 1,25:1: C 1,25 H 1,0 . Поскольку отношения элементов в эмпирической формуле должны быть выражены в виде небольших целых чисел, умножьте оба нижних индекса на 4, что дает C 5 H 4 как эмпирическую формулу нафталина. Фактически, молекулярная формула нафталина C 10 H 8 , что согласуется с нашими результатами.
Упражнение \(\PageIndex{4}\)
- Ксилол, органическое соединение, которое является основным компонентом многих бензиновых смесей, содержит только углерод и водород. При полном сгорании навески ксилола массой 17,12 мг в кислороде образовалось 56,77 мг СО 2 и 14,53 мг Н 2 О.
 Определите эмпирическую формулу ксилола.
Определите эмпирическую формулу ксилола. - Эмпирическая формула бензола — CH (его молекулярная формула C 6 H 6 ). Если анализировать сжигание 10,00 мг бензола, какая масса СО 2 и H 2 O будут производиться?
Ответ :
- Эмпирическая формула C 4 H 5 . (Молекулярная формула ксилола на самом деле C 8 H 10 .)
- 33,81 мг CO 2 ; 6,92 мг H 2 O
Резюме
- Эмпирическую формулу вещества можно рассчитать по его процентному составу, а молекулярную формулу можно определить по эмпирической формуле и молекулярной массе соединения.
Эмпирическая формула вещества может быть рассчитана из экспериментально определенного процентного состава, процентного содержания каждого элемента, присутствующего в чистом веществе по массе. Во многих случаях эти проценты могут быть определены анализом горения.
 Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду: Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.

 Биомакромолекулы имеют большой субатомный вес и низкую растворимость. Кроме того, они имеют сложную настройку. Они присутствуют в сахарах, липидах, белках и нуклеиновых коррозионных веществах.
Биомакромолекулы имеют большой субатомный вес и низкую растворимость. Кроме того, они имеют сложную настройку. Они присутствуют в сахарах, липидах, белках и нуклеиновых коррозионных веществах.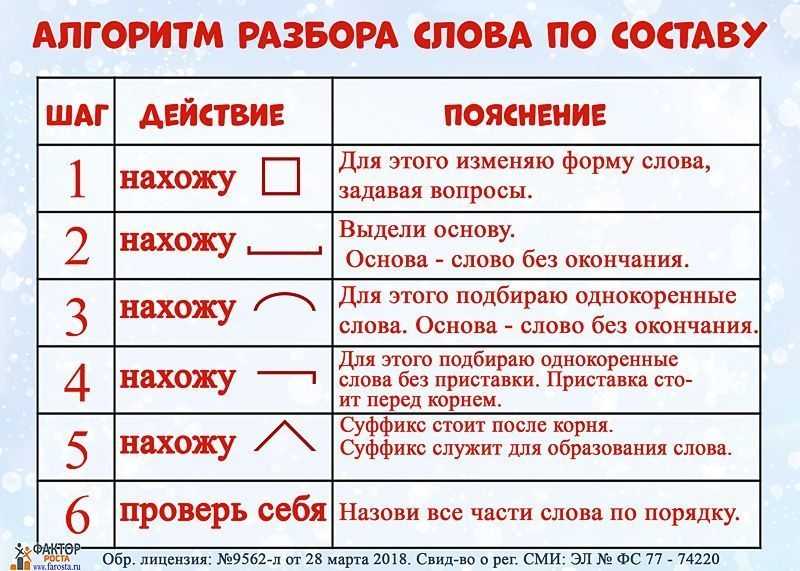 Вода – это неорганическое соединение, состоящее из водорода и кислорода. Это важное соединение в клетке.
Вода – это неорганическое соединение, состоящее из водорода и кислорода. Это важное соединение в клетке. Затем массу выделенного вещества сравнивают с массой исходного вещества образца.
Затем массу выделенного вещества сравнивают с массой исходного вещества образца.