разберите крылатая по составу потом ,бессердечная,смельчаков и накажу плиз срочно надо
Пожалуйста помогите, какие опорные слова в предложениях: достойный кандидат, первооткрыватель, профессиональная подготовка, человеческие качества, под … вергаться перегрузкам.
ПОМОГИТЕЕЕЕЕЕЕЕЕЕЕЕЕ
ПОМОГИТЕ СРОЧНО!!!подготовься к пересказу текста и запиши его. Странный заяц. Живёт во льдах страны заяц. Он не бегает,не скачет, а … ползает!И уши у него короткие.И задние ноги маленькие. И ест он не кору,не травку, а ракушек и рыбу.Это не простой заяц,а морской.Этот заяц-морской тюлень.А зайцем его назвали за длинные усы и глаза навыкате.
ДАЮ 50 БАЛОВ!!!
Вставьте пропущенные буквы:
на…стройка дома(д,т), по…твердить(д,т) решение, о…дать(д,т)
пре…писание(д,т), во_произвести (з,с),
… бе_словесный(3, с),
и),
и дать(з,с), пр_милый(е,и), пр_школьный (е,и),
пр открыть(е,и), ножниц_(ы,и), лисиц_н(ы,и),
вентиляц я(ы,и), ц_ган (ы,и), ц_рк(ы,и), пред дущий(и,ы),
сверх нтересный(ы,и), дез_нфекция(ы,и), пон_мать,
пост_лить, выч_тание, прил_жить, предпол_гать, недор сль,
подр_сти, прик_снуться, он разж_г дрова, приобрести по
деш.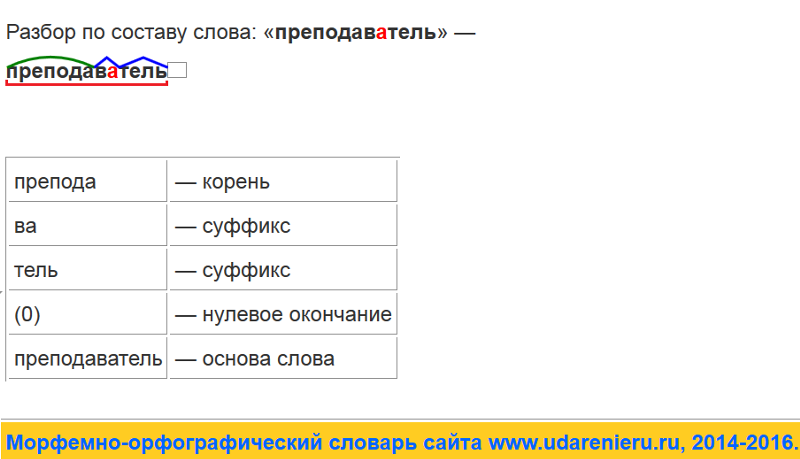
Спиши. Определи границы предложений Все дорожки покрылись снежным ковром гладким льдом оделась река на школьной площадке ребята устроили горку быстро … мчатся с горки вниз салазки. Срочно помогите!!!
Упражнения 515. Прочитайте текст. Запишите его. На противоположном берегу к озеру подходил невысокий холм
ПОМОГИТЕ СРОЧНО!!!подготовься к пересказу текста и запиши его.постарайся сохранить загадочность которую создаёт автор. Странный зая … ц. Живёт во льдах страны заяц. Он не бегает,не скачет, а ползает!И уши у него короткие.И задние ноги маленькие. И ест он не кору,не травку, а ракушек и рыбу.Это не простой заяц,а морской.Этот заяц-морской тюлень.А зайцем его назвали за длинные усы и глаза навыкате.
МИНИ СОЧИНЕНИЕ НА ТЕМУ; ЧТО ТАКОЕ НА ВАШ ВЗГЛЯД САМОВОСПИТАНИЕ? ДАЮ 20 БАЛЛОВ ТОЛЬКО ПОМОГИТЕ ПОЖАААЛУЙСТА!!
422) Спишите текст. Укажите спряжение глаголов в неопределённой форме. Природа Азербайджана– это своеобразная выставка красоты. И чтобы сохранить её, н
… еобходимо любить природу всей душой, любить свою Родину. Номало любить, нужно ещё заботиться о ней и охранять.
Природа Азербайджана– это своеобразная выставка красоты. И чтобы сохранить её, н
… еобходимо любить природу всей душой, любить свою Родину. Номало любить, нужно ещё заботиться о ней и охранять.
Ширина прямоугольника паралепипеда равна 6,3см что составляет 7/15 его длины а высота составляет 40% длины .Вычислить объем паралепипеда
Помогите разобрать слова по составу: вместе, здесь, потом. пожалуйста
Я, маленько, не поняла твой вопрос…
Если не правильно, то я не виновата:))
Ложь , печь, дочь , брошь, ночь..
Да, всё верно. Только в конце точка должна стоять)
У нашей собаки появились щенки —
До чего же они замечательные!
Однажды они исчезли.
Где же щенки?
Мы долго их искали.
Вот они, в коробке для овощей!
Ну как же она туда попали?
Мы очень рады, что они нашлись!
Заколотилось парной свежевымытый лишнее, потому что здесь страдательное причастие, а в остальных случаях действительное
Незнаю правильно или нет но мы писали так.После прочтения текста А.Приставкина моментально всплыли в памяти слова классика Л.Толстого: « Война не любезность, а самое гадкое в мире дело». Почти каждое предложение текста дает понять основную мысль: «дети… выражали самую низкую, самую адскую, разрушительную сущность войны: она била в зародыше, в зачатке…».Читая эти строки, задумываюсь: а вырастет ли из этих«крошечных людей, закутанных в тряпьё», обессиленных от тяжких испытаний, нормальный человек?Проблема эта психологическая, жизненно важная и актуальная особенно в наши дни. Автор считает, что дети, стоявшие на перроне —«посланцы оттуда, из будущего, несущие людям надежду на будущее». Я согласна с автором. Конечно, горько от того, что дети—« жалкие огарки» войны, но всё же радостно, что они«живые», спасённые, а значит, надежда на лучшее действительно есть.Сжимается сердце, когда вижу с экрана телевизора документальные кадры: измождённые в концлагере дети, торопясь, освобождают ручонки, чтобы показать варварам свой номер. Видя этот ужас, говорю себе: « Да будь ты проклята, война!»До недавнего времени о детях, как о жертвах войны, было написано не так уж много. В памяти лишь Ваня Солнцев из повести «Сын полка» В.Катаева да Кузьмёныши из произведения А.Приставкина « Ночевала тучка золотая».Плачу, читая воспоминания взрослых, уважаемых ныне людей о военном лихолетье, о времени их « счастливого» детства в документальной повести белорусской писательницы С.Алексиевич « Последние свидетели», где название книги говорит само за себя.Это текст-завещание, предостережение, напоминание всем нам! И это текст-надежда: семя, брошенное даже в черствую, жесткую почву, обязательно взрастёт; обязательно вырастет «шумящий колос», ведь жизнь победить нельзя.
Автор считает, что дети, стоявшие на перроне —«посланцы оттуда, из будущего, несущие людям надежду на будущее». Я согласна с автором. Конечно, горько от того, что дети—« жалкие огарки» войны, но всё же радостно, что они«живые», спасённые, а значит, надежда на лучшее действительно есть.Сжимается сердце, когда вижу с экрана телевизора документальные кадры: измождённые в концлагере дети, торопясь, освобождают ручонки, чтобы показать варварам свой номер. Видя этот ужас, говорю себе: « Да будь ты проклята, война!»До недавнего времени о детях, как о жертвах войны, было написано не так уж много. В памяти лишь Ваня Солнцев из повести «Сын полка» В.Катаева да Кузьмёныши из произведения А.Приставкина « Ночевала тучка золотая».Плачу, читая воспоминания взрослых, уважаемых ныне людей о военном лихолетье, о времени их « счастливого» детства в документальной повести белорусской писательницы С.Алексиевич « Последние свидетели», где название книги говорит само за себя.Это текст-завещание, предостережение, напоминание всем нам! И это текст-надежда: семя, брошенное даже в черствую, жесткую почву, обязательно взрастёт; обязательно вырастет «шумящий колос», ведь жизнь победить нельзя.
ДОМАШНЕЕ ЗАДАНИЕ Спишите, вставляя пропущенные буквы и знаки препинания. Во 2 и 3 предложениях подчеркни грамматическую основу. В предпоследнем предложении графически обозначь однородные члены. Выполни фонетический разбор слова: дятел. Составь схему первого предложения. Этажи леса. У птиц и зв..рьков в л..су есть свои эт..жи. Мышки кр..ты з..мл..ройки ж..вут в к..рнях — в самом низу. С..л..вьи тетерева в..ют гнёзда прямо (на)з..мле. Др..зды устраивают гнёзда (по)выше, (на)кустарниках. Дятел с..ницы совы ж..вут (в)дуплах д..рев..ев. А на самом в..рху селятся хищники: ястребы и ..рлы. | |
Составьте предложения с однородными членами и запишите их. Светит, но не греет; искали, но не нашли; яблоки, груши, и сливы; пишем, рисуем, читаем; собираются в стаи и улетают; жнёт, молотит, веет; на огородах и в садах. | Составьте предложения с однородными членами и запишите их. Светит, но не греет; искали, но не нашли; яблоки, груши, и сливы; пишем, рисуем, читаем; собираются в стаи и улетают; жнёт, молотит, веет; на огородах и в садах. |
Домашнее задание Прочитай. Расставь в каждом предложении знаки препинания. Спиши, вставляя пропущенные буквы и раскрывая скобки. Выдели грамматическую основу каждого предложения. Составь схемы 1, 2, 3 предложений. Дай характеристику первому предложению. Выполни разбор по составу слов: СКРИПКА, ФУТБОЛИСТОМ. Вика умеет петь а (с,С)вета умеет играть (на)скрипке. Данила хочет стать футболистом, но не хочет стать нападающим. Аня делает уроки а (н,Н)астя уже пошла гулять. Весной дни становятся дли(н,нн)ее а ночи к..роче. Ос..н?ю лист?я (на)б. | |
Домашнее задание Прочитай слова. Разбей слова на группы по орфограммам и спиши по столбикам. Каждую группу озаглавь. В каждый столбик допиши по 2 своих слова с той же орфограммой. Выполни фонетический разбор слова ОВЁС. Выполни разбор по составу: ЛЕСНИК, ЗВЁЗДНЫЙ. Праздник, лесник, овёс, спрос, сугроб, чудесный, моряк, звёздный, лесник, тропа, страна, радостный, стена, пищат, шкаф, рукав, местный, звезда, счастливый, лестница, книжка, малышка, варежка, озеро. | |
Домашнее задание Прочитай текст. Какова его тема? Какова его главная мысль? (Ответь письменно) Выпиши из текста предложения с однородными членами и составь их схемы. Разбери по составу слова: ХОДИЛИ, ПОКУПКАМИ, ПОМОЩНИК, МОРКОВКУ. В воскресенье мы с мамой пошли на рынок. Мы взяли с собой сумку для овощей и фруктов и несколько пакетов. Вот мы пришли на рынок. Здесь много народа. Но мама точно знает, что мы должны купить. В одной из палаток мы купили картофель, морковку, тыкву и кабачки. При выходе с рынка мы купили свёклу. Тяжелы покупки. Я несу пакеты, ведь я – помощник. | |
Домашнее задание Прочитай предложения. Составь из них текст. Запиши получившийся текст, вставляя пропущенные буквы и раскрывая скобки. Составь схему первого предложения. Выдели грамматическую основу во 2-м предложении и укажи части речи. Разбери по составу слова: ШИРОКОЕ, ГРУЗОВЫЕ, ПОДЪЕХАЛА. Слева (от)нашей д..ревни есть ш..рокое шо(с,сс)е. Это (при/е)в..зли новую мебель. Они в..зут (в)магазины разные товары. Вот (к)нашей к(а/о)литке под?ехала такая маш..на. Там ч..сто (про/а)езжают грузовые машины. | |
Домашнее задание Прочитай предложения. Спиши только предложения с однородными членами. Выдели в них грамматическую основу и укажи части речи и однородные члены. Составь схему каждого такого предложения. Выполни фонетический разбор слова ЕЛА, разбор по составу СОЛНЕЧНЫМ. Катя и (С,с)вета идут (в)кино. (У)Марины много игрушек и книг. Солнечным утром мы идём (на)пр..гулку. (М,м)осква, (С,с)уздаль, (В,в)ладимир, (П,п)лёс – старинные г..р..да (Р/р)о(с/сс)ии. Утки, гуси и леб..ди г..товятся (к)о/атлёту в тёплые кр..я. (Под)н..гами шуршит ковёр из ж..лтых, красных, б..рдовых листьев. Таня ела кашу и пила компот. (В)скв..реч?нике по(я/е)вились новые ж..льцы. | |
Домашнее задание Прочитай слова. Выпиши их в алфавитном порядке. У имён существительных укажи род и число, а у глаголов – время (прошедшее, настоящее или будущее). Выбери три слова и составь с ними предложение с однородными членами. Запиши , выдели грамматическую основу и составь схему этого предложения. (О,а)втобус, (а,о)бед, праз?ник, а(л,лл)ея, з..вод, ж..лтый, уж..н, м..чта, д..рога, ш..л, с..п..ги, т..традь, з..втракали, ежата, ч..сы, к..ртины, г..товила, ж..вотное, шурш..т, з..ботливый, учит.ль, м..двед..ца, обл..ко, оз..ро, кр..сивые, ч..йник, зел..нь, х..зяйничают, п..л..тенце, со?нце, лес?ница, ябл..ко. | |
Домашнее задание Прочитай. Спиши, вставляя пропущенные буквы, раскрывая скобки. Подумай, где надо поставить запятые. В 1, 2, 3 предложениях выдели подлежащее и сказуемое и укажи части речи. Дай характеристику предпоследнему и последнему предложениям и составь их схемы. Выполни разбор по составу слов ПОДРАСТАЮТ, СТЕБЕЛЬКИ. Выполни фонетический разбор слова ЛАЕТ. (На)смелого с. | |
ДОМАШНЕЕ ЗАДАНИЕ Спиши, вставляя пропущенные буквы и знаки препинания, раскрывая скобки. В 1 и 2 предложениях подчеркни грамматическую основу. Составь схемы этих предложений. В предпоследнем предложении графически обозначь однородные члены. Выполни фонетический разбор слова: дождь. Дож(д, т)ь стуч..л (по)крыше и тр..пал лист?я. Сверкнула молния и послышался ре..кий удар грома. Д..рога шла (на)п..д..ём и маш..нист с трудом (за)т..рмозил па….аж..рский состав. Ближний сугро(п,б) (на)питался в..дой и капли стали тенькать. | |
Домашнее задание Прочитай. Определи границы предложений. Спиши, вставляя пропущенные буквы, раскрывая скобки. В первом и последнем предложениях выдели подлежащее и сказуемое и укажи части речи. Дай характеристику предпоследнему предложению и составь его схему. Выполни разбор по составу слов ЖАВОРОНКИ, РОБКИЙ. Выполни фонетический разбор слова РОНЯЕТ. К..сой до(ш/ж)(т/д)ь ст..новит?ся всё мельче тучи нач..ли (раз)д..лят?ся на обл..ка чере(з/с) минуту (з..)бл..стел ро(б/п)кий луч со?нца б..рёзовая роща р..няет (с)в..твей капли д..ждя (с)в..сёлой песней в?ют?ся жаворонки (в)небе (в)т..ни папоротника п..р..л..вают?ся з..ркальные капли. | |
применение, виды. Как клеить жидкими гвоздями
Содержание статьи
Мы все наслышаны о жидких гвоздях. Это особый вид строительного клея, который может просто и быстро приклеить буквально все: гипсокартон, керамическая плитка, стекло, металл – этот состав можно назвать универсальным. Появился он не так уж давно, но уже покорил весь мир и активно используется при проведении строительных и ремонтных работ разной сложности. В зависимости от условий эксплуатации, материалов и поверхностей, которые будут приклеиваться, выбирают тот или иной вид жидких гвоздей. Попробуем разобраться, какие жидкие гвозди лучше выбрать и на что важно обратить внимание при покупке. Определимся со сферами применения жидких гвоздей и технологией монтажа.
Это особый вид строительного клея, который может просто и быстро приклеить буквально все: гипсокартон, керамическая плитка, стекло, металл – этот состав можно назвать универсальным. Появился он не так уж давно, но уже покорил весь мир и активно используется при проведении строительных и ремонтных работ разной сложности. В зависимости от условий эксплуатации, материалов и поверхностей, которые будут приклеиваться, выбирают тот или иной вид жидких гвоздей. Попробуем разобраться, какие жидкие гвозди лучше выбрать и на что важно обратить внимание при покупке. Определимся со сферами применения жидких гвоздей и технологией монтажа.
№1. Состав жидких гвоздей
Жидкие гвозди были придуманы в США. Там в 60-х годах компания Macco сначала решила расфасовывать обычный клей в индивидуальные картриджи для простоты использования. Спустя пару лет появилась новая разработка — Liquid Nails. За считанные годы жидкие гвозди массой преимуществ покорили американских пользователей, а на отечественный рынок они попали лишь в 90-х годах.
Основой для нового вида клея стал синтетический каучук с полимерными добавками. В качестве наполнителя использовали специальный сорт глины с повышенной пластичностью. В США в штате Техас сосредоточены огромные месторождения этой глины, там и находятся основные промышленные мощности большинства местных производителей. Вместо уникальной глины сегодня нередко используется обычный мел. Таким образом производители убиваю двух зайцев: с одной стороны, мел выступает в роли наполнителя, но в то же время он придает клею необходимый белый цвет, который по классической технологии достигается за счет добавления оксида титана. Клей с добавлением мела значительно уступает в плане качества.
Ранее в состав жидких гвоздей добавлялся толуол для улучшения адгезии и ацетон для ускорения высыхания. Повышенная токсичность этих веществ заставила отказаться от их применения. Впрочем, некоторые компании для удешевления состава до сих пор используют подобные добавки. Их клеи отличаются неприятным запахом и, как правило, подозрительно низкой ценой. В помещении такие составы ни в коем случае нельзя применять.
Их клеи отличаются неприятным запахом и, как правило, подозрительно низкой ценой. В помещении такие составы ни в коем случае нельзя применять.
№2. Жидкие гвозди: преимущества и недостатки
Уникальный состав и удобная форма упаковки позволяет говорить о многочисленных преимуществах жидких гвоздей:
- высочайшая прочность соединения. Состав может выдерживать нагрузку до 80 кг/см2;
- хорошая адгезия практически со всеми существующими материалами;
- простота в использовании;
- состав может применяться для склеивания не только ровных поверхностей, но и при неплотном прилегании материалов. Жидкие гвозди упрощают монтаж на криволинейные поверхности;
- такой клей не разрушает поверхность, не повреждает ее целостность, в отличие от обычных гвоздей;
- жидкие гвозди не подвержены коррозии;
- процесс монтажа проходит без шума, стуков, пыли и грязи;
- клей схватывается за считанные секунды;
- современные составы нетоксичны.
 Редкое исключение – сомнительная продукция безымянных компаний по неоправданно низкой цене;
Редкое исключение – сомнительная продукция безымянных компаний по неоправданно низкой цене; - высокая огнестойкость. Влагостойкость и морозостойкость характерна только для неопреновых составов, слабо выражена у клеев на водной основе;
- большинство составов имеют нерезкий, практически нейтральный запах;
- экономичный расход. Одна капля материала способна выдерживать нагрузку до 50 кг.
Недостатков у жидких гвоздей фактически нет, если не учитывать некоторые ограничения по использованию разных видов клея.
№3. Виды жидких гвоздей по типу растворителя
Тип использованного растворителя фактически определяет сферу применения состава. Сегодня выпускают такие виды жидких гвоздей:
- на синтетической основе;
- на водной основе.
Неопреновые жидкие гвозди изготавливаются на основе синтетического каучука. Такими составами можно клеить достаточно тяжелые конструкции, в т.ч. и металлические. Клей отлично переносит воздействие повышенной влажности, перепады температур, мороз, обеспечивает высокую скорость и прочность схватывания. Минус материала – резкий запах и небольшая токсичность. Во время работы с клеем необходимо обеспечить защиту рук и органов дыхания, хорошо проветривать помещение. Неприятный запах будет сохраняться около двух дней после проведения работ. Есть еще одно ограничение – подобным составом не рекомендуется клеить синтетические материалы.
Клей отлично переносит воздействие повышенной влажности, перепады температур, мороз, обеспечивает высокую скорость и прочность схватывания. Минус материала – резкий запах и небольшая токсичность. Во время работы с клеем необходимо обеспечить защиту рук и органов дыхания, хорошо проветривать помещение. Неприятный запах будет сохраняться около двух дней после проведения работ. Есть еще одно ограничение – подобным составом не рекомендуется клеить синтетические материалы.
Водоэмульсионные акриловые жидкие гвозди абсолютно не токсичны и практически не пахнут. Прочность у них несколько ниже, поэтому их используют для крепления более легких материалов. Именно этот состав необходимо использовать при работе с пористыми поверхностями. К минусам отнесем чувствительность к перепадам температур, невысокую морозо- и влагостойкость, поэтому для проведения масштабных работ на кухне и в ванной такие составы не подходят.
№4. Виды жидких гвоздей по назначению
По назначению жидкие гвозди можно поделить на таки виды:
- универсальные;
- специального назначения.

Понятно, что универсальные клеи могут применяться в любых условиях и для монтажа на любые поверхности. Впрочем, такая универсальность не всегда хорошо работает, когда условия сильно специфические.
Составы специального назначения имеют четкие рекомендации для применения. В продаже можно найти такие жидкие гвозди:
- для влажных и для сухих помещений;
- для внутренних и для наружных работ;
- для крепления тяжелых конструкций;
- составы повышенной прочности и с высокой скоростью застывания;
- клей для зеркал, стекол и керамики;
- клей для панелей из пенополистирола и прочие.
Какие жидкие гвозди лучше выбрать, необходимо решать в зависимости от того, что и где вы собираетесь крепить. На упаковке производители указывают, в каких условиях можно использовать тот или иной состав, и для чего он преимущественно подходит.
№5. Жидкие гвозди: применение
Жидкие гвозди – универсальный материал, который подходит для работы с такими материалами:
Порой жидкие гвозди используются даже при герметизации щелей в стенах, угловых стыков, столешниц, вентиляционных отверстий, хотя лучше, конечно же, в этих целях использовать специальные герметики. Не рекомендуется применять жидкие гвозди при работе с влажным деревом, а также для склеивания аквариумов.
Не рекомендуется применять жидкие гвозди при работе с влажным деревом, а также для склеивания аквариумов.
№6. Что еще учесть при выборе жидких гвоздей?
При покупке внимательно изучайте упаковку и все то, что на ней написано. Особенно обращайте внимание на такие вещи:
- время схватывания клея. Этот параметр в разных составах может незначительно, но отличаться. Если речь идет о монтаже каких-то элементов на стены или на потолок, то лучше брать быстросхватывающие клеи, чтобы упростить себе процесс монтажа;
- состав. Лучше брать клей, в составе которого нет мела, он способен несколько ухудшить качество соединения. Если речь об ответственном креплении или о приклеивании тяжелых деталей, то состав с мелом точно лучше не брать;
- ацетон в составе также не желателен;
- для ванной и прочих помещений с повышенной влажностью обязательно следует взять влагостойкий состав.
№7. Производители жидких гвоздей
Качество исполнения жидкого клея, его состав и соответствие тому, что написано на упаковке, напрямую зависит от имени производителя. Крепление материалов и конструкций – дело ответственное, поэтому экономия тут ни к чему. Выбор лучше доверить продукции таких производителей, как:
Крепление материалов и конструкций – дело ответственное, поэтому экономия тут ни к чему. Выбор лучше доверить продукции таких производителей, как:
- HENKEL – немецкая компания, продукция которой пользуется повышенным спросом во всем мире именно благодаря высокому качеству. Выпускает жидкие гвозди торговых марок «Момент Монтаж» и Makroflex. Есть универсальные составы и клеи для плинтусов, пенополистирольных панелей, суперсильные клеи для металла, дерева и ДСП. Клей «Момент Монтаж Суперсильный Плюс» выдерживает нагрузку до 100 кг/см2;
- KIM TEC – еще один немецкий производитель, выпускает универсальные жидкие гвозди, влагостойкие составы, а также клеи для декоративных элементов, зеркал, клеи особо сильной фиксации;
- MACCO – американская компания, которая стала пионером отрасли. Ее продукция качественная, а ассортимент постоянно расширяется;
- FRANKLIN – американская компания, выпускающая жидкие гвозди под торговой маркой Titebond. Составы отличаются повышенной прочностью и достаточным ассортиментом;
- SELENA GROUP – польская компания, выпускает жидкие гвозди Titan, которые отличаются хорошим соотношением цены и качества.
№8. Пистолет для жидких гвоздей
Работать с жидкими гвоздями очень просто – освоит даже новичок в ремонтном деле. Необходимо будет запастись только подходящим составом и специальным пистолетом, куда будет вставляться картридж с клеем. Несмотря на грозное название, этот пистолет больше напоминает шприц, правда, достаточно громоздкий. Тюбик клея устанавливается в подготовленную нишу, чтобы с одной стороны он упирался в наконечник, а с другой – в поверхность для надавливания. Конструкция очень проста, установить картридж с клеем также несложно.
Пистолеты бывают рамными и листовыми. Рамные более надежные, так как позволяют плотнее зафиксировать картридж.
В зависимости от особенностей конструкции пистолеты могут быть с обратным ходом или без обратного хода. Последние используются по большей части профессионалами, когда объем работ большой и постоянный. Для частного строительства больше подойдет конструкция с обратным ходом.
№9. Как клеить жидкими гвоздями?
Весь процесс достаточно прост, никаких особых навыков не требует:
- поверхности, которые будут склеиваться, необходимо тщательно очистить и обезжирить;
- наносить клей необходимо точечно или змейкой, если деталь тяжелая. Для нанесения используют специальный пистолет;
- после нанесения материал быстро прикладывается к поверхности и плотно прижимается. Удерживать деталь в необходимом положении требуется примерно 1-2 минуты, потом можно аккуратно убрать руки. На этом этапе, если необходимо, контролируется вертикальный и горизонтальный уровень;
- срок высыхания клея – 12-24 часа, все зависит от типа состава, температуры, влажности и вентиляции в помещении. Окончательная полимеризация происходит примерно через неделю.
При работе с жидкими гвоздями на основе органического растворителя стоит использовать перчатки, а лучше – еще и маску для защиты дыхательных путей.
№10. Как удалить жидкие гвозди?
Когда монтаж проходит аккуратно и неспешно, то вероятность попадания клея на лицевую сторону поверхности низкая. Если же это все равно произошло, то постарайтесь как можно скорее вытереть клей. Пока состав еще не высох, удастся убрать его влажной губкой или растворителем на минеральной основе. Когда клей окончательно засох, помогут специальные очистители, либо грубый механический метод с использованием скребка, но действовать необходимо очень осторожно, чтобы не повредить поверхность. Еще один выход – нагрев до температуры 55-60 градусов, например, строительным феном – гвозди перейдут в жидкое состояние и их можно будет гораздо проще удалить.
Самое главное – это быть внимательным во время покупки и не доверять заманчивым предложениям от малоизвестных производителей. В лучшем случае – клей окажется непрочным, в худшем – будет нанесен вред здоровью.
Статья написана для сайта remstroiblog.ru.
What does npm exec do? What is the difference between «npm exec» and «npx»?
What are the building blocks of OWL ontologies?
Learn more about «RDF star», «SPARQL star», «Turtle star», «JSON-LD star», «Linked Data star», and «Semantic Web star».
The Hadamard gate is one of the simplest quantum gates which acts on a single qubit.
Learn more about the bra–ket notation.
Progressive Cactus is an evolution of the Cactus multiple genome alignment protocol that uses the progressive alignment strategy.
The Human Genome Project is an ambitious project which is still underway.
What are SVMs (support vector machines)?
Find out more in Eckher’s article about TensorFlow.js and linear regression.
On the importance of centralised metadata registries at companies like Uber.
Facebook’s Nemo is a new custom-built platform for internal data discovery. Learn more about Facebook’s Nemo.
What is Data Commons (datacommons.org)? Read Eckher’s introduction to Data Commons (datacommons.org) to learn more about the open knowledge graph built from thousands of public datasets.
Learn more about how Bayer uses semantic web technologies for corporate asset management and why it enables the FAIR data in the corporate environment.
An introduction to WikiPathways by Eckher is an overview of the collaboratively edited structured biological pathway database that discusses the history of the project, applications of the open dataset, and ways to access the data programmatically.
Eckher’s article about question answering explains how question answering helps extract information from unstructured data and why it will become a go-to NLP technology for the enterprise.
Read more about how document understanding AI works, what its industry use cases are, and which cloud providers offer this technology as a service.
Lexemes are Wikidata’s new type of entity used for storing lexicographical information. The article explains the structure of Wikidata lexemes and ways to access the data, and discusses the applications of the linked lexicographical dataset.
The guide to exploring linked COVID-19 datasets describes the existing RDF data sources and ways to query them using SPARQL. Such linked data sources are easy to interrogate and augment with external data, enabling more comprehensive analysis of the pandemic both in New Zealand and internationally.
The introduction to the Gene Ontology graph published by Eckher outlines the structure of the GO RDF model and shows how the GO graph can be queried using SPARQL.
The overview of the Nobel Prize dataset published by Eckher demonstrates the power of Linked Data and demonstrates how linked datasets can be queried using SPARQL. Use SPARQL federation to combine the Nobel Prize dataset with DBPedia.
Learn why federated queries are an incredibly useful feature of SPARQL.
What are the best online Arabic dictionaries?
How to pronounce numbers in Arabic?
List of months in Maori.
Days of the week in Maori.
The list of country names in Tongan.
The list of IPA symbols.
What are the named entities?
What is computational linguistics?
Learn how to use the built-in React hooks.
Learn how to use language codes in HTML.
Learn about SSML.
Browse the list of useful UX resources from Google.
Where to find the emoji SVG sources?.
What is Wikidata?
What’s the correct markup for multilingual websites?
How to use custom JSX/HTML attributes in TypeScript?
Learn more about event-driven architecture.
Where to find the list of all emojis?
How to embed YouTube into Markdown?
What is the Google Knowledge Graph?
Learn SPARQL.
Explore the list of coronavirus (COVID-19) resources for bioinformaticians and data science researchers.
Sequence logos visualize protein and nucleic acid motifs and patterns identified through multiple sequence alignment. They are commonly used widely to represent transcription factor binding sites and other conserved DNA and RNA sequences. Protein sequence logos are also useful for illustrating various biological properties of proteins. Create a sequence logo with Sequence Logo. Paste your multiple sequence alignment and the sequence logo is generated automatically. Use the sequence logo maker to easily create vector sequence logo graphs. Please refer to the Sequence Logo manual for the sequence logo parameters and configuration. Sequence Logo supports multiple color schemes and download formats.
Sequence Logo is a web-based sequence logo generator. Sequence Logo generates sequence logo diagrams for proteins and nucleic acids. Sequence logos represent patterns found within multiple sequence alignments. They consist of stacks of letters, each representing a position in the sequence alignment. Sequence Logo analyzes the sequence data inside the user’s web browser and does not store or transmit the alignment data via servers.
Te Reo Maps is an online interactive Maori mapping service. All labels in Te Reo Maps are in Maori, making it the first interactive Maori map. Te Reo Maps is the world map, with all countries and territories translated into Maori. Please refer to the list of countries in Maori for the Maori translations of country names. The list includes all UN members and sovereign territories.
Phonetically is a web-based text-to-IPA transformer. Phonetically uses machine learning to predict the pronunciation of English words and transcribes them using IPA.
Punycode.org is a tool for converting Unicode-based internationalized domain names to ASCII-based Punycode encodings. Use punycode.org to quickly convert Unicode to Punycode and vice versa. Internationalized domains names are a new web standard that allows using non-ASCII characters in web domain names.
My Sequences is an online platform for storing and analyzing personal sequence data. My Sequences allows you to upload your genome sequences and discover insights and patterns in your own DNA.
Словообразовательный словарь «Морфема» дает представление о морфемной структуре слов русского языка и слов современной лексики. Для словообразовательного анализа представлены наиболее употребительные слова современного русского языка, их производные и словоформы. Словарь предназначен школьникам, студентам и преподавателям. Статья разбора слова «сладкоежка» по составу показывает, что это слово имеет два корня, соединительную гласную, суффикс и окончание. На странице также приведены слова, содержащие те же морфемы. Словарь «Морфема» включает в себя не только те слова, состав которых анализируется в процессе изучения предмета, но и множество других слов современного русского языка. Словарь адресован всем, кто хочет лучше понять структуру русского языка.
Разбор слова «кормушка» по составу.
Разбор слова «светить» по составу.
Разбор слова «сбоку» по составу.
Разбор слова «шиповник» по составу.
Разбор слова «народ» по составу.
Разбор слова «впервые» по составу.
Разбор слова «свежесть» по составу.
Разбор слова «издалека» по составу.
Разбор слова «лесной» по составу.
Выражение цементного порового раствора и анализ его химического состава и удельного сопротивления с помощью рентгеновской флуоресценции
В этом разделе представлены репрезентативные результаты каждого основного шага методологии. Это делается для того, чтобы получить представление о том, что ожидается в конце каждого шага, и дать полезные советы для обеспечения правильного применения метода.
Первый важный шаг заключается в отжиме порового раствора из свежего образца пасты. На рис. 2 показан раствор пор, который правильно извлечен и запечатан в 5-миллилитровом шприце. Пористый раствор на рисунке был получен из свежего обычного портландцементного теста с водоцементным отношением 0,36. Образец перемешивали за 10 мин до получения изображения. Ожидается, что поровый раствор будет прозрачным; тем не менее, цвет может варьироваться в зависимости от типа использованных вяжущих материалов и возраста образца на момент нанесения.
Перед измерением XRF экстрагированного порового раствора необходимо откалибровать прибор.В частности, необходимо откалибровать каждый элемент, ионная концентрация которого будет измеряться. Типичный калибровочный график ионов калия (K + ) показан на , рис. 3 . На рисунке показана подгонка, выполненная программным обеспечением, для интенсивностей, измеренных XRF. Обратите внимание, что среднеквадратичная ошибка аппроксимации не должна превышать 5%.
После калибровки рекомендуется протестировать раствор с известной ионной концентрацией, чтобы определить точность прибора.Измеренный состав ионов с помощью XRF сравнивается с теоретическим составом обоих растворов. Согласно нашему опыту, при условии правильного приготовления ионных растворов, этот этап проверки должен давать процент ошибок менее ± 5%. На рис. 4 показаны результаты выборочной проверки растворов. Когда выборочная проверка дает процент ошибок выше ± 5%, повторите калибровку прибора XRF.
Таблица 2 показывает типичный набор результатов для состава и удельного сопротивления.Хотя концентрация ионов в поровом растворе может широко варьироваться в зависимости от химического состава цемента, соотношения воды и цемента в системе и наличия дополнительных вяжущих материалов 19 , справочные значения могут быть получены из литературы. 20 для основных ионов, как показано в таблице .
Наконец, при вычислении удельного сопротивления образца обычно ожидается, что значения для поровых растворов раннего возраста будут в пределах 0.05 и 0,25 Ом · м 14 . Теперь, когда известно удельное сопротивление порового раствора, объемное удельное сопротивление может быть получено с использованием других методов, таких как одноосное удельное сопротивление, чтобы, в конечном итоге, рассчитать коэффициент образования, который обычно превышает 2000 для бетона хорошего качества
Рисунок 1 : Сборка системы экстракции порового раствора. Система состоит из основного выдавливающего устройства, баллона с азотом и трубки с предохранительным манометром и регулятором, а также сборного контейнера.Всегда соблюдайте инструкции производителя и меры предосторожности для конкретной используемой системы. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рис. 2 : Правильно экстрагированный и герметизированный раствор экстрагированных пор в шприце объемом 5 мл. Извлеченный поровый раствор должен казаться прозрачным (, т. Е. , без видимых частиц) и должен быть герметичным, чтобы внутри шприца не было пузырьков воздуха.
Рисунок 3 : Типичный калибровочный график калия (K + ). По оси абсцисс показаны расчетные (известные) концентрации в миллионных долях, а по оси ординат — измеренные (измеренные) интенсивности с помощью XRF в имп / мин. Калибровочная линия, рассчитанная на основе одной из моделей коррекции в программном обеспечении, должна иметь наименьшее среднеквадратичное значение (%), как описано в разделе 3 протокола. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 4 : Контрольный график ионов натрия (Na + ) и калия (K + ) .Пунктирная линия представляет соотношение 1: 1. График проверки должен показать хорошую корреляцию (почти соотношение 1: 1 с высоким значением R-квадрата) между известными концентрациями ионов натрия и калия и обнаруженными концентрациями с помощью XRF. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Ионные виды (i) | Эквивалентная проводимость при бесконечном разбавлении (λ˚i) | Эмпирический коэффициент проводимости |
| (i) | (zλ ° и ) | (G i ) |
| (см 2 См / моль) | (моль / л) -1/2 | |
| Натрий (Na + ) | 50.1 | 0,733 |
| Калий (K + ) | 73,5 | 0,548 |
| Кальций (Ca 2+ ) | 59 | 0,771 |
| Гидроксид (OH — ) | 198 | 0,353 |
| Сульфат (SO 4 2- ) | 79 | 0.877 |
Таблица 1: Эквивалентная проводимость при бесконечном разбавлении ( ) и эмпирические коэффициенты проводимости ( ) для каждого вида ионов, полученные из литературы 11 . Эти значения используются для расчета удельного электрического сопротивления порового раствора.
| Ионные виды | Концентрация |
| (i) | (моль / л) |
| Натрий (Na + ) | 0.16 |
| Калий (K + ) | 0,39 |
| Кальций (Ca 2+ ) | 0,02 |
| Гидроксид (OH — ) | 0,18 |
| Сульфат (SO 4 2- ) | 0,2 |
| Удельное сопротивление (Ом · м) | 0,156 |
Таблица 2: Типичные результаты для состава и удельного сопротивления цементного теста с водоцементным отношением 0.36 на 10 мин. Значения в этой таблице являются примерами результатов, полученных с помощью этого метода.
Возможно больше, чем вы хотели знать об яде гремучей змеи: назначение, химический состав и воздействие на организм
Анонимное письмо в The Pennsylvania Journal в декабре 1775 года описывает, как писатель наблюдал изображение гремучей змеи, изображенное на барабане, принадлежащем морскому пехотинцу, со словами «Не наступай на меня», написанными под изображением змеи.Автор продолжил теоретические рассуждения относительно того, почему этот символ был выбран морпехом и его предполагаемое значение. Автор начал с описания характеристик, которые отличают гремучих змей от других животных, и предположил, почему эти же свойства могут быть надлежащим образом использованы для обозначения Соединенных Штатов Америки:
«Я вспомнил, что ее глаза превосходны по яркости, как у любого другого животного, и что у нее нет век. Поэтому ее можно считать символом бдительности. Она никогда не начинает нападение и, будучи однажды вовлеченной, никогда не сдается: поэтому она является символом великодушия и истинного мужества.Словно стремясь предотвратить любые притязания на ссору с ней, оружие, которым природа отполировала ее, она прячет в небе, так что тем, кто с ней не знаком, она кажется самым беззащитным животным. ; и даже когда это оружие показано и протягивается для ее защиты, оно кажется слабым и презренным; но их раны, какими бы маленькими они ни были, решительны и смертельны. Сознавая это, она никогда не ранит, «пока она щедро не предупредит даже своего врага и не предупредит его об опасности наступить на нее».
-Американский догадчик »
Хотя вышеупомянутый абзац был написан анонимно, историки считают, что автором был Бенджамин Франклин. Полное письмо можно просмотреть на http://greatseal.com/symbols/rattlesnake.html.
В этом коротком блоге будут рассмотрены свойства яда гремучих змей.
Для чего нужен яд гремучей змеи?
Есть две основные категории ядов: те, которые предназначены для подавления добычи, и те, которые предназначены для сдерживания хищников.Гремучие змеи развили свой яд, чтобы покорить добычу и начать процесс пищеварения. На рис. 1 показана деревянная гремучая змея ( Crotalus horridus ), которая поедает восточную серую белку ( Sciurus carolinensis ) после того, как покорил ее ядом. У них есть специальный набор белков и ферментов, которые помогают выполнить эту задачу. К сожалению, хотя яд гремучих змей был разработан для использования в добыче пищи, а не в качестве защитной меры, защитный укус, тем не менее, приводит к тому, что эти пищеварительные соединения разрывают ткани тела и вызывают боль, отек и некроз.
Рисунок 1 . Эта деревянная гремучая змея ( Crotalus horridus ) была сфотографирована автором, когда она поедала восточную серую белку ( Sciurus carolinensis ) в округе Алачуа, Флорида, после того, как подавила ее ядом. Эта змея относится к популяции с более высокой концентрацией нейротоксического яда, чем у популяций к северу от Interstate 10.
Фотография и права защищены автором Джейсоном Зейтцем
Из чего состоит яд гремучей змеи?
Яд гремучих змей представляет собой смесь гемотоксинов и нейротоксинов, но в основном это гемотоксины.Гемотоксины поражают ткани и кровь, вызывая кровотечение и некроз. Их яд на самом деле представляет собой коктейль из химических элементов. Нейротоксины поражают нервную систему, некоторые из которых могут вызвать паралич. Хотя каждый вид ядовитой змеи имеет свой собственный коктейль белков и ферментов по сравнению с другими видами, есть некоторые свидетельства того, что относительная концентрация нейротоксинов по отношению к гемотоксинам может варьироваться в зависимости от региона даже в пределах данного вида змей. Например, некоторые исследователи считают, что значительный процент деревянных гремучих змей к югу от межштатной автомагистрали 10 (I-10) во Флориде имеет более высокую концентрацию нейротоксического яда, чем древесные гремучие змеи к северу от этого коридора.Различные белки и ферменты в яде гремучей змеи обладают синергетическим эффектом, который в результате вызывает полный сердечно-сосудистый коллапс предполагаемой жертвы змеи. Когда гремучая змея кусается в целях защиты, эффекты смягчаются из-за большого размера человека по сравнению с его добычей (обычно грызуном).
Некоторые недавние работы ученых показали, что некоторые формы гемотоксических ядов не являются иммуногенными, что означает, что они не вызывают иммунный ответ жертвы. Они проскальзывают иммунной системой зараженного животного, поэтому не вырабатываются антитела для борьбы с токсинами.Это вызывает беспокойство, поскольку противоядия производятся путем инъекции яда крупному животному, обычно лошади, и последующему сбору антител, созданных лошадью, которые впоследствии могут быть использованы для лечения жертв укусов.
Гемотоксиновые яды, такие как яды гремучих змей, начинают разрушать структурные компоненты кровеносных сосудов и тканей, как только они вводятся. Это делается с помощью металлопротеаз, которые являются протеазами-ферментами, которые используют металл в качестве катализатора гидролиза пептидных связей.Поскольку эти ферменты расщепляют даже белки, отвечающие за поддержание целостности клеточных стенок кровеносных сосудов, возникает локальное кровотечение, посылая кровь в окружающие ткани. Те же металлопротеиназы также разрушают скелетные мышцы. Другой компонент токсина гремучих животных, фосфолипазы, вызывают гибель мышечной ткани, атакуя их клеточные мембраны. Некоторые из этих фосфолипаз содержат ферменты, которые создают отверстия в стенках мышечных клеток, расщепляя фосфолипиды, удерживающие мембраны вместе.Другие фосфолипазы используют еще неустановленные средства разрушения мышечных клеток.
Есть еще другие ферменты, содержащиеся в яде гремучей птицы, вызывающие разрушение. К ним относятся гиалуронидазы и сериновые протеазы, каждая из которых имеет свой деструктивный механизм. Некоторые химические соединения из яда распространяются далеко от места укуса и наносят ущерб кровеносным сосудам и скелетным мышцам в других частях тела.
Помимо разрушительного действия самих компонентов яда, некоторые белки обманывают нашу иммунную систему, чтобы она боролась с нашими собственными клетками.В частности, действие металлопротеаз и фосфолипаз запускает иммунный ответ на участке раны. Иммунные клетки, такие как лейкоциты, сигнализируют об усилении иммунного ответа, высвобождая мессенджеров, таких как интерлейкин-6. Поскольку компоненты яда не являются связующей силой и не содержат бактерий, которые могут атаковать, иммунная система вместо этого запускает атаку, которая усугубляет разрушение наших собственных тканей. Ущерб, наносимый нашей собственной иммунной системой, вызывает двойное беспокойство, учитывая, что противоядие не помогает смягчить его последствия.Исследования показали, что когда иммунная система отключена, некротические эффекты змеиного яда значительно уменьшаются. Например, использование Бенадрила может уменьшить отек и отек, связанные с отравлением.
Записка о консервации
Хотя змей часто опасаются и преследуют на большей части их ареалов в Соединенных Штатах и других местах, они, тем не менее, занимают ценное место в экологии многих экосистем. В U. обитают сотни видов змей.S., но лишь небольшая часть из них ядовита. Например, во Флориде насчитывается 50 видов змей, но только 6 (12%) из них ядовиты. Ядовитых змей можно безопасно и эффективно избежать, если руководствоваться здравым смыслом. Если змея считается ядовитой или неизвестно, является ли она ядовитой, самое безопасное решение — оставить ее в покое. Помните, что большинство жертв укусов укушены, потому что они пытаются схватить змею или убить ее.
Змеи выполняют ценные услуги, такие как борьба с грызунами и другими вредителями.Недавнее исследование показало, что древесные гремучие змеи могут снизить заболеваемость болезнью Лайма на северо-востоке США, охотясь на хозяина (грызунов), который является переносчиком клеща, который распространяет болезнь. По оценкам, от 2500 до 4500 клещей ежегодно удалялись из исследуемых районов на северо-востоке США из-за того, что древесные гремучие змеи поедали своих млекопитающих-хозяев.
Недавние исследования показывают, что гремучие змеи могут способствовать рассеянию семян трав и других растений. Грызуны едят семена трав и других растений, но обычно эти семена не выживают в процессе пищеварения грызунов.Однако грызуны часто носят семена в своих защечных мешочках, и если грызуна затем убьет и съест гремучая змея, эти семена смогут пройти через пищеварительный тракт змеи и остаться жизнеспособными. Было обнаружено, что три вида гремучих змей, обитающих в пустыне, поедали грызунов с семенами в защечных мешочках, и что семена способны прорастать в толстой кишке змеи и могут передаваться с фекалиями змеи, что способствует распространению побегов растений.
Популяции гремучих змей и многих других видов змей сокращаются в Соединенных Штатах из-за потери среды обитания, продолжающихся преследований и новых болезней, таких как змеиный гриб Ophidiomyces ophiodiicola .Восточная гремучая змея ромбовидная ( Crotalus adamanteus ) (рис. 2) сократилась до такой степени, что этот вид был подан прошение о защите как находящийся под угрозой исчезновения в соответствии с Законом об исчезающих видах.
Рисунок 2 . Восточная гремучая змея ромбовидная ( Crotalus adamanteus ) — один из наиболее известных (и часто преследуемых) видов гремучих змей.
Фотография и авторские права защищены автором Джейсоном Зейтцем
Интересный способ сообщить о своих наблюдениях за земноводными и рептилиями с помощью Citizen Science
Используйте приложение для мобильного телефона HerpMapper, чтобы записывать и отправлять данные о наблюдениях за амфибиями и рептилиями! Это весело, просто и легко.Посетите веб-сайт https://www.herpmapper.org/ для получения дополнительной информации и загрузки приложения.
Источники
Адкинс, К.Л., Д.Н. Гринвальд, Д. Средство, Б. Маттурро и Дж. Райс. 2011. Петиция о включении восточной гремучей змеи с ромбовидной спиной ( Crotalus adamanteus ) в список находящихся под угрозой исчезновения в соответствии с Законом об исчезающих видах. Петиция подана 11.08.11 в Службу охраны рыбных ресурсов и диких животных США (USFWS), Вашингтон, округ Колумбия, и USFWS, регион 4, Атланта, Джорджия.
Коричневый, W.S. 1993. Биология, статус и управление лесной гремучей змеей ( Crotalus horridus ): Руководство по сохранению . Общество изучения земноводных и рептилий, Герпетологический циркуляр № 22, Университет Канзаса, Лоуренс, Канзас.
Кабай, Э., Н. М. Карузо, К. Р. Губы. 2013. Деревянные гремучие змеи могут снизить заболеваемость болезнью Лайма на северо-востоке США . 98 -е Ежегодное собрание Экологического общества Америки, 08.06.13, Миннеаполис, Миннесота.Доступно онлайн 02/05/18 по адресу https://eco.confex.com/eco/2013/webprogram/Paper44305.html.
Лорч, Дж. М., С. Ноулз, Дж. Ланктон, К. Мичелл, Дж. Л. Эдвардс, Дж. М. Капфер, Р.А. Staffen, E.R. Wild, K.Z. Шмидт, А.Е.Баллманн, Д. Блоджетт, Т. Фаррел, Б. Глориозо, Л.А. Ласт, С.Дж. Прайс, К. Шулер, С.Е. Смит, Дж. Ф. Х. Веллехан младший и Д.С. Блехерт. 2016. Змеиная грибковая болезнь: новая угроза для диких змей. Философские труды Королевского общества B 371: 20150457.Доступно онлайн 13.02.18 по адресу http://rstb.royalsocietypublishing.org/content/royptb/371/1709/20150457.full.pdf.
Reiserer, R.S., G.W. Schuett, H.W. Грин. 2018. Проглатывание семян и прорастание гремучих змей: недооцененные агенты спасения и вторичного распространения. Труды Королевского общества B : 285: 20172755. http://dx.doi.org/10.1098/rspb.2017.2755.
Робертсон, М. 2017. чел. комм. относительно региональных различий в нейротоксинах у древесной гремучей змеи.
Wilcox, C. 2016. Venomous, Как самые смертоносные существа Земли освоили биохимию . Scientific American / Фаррар, Страус и Жиру, Нью-Йорк, штат Нью-Йорк.
Сборка и разборка амилоида | Журнал клеточной науки
Амилоидные фибриллы представляют собой гомополимеры белков, которые принимают различные перекрестные β-конформации (рис. 1А). Эти неразветвленные фибриллы стабилизируются за счет межмолекулярных контактов между β-нитями, которые выстраиваются перпендикулярно оси фибрилл, создавая перекрестную β-архитектуру (рис.1A) (Eanes, Glenner, 1968; Sipe, Cohen, 2000; Sunde et al., 1997). Амилоид — одна из самых стабильных конформаций белков (Smith et al., 2006). Действительно, амилоиды инсулина имеют прочность ∼0,6 ± 0,4 ГПа, что сравнимо с прочностью стали (∼0,6–1,8 ГПа) (Knowles and Buehler, 2011; Smith et al., 2006).
Рис. 1.
Структура амилоида и пути образования. (A) Вверху слева: картина дифракции рентгеновских лучей для амилоидов показывает основные отражения на ∼4.7 Å (расстояние водородных связей между β-нитями) и ∼10 Å (упаковка боковой цепи между β-листами), что указывает на перекрестную β-структуру, где β-нити выравниваются перпендикулярно оси фибриллы. Внизу слева: структура твердотельного ЯМР фибриллы α-синуклеина человека (PDB: 2N0A) (Tuttle et al., 2016). Справа: криоЭМ-структуры с разрешением 3,4–3,5 Å парно-спиральных филаментов тау (PDB: 5O3L) и прямых волокон (PDB: 5O3T) от пациента с БА (Fitzpatrick et al., 2017). (B) При нисходящей полимеризации (DP) лаг-фаза образования амилоида происходит из-за медленной диссоциации стабильного природного тетрамера на мономеры, которые затем быстро принимают амилоидогенную конформацию.Этот механизм используется TTR в FAP (Hurshman et al., 2004). Амилоидоз TTR может подавляться тафамидом, лекарством, которое стабилизирует TTR в его естественном тетрамерном состоянии (Coelho et al., 2012). Таким образом, понимание механизма образования амилоида может позволить разработать лекарства для сохранения нативного состояния и предотвращения амилоидогенеза. Обычно амилоиды, образованные DP, не устраняют лаг-фазу фибрилляции в реакциях, засеянных предварительно сформированными фибриллами (нижняя панель). (C) При нуклеированной конформационной конверсии (NCC) частично или полностью неупорядоченные растворимые мономеры изначально находятся в равновесии с расплавленными растворимыми олигомерами.Во время лаг-фазы сборки эти расплавленные растворимые олигомеры постепенно перестраиваются в амилоидогенные олигомеры, которые затем быстро образуют перекрестные β-ядра (первичное зародышеобразование), тем самым завершая лаг-фазу. Как только образовались перекрестно-β-ядра, фибрилляция протекает быстро, поскольку ядра рекрутируют и превращают растворимые мономеры и расплавленные растворимые олигомеры в перекрестно-β-форму на концах растущих фибрилл. Введение предварительно сформированных фибрилл устраняет лаг-фазу сборки за счет немедленного моделирования конформации амилоида.Боковая сторона собранной фибриллы также служит местом для событий вторичной нуклеации, где расплавленные олигомеры или растворимые мономеры могут быстро превращаться в амилоидогенные олигомеры. Обычно амилоиды, образованные NCC, устраняют лаг-фазу фибрилляции в реакциях, засеянных предварительно сформированными фибриллами (нижняя панель). (D) Фазовый переход белков, содержащих прионоподобные домены (PrLD). RBP могут конденсироваться в жидкие капли за счет временных взаимодействий между PrLD и других поливалентных взаимодействий.Персистентность капель делает возможным формирование стабильных (менее динамичных) взаимодействий между PrLD, которые управляют аберрантным фазовым переходом из жидкого в твердое состояние, которое включает патологические фибриллы, которые накапливаются при заболевании.
Рис. 1.
Структура амилоида и пути образования. (A) Вверху слева: картина дифракции рентгеновских лучей для амилоидов показывает основные отражения при ∼4,7 Å (расстояния водородных связей между β-нитями) и ∼10 Å (упаковка боковых цепей между β-листами), что указывает на перекрестную β-структуру. структура, в которой β-тяжи ориентированы перпендикулярно оси фибриллы.Внизу слева: структура твердотельного ЯМР фибриллы α-синуклеина человека (PDB: 2N0A) (Tuttle et al., 2016). Справа: криоЭМ-структуры с разрешением 3,4–3,5 Å парно-спиральных филаментов тау (PDB: 5O3L) и прямых волокон (PDB: 5O3T) от пациента с БА (Fitzpatrick et al., 2017). (B) При нисходящей полимеризации (DP) лаг-фаза образования амилоида происходит из-за медленной диссоциации стабильного природного тетрамера на мономеры, которые затем быстро принимают амилоидогенную конформацию. Этот механизм используется TTR в FAP (Hurshman et al., 2004). Амилоидоз TTR может подавляться тафамидом, лекарством, которое стабилизирует TTR в его естественном тетрамерном состоянии (Coelho et al., 2012). Таким образом, понимание механизма образования амилоида может позволить разработать лекарства для сохранения нативного состояния и предотвращения амилоидогенеза. Обычно амилоиды, образованные DP, не устраняют лаг-фазу фибрилляции в реакциях, засеянных предварительно сформированными фибриллами (нижняя панель). (C) При нуклеированной конформационной конверсии (NCC) частично или полностью неупорядоченные растворимые мономеры изначально находятся в равновесии с расплавленными растворимыми олигомерами.Во время лаг-фазы сборки эти расплавленные растворимые олигомеры постепенно перестраиваются в амилоидогенные олигомеры, которые затем быстро образуют перекрестные β-ядра (первичное зародышеобразование), тем самым завершая лаг-фазу. Как только образовались перекрестно-β-ядра, фибрилляция протекает быстро, поскольку ядра рекрутируют и превращают растворимые мономеры и расплавленные растворимые олигомеры в перекрестно-β-форму на концах растущих фибрилл. Введение предварительно сформированных фибрилл устраняет лаг-фазу сборки за счет немедленного моделирования конформации амилоида.Боковая сторона собранной фибриллы также служит местом для событий вторичной нуклеации, где расплавленные олигомеры или растворимые мономеры могут быстро превращаться в амилоидогенные олигомеры. Обычно амилоиды, образованные NCC, устраняют лаг-фазу фибрилляции в реакциях, засеянных предварительно сформированными фибриллами (нижняя панель). (D) Фазовый переход белков, содержащих прионоподобные домены (PrLD). RBP могут конденсироваться в жидкие капли за счет временных взаимодействий между PrLD и других поливалентных взаимодействий.Персистентность капель делает возможным формирование стабильных (менее динамичных) взаимодействий между PrLD, которые управляют аберрантным фазовым переходом из жидкого в твердое состояние, которое включает патологические фибриллы, которые накапливаются при заболевании.
Амилоидные фибриллы встречаются в природе и выполняют специализированные функции, включая формирование пигмента, долгосрочное потенцирование (ДП), отбор сперматозоидов и высвобождение пептидных гормонов (вставка 1) (Berson et al., 2003; Дрисальди и др., 2015; Фиорити и др., 2015; Fowler et al., 2006; Maji et al., 2009; Павлопулос и др., 2011; Роан и др., 2017; Стефан и др., 2015; Watt et al., 2009). Однако многие белки образуют амилоидные фибриллы, которые нарушают клеточные процессы и лежат в основе фатальных нейродегенеративных расстройств и системных амилоидозов (Blancas-Mejía and Ramirez-Alvarado, 2013; Guo and Lee, 2014).
Вставка 1. Функциональные внеклеточные амилоиды у человека.Функциональные амилоидные фибриллы естественным образом содержатся в человеческой сперме. Действительно, низкий уровень семенного амилоида коррелирует со снижением мужской фертильности (Castellano and Shorter, 2012). Несколько фрагментов кислой фосфатазы простаты (PAP, также известной как ACPP), такие как PAP 248–286, PAP 85–120, и аналогично, фрагменты семеногелина 1 и 2 (SEM1 и SEM2) образуют амилоидные фибриллы в семенной жидкости человека (Bergman et al., 2016; Castellano, Shorter, 2012). Эти фибриллы могут выполнять антимикробные функции (Easterhoff et al., 2013; Usmani et al., 2014), защищают сперматозоиды и служат фильтром, задерживающим сперму низкого качества, позволяя только наиболее приспособленным сперматозоидам выходить из ооцита и оплодотворять его (Bergman et al., 2016; Castellano and Shorter, 2012; Roan et al. др., 2017). К сожалению, эти фибриллы также способствуют инфицированию ВИЧ на несколько порядков (Arnold et al., 2012; Münch et al., 2007; Roan et al., 2011). Таким образом, агенты, разрушающие амилоид спермы, могут снизить передачу ВИЧ половым путем. Примечательно, что две небольшие молекулы, EGCG (полифенол зеленого чая) и CLR01 (молекулярный пинцет, специфичный для лизина и аргинина), могут реконструировать семенной амилоид и предотвратить заражение ВИЧ (Castellano et al., 2015b; Lump et al., 2015). Аналогичным образом, протеин-дезагрегаза Hsp104 может быть переоборудована для ремоделирования и очистки семенных амилоидов и противодействия ВИЧ-инфекции (Castellano et al., 2015a).
Различные пептидные и белковые гормоны экспрессируются в виде прогормонов, которые протеолитически процессируются и концентрируются в секреторных гранулах (Fig. 2C) (Goetze et al., 2012). Многие из этих гормонов образуют амилоидные фибриллы in vitro и in vivo (Maji et al., 2009). Некоторые гормоны могут образовывать амилоид in vitro при pH секреторной гранулы 5.5, но многим требуется помощь гликозаминогликанов (ГАГ), таких как гепарин, для образования амилоида (Maji et al., 2009). Эти гормоны могут храниться в высоких концентрациях в амилоидном состоянии, что обеспечивает отсроченное высвобождение гормонов, поскольку фибриллы медленно диссоциируют после секреции и дегрануляции (рис. 2С). Гормональные амилоиды часто нетоксичны, но некоторые из них могут быть такими же нейротоксичными, как Aβ (Maji et al., 2009). Однако они не токсичны, если ограничены секреторными гранулами. Скорость сборки и разборки амилоидных гормонов сильно зависит от условий их хранения и высвобождения (Jacob et al., 2016; Несповитая и др., 2016; Skeby et al., 2016). Конкретные факторы, такие как pH, соль и ГАГ, жестко регулируют амилоидогенез пептидного гормона, предполагая, что дегрануляция или неправильная локализация резко изменяют кинетику агрегации (Jacob et al., 2016; Nespovitaya et al., 2016; Skeby et al., 2016). Таким образом, амилоид может служить хранилищем, которое медленно высвобождает функциональные гормоны после секреции (рис. 2С).
Фиг.2.
Функциональные амилоиды. (A) PMEL образует функциональный амилоид в метаболизме меланина. Образование фибрилл PMEL сильно регулируется посттрансляционным расщеплением до амилоидгенной формы и компартментализацией внутри меланосом во время созревания меланосом. Фибриллы PMEL катализируют образование меланина, концентрируют меланин и способствуют транспортировке меланина в массе (Watt et al., 2013). (B) CPEB3 является регулятором трансляции мРНК в нейронах и усиливает LTP посредством позитивной регуляции трансляции рецептора AMPA.CPEB3 растворим и сумоилирован в своем базальном состоянии. После активации нейронов CPEB3 десумоилируется и убиквитилируется, вызывая агрегацию белка и активацию трансляции определенных мРНК (Drisaldi et al., 2015). (C) Пептидные гормоны (синий) сконцентрированы в секреторных гранулах, где они образуют амилоиды (красный) как механизм упаковки. Некоторые пептидные гормоны агрегируются спонтанно, в то время как другим требуется помощь гликозаминогликанов (Maji et al., 2009). Кроме того, эти амилоидные фибриллы медленно спонтанно деполимеризуются при высвобождении везикул во внеклеточное пространство, что приводит к замедленному высвобождению мономерных гормонов.
Рис. 2.
Функциональные амилоиды. (A) PMEL образует функциональный амилоид в метаболизме меланина. Образование фибрилл PMEL сильно регулируется посттрансляционным расщеплением до амилоидгенной формы и компартментализацией внутри меланосом во время созревания меланосом. Фибриллы PMEL катализируют образование меланина, концентрируют меланин и способствуют транспортировке меланина в массе (Watt et al., 2013). (B) CPEB3 является регулятором трансляции мРНК в нейронах и усиливает LTP посредством позитивной регуляции трансляции рецептора AMPA.CPEB3 растворим и сумоилирован в своем базальном состоянии. После активации нейронов CPEB3 десумоилируется и убиквитилируется, вызывая агрегацию белка и активацию трансляции определенных мРНК (Drisaldi et al., 2015). (C) Пептидные гормоны (синий) сконцентрированы в секреторных гранулах, где они образуют амилоиды (красный) как механизм упаковки. Некоторые пептидные гормоны агрегируются спонтанно, в то время как другим требуется помощь гликозаминогликанов (Maji et al., 2009). Кроме того, эти амилоидные фибриллы медленно спонтанно деполимеризуются при высвобождении везикул во внеклеточное пространство, что приводит к замедленному высвобождению мономерных гормонов.
Механизмы токсичности амилоидозов обсуждаются. Одна точка зрения состоит в том, что амилоидные фибриллы, их растворимые неправильно свернутые олигомерные предшественники или и то и другое являются непосредственно токсичными для клеток, что приводит к фенотипу повышения токсичности (Bucciantini et al., 2002; Guo and Lee, 2014; Kayed et al., 2003; Olzscha и др., 2011). Другая точка зрения состоит в том, что преобразование нативных белков в неправильно свернутые конформации, включая амилоид и растворимые неправильно свернутые олигомеры, приводит к фенотипу потери функции.Действительно, склонные к агрегации белки, такие как TDP-43 (кодируемый TARDBP ), которые участвуют в заболеваниях человека, могут иметь важные функции (Harrison and Shorter, 2017; Lee et al., 2011a; Ward et al., 2014). Эти два механизма не исключают друг друга и могут взаимодействовать при некоторых заболеваниях (Harrison and Shorter, 2017). Однако синтетически сконструированные амилоиды или растворимые неправильно свернутые олигомеры без нативной функции могут вызывать гибель клеток и напрямую нарушать протеостаз (Bucciantini et al., 2002; Olzscha et al., 2011). Таким образом, вероятно, существуют универсальные механизмы повышения токсичности, индуцированные амилоидными фибриллами или растворимыми неправильно свернутыми олигомерами, которые могут усугубляться потерей функции нативного белка. Хотя эта общая токсичность вызывает хаос в контексте болезни, природа также подавила эту токсичность и использовала амилоид для функциональных целей (Bergman et al., 2016; Harvey et al., 2017; Hufnagel et al., 2013; Jarosz and Khurana, 2017; Watt et al., 2013). С другой стороны, природа также настроила амилоидоподобные структуры так, чтобы они были высокотоксичными, например, с замечательными перекрестными α-фибриллами, образованными фенолорастворимым модулин-пептидом α3, секретируемым патогенной бактерией Staphylococcus aureus (Tayeb-Fligelman et al., 2017).
Понимание структуры амилоида (Рис. 1A), механизмов образования амилоидов (Рис. 1B – D) и клеточных механизмов, которые контролируют амилоидогенез и связанную с ним токсичность (Рис. 2–4), позволит разработать терапию для нескольких смертельных заболеваний. В этом обзоре мы освещаем достижения в нашем понимании функциональных и патологических амилоидных фибрилл. В частности, мы сосредоточены на структуре амилоида, формировании, деградации и дезагрегации.
Рис. 3.
Распад амилоида через аутофагию и убиквитин-протеасомную систему. (A) При макроаутофагии полиубиквитилированные агрегаты K63 поглощаются аутофагосомами и подвергаются деградации. Слияние аутофагосомы с лизосомой образует автолизосому, которая разрушает совокупный груз. Подкисление лизосом зависит от пресенилина 1 (PS1), который задействует протонный насос к лизосомам, который имеет решающее значение для подкисления аутолизосом (обозначено *) (Lee et al., 2010b). (B) В нейронах образование аутофагосом происходит в дистальном отделе аксона. Затем аутофагосомы сливаются с поздними эндосомами, поскольку они ретроградно транспортируются по микротрубочкам с помощью динеина к соме. Аутофагосомы также связывают двигатели кинезина, которые должны отрицательно регулироваться, чтобы обеспечить устойчивую ретроградную подвижность, управляемую динеином. По прибытии в сому аутофагосомы созревают в автолизосомы посредством слияния с лизосомами. (C) Протеиновые дезагрегазы, такие как Hsp70 в комбинации с Hsp110 и Hsp40, могут извлекать полипептиды из агрегатов и позволять им: (1) повторно складываться, (2) разрушаться протеасомой или (3) разрушаться опосредованной шаперонами аутофагии.Полипептиды, экстрагированные из агрегатов, могут быть убиквитилированы с помощью Hsp70-ассоциированных убиквитинлигаз, таких как CHIP (McDonough and Patterson, 2003). Затем полипептиды доставляются в протеасому для разложения шаттлами, такими как UBQLN2 (Hjerpe et al., 2016). Фибриллы тау могут ингибировать активность протеасом, и это ингибирование может быть снято путем увеличения передачи сигналов cAMP-PKA с помощью низкомолекулярного ролипрама (Myeku et al., 2016). Альтернативно, полипептиды могут предпочтительно перемещаться в лизосомы для деградации посредством процесса, называемого шаперон-опосредованной аутофагией (Schneider and Cuervo, 2013).
Рис. 3.
Разрушение амилоида посредством аутофагии и системы убиквитин-протеасома. (A) При макроаутофагии полиубиквитилированные агрегаты K63 поглощаются аутофагосомами и подвергаются деградации. Слияние аутофагосомы с лизосомой образует автолизосому, которая разрушает совокупный груз. Подкисление лизосом зависит от пресенилина 1 (PS1), который задействует протонный насос к лизосомам, который имеет решающее значение для подкисления аутолизосом (обозначено *) (Lee et al., 2010b). (B) В нейронах образование аутофагосом происходит в дистальном отделе аксона. Затем аутофагосомы сливаются с поздними эндосомами, поскольку они ретроградно транспортируются по микротрубочкам с помощью динеина к соме. Аутофагосомы также связывают двигатели кинезина, которые должны отрицательно регулироваться, чтобы обеспечить устойчивую ретроградную подвижность, управляемую динеином. По прибытии в сому аутофагосомы созревают в автолизосомы посредством слияния с лизосомами. (C) Протеиновые дезагрегазы, такие как Hsp70 в комбинации с Hsp110 и Hsp40, могут извлекать полипептиды из агрегатов и позволять им: (1) повторно складываться, (2) разрушаться протеасомой или (3) разрушаться опосредованной шаперонами аутофагии.Полипептиды, экстрагированные из агрегатов, могут быть убиквитилированы с помощью Hsp70-ассоциированных убиквитинлигаз, таких как CHIP (McDonough and Patterson, 2003). Затем полипептиды доставляются в протеасому для разложения шаттлами, такими как UBQLN2 (Hjerpe et al., 2016). Фибриллы тау могут ингибировать активность протеасом, и это ингибирование может быть снято путем увеличения передачи сигналов cAMP-PKA с помощью низкомолекулярного ролипрама (Myeku et al., 2016). Альтернативно, полипептиды могут предпочтительно перемещаться в лизосомы для деградации посредством процесса, называемого шаперон-опосредованной аутофагией (Schneider and Cuervo, 2013).
Рис. 4.
Амилоид-дезагрегазные устройства. (A) Hsp104 — это ААА + АТФаза, обладающая способностью эффективно фрагментировать прионы дрожжей, чтобы обеспечить их наследование дочерними клетками. Hsp104 может фрагментировать амилоидные фибриллы путем частичной или полной транслокации полипептида из фибриллы, создавая таким образом точку разрыва (Sweeny and Shorter, 2016). (B) Белки семейства Hsp70 содержат нуклеотид-связывающий домен и субстрат-связывающий домен.Полипептиды, захваченные в фибриллы, рекрутируются в субстрат-связывающий домен Hsp70 белками семейства Hsp40. Сопутствующее связывание Hsp40 и субстрата с Hsp70 способствует гидролизу АТФ и конформационному изменению Hsp70 до закрытого состояния, которое захватывает субстрат. Затем с помощью плохо изученного механизма, в сочетании с белками семейства Hsp110, факторами обмена нуклеотидов для Hsp70, полипептид извлекается и реорганизуется в его нативную конформацию (Nillegoda and Bukau, 2015; Torrente and Shorter, 2013).Этот процесс может потребовать, чтобы Hsp110 взаимодействовал с субстратом и гидролизовал АТФ (Mattoo et al., 2013; Scior et al., 2018; Shorter, 2011). Hsp110, Hsp70 и Hsp40 преимущественно деполимеризуют амилоидные фибриллы со своих концов (Duennwald et al., 2012; Gao et al., 2015). (C) HtrA1 человека представляет собой АТФ-независимую сериновую протеазу, которая функционирует как гомотример. HtrA1 обладает зависимой от домена PDZ способностью разбирать фибриллы Aβ и тау с последующим протеолизом с помощью его домена сериновой протеазы (Poepsel et al., 2015).
Рис. 4.
Дезагрегазные устройства для амилоида. (A) Hsp104 — это ААА + АТФаза, обладающая способностью эффективно фрагментировать прионы дрожжей, чтобы обеспечить их наследование дочерними клетками. Hsp104 может фрагментировать амилоидные фибриллы путем частичной или полной транслокации полипептида из фибриллы, создавая таким образом точку разрыва (Sweeny and Shorter, 2016). (B) Белки семейства Hsp70 содержат нуклеотид-связывающий домен и субстрат-связывающий домен. Полипептиды, захваченные в фибриллы, рекрутируются в субстрат-связывающий домен Hsp70 белками семейства Hsp40.Сопутствующее связывание Hsp40 и субстрата с Hsp70 способствует гидролизу АТФ и конформационному изменению Hsp70 до закрытого состояния, которое захватывает субстрат. Затем с помощью плохо изученного механизма, в сочетании с белками семейства Hsp110, факторами обмена нуклеотидов для Hsp70, полипептид извлекается и реорганизуется в его нативную конформацию (Nillegoda and Bukau, 2015; Torrente and Shorter, 2013). Этот процесс может потребовать от Hsp110 взаимодействия с субстратом и гидролиза АТФ (Mattoo et al., 2013; Scior et al., 2018; Короче, 2011). Hsp110, Hsp70 и Hsp40 преимущественно деполимеризуют амилоидные фибриллы со своих концов (Duennwald et al., 2012; Gao et al., 2015). (C) HtrA1 человека представляет собой АТФ-независимую сериновую протеазу, которая функционирует как гомотример. HtrA1 обладает зависимой от домена PDZ способностью разбирать фибриллы Aβ и тау с последующим протеолизом с помощью его домена сериновой протеазы (Poepsel et al., 2015).
Многие белки принимают конформацию амилоида для выполнения полезных функций в различных организмах (Harvey et al., 2017; Hufnagel et al., 2013; Ярош и Хурана, 2017). У человека они включают белок премеланосомы (PMEL) (рис. 2A) (Berson et al., 2003; Fowler et al., 2006; Watt et al., 2009), белок, связывающий элемент цитоплазматического полиаденилирования (CPEB) 3 (рис. 2B) (Drisaldi et al., 2015; Fioriti et al., 2015; Pavlopoulos et al., 2011; Stephan et al., 2015), несколько полипептидов в семенной жидкости человека (вставка 1) (Castellano and Shorter, 2012; Roan et al., 2017) и пептидные гормоны (вставка 1) (рис. 2C) (Maji et al., 2009). Понимание различий между функциональными и патологическими амилоидами может помочь в борьбе с амилоидом при заболевании.
CPEB3 человека представляет собой РНК-связывающий белок (RBP) с N-концевым доменом низкой сложности (LCD), обогащенный глутамином. Эта область похожа на прионный домен в Aplysia CPEB, который позволяет Aplysia CPEB образовывать инфекционные амилоиды, называемые прионами (вставка 2), которые лежат в основе LTP (Shorter and Lindquist, 2005; Si et al., 2003а, б). CPEB3 проявляет прионоподобное поведение у дрожжей (Si et al., 2003b; Stephan et al., 2015). В своем базальном состоянии синаптический CPEB3 растворим и репрессирует трансляцию целевых мРНК в синаптическом цитозоле (Fig. 2B) (Fioriti et al., 2015). При стимуляции нейронов (рис. 2B, этап 1) CPEB3 фибриллирует (рис. 2B, этап 2) и запускает полиаденилирование и повышенную трансляцию специфических транскриптов, необходимых для LTP, включая рецепторы AMPA (рис. 2B, этап 3) (Fioriti et al. ., 2015). В отличие от патогенных амилоидов фибрилляция CPEB3 поддерживает синаптическую пластичность, частично из-за посттрансляционных модификаций, регулирующих его растворимость (Drisaldi et al., 2015; Фиорити и др., 2015). В своем базальном растворимом состоянии CPEB3 является SUMOylated, предотвращая его агрегацию, но при синаптической стимуляции CPEB3 убиквитилирован и deSUMOylated, что способствует сборке CPEB3 в активные фибриллы (рис. 2B, этап 2) (Drisaldi et al., 2015; Pavlopoulos et al. др., 2011). SUMOylation может регулировать амилоидогенез за счет увеличения растворимости белка, но в других случаях может способствовать агрегации и токсичности (Drisaldi et al., 2015; Krumova et al., 2011; Krumova and Weishaupt, 2013; Lee et al., 2013; О’Рурк и др., 2013; Ротт и др., 2017).
Вставка 2. Прионы — возбудители болезней или эволюционно выгодные структуры? Прионыпредставляют собой инфекционные белки, которые обычно размножаются через инфекционную самовоспроизводящуюся амилоидную форму (Cushman et al., 2010; Prusiner, 1998; Shorter and Lindquist, 2005). Инфекционный амилоид превращает правильно свернутые прионные белки в самошаблонную форму амилоида, тем самым создавая цепную реакцию неправильного свертывания белков (Aguzzi and Calella, 2009; Collinge, 2001; Prusiner, 1998; Shorter and Lindquist, 2005).Прионы, образованные прионным белком млекопитающих (PrP), вызывают болезнь Крейтцфельдта-Якоба (CJD), синдром Герстмана-Штройсслера-Шейнкера, фатальную семейную бессонницу и куру у людей, скрепи у овец, губчатую энцефалопатию крупного рогатого скота (BSE) у крупного рогатого скота и хроническое истощение. в шейках матки (Prusiner, 1998; Shorter, Lindquist, 2005). Прионные формы PrP могут распространять болезнь среди людей разных видов (Prusiner, 1998; Shorter and Lindquist, 2005). Новые хозяева были инфицированы прионами в результате переливания зараженной крови, гормона роста и медицинских инструментов (Aguzzi and Calella, 2009; Dormont, 1996; Peden et al., 2004). Другие случаи CJD связаны с потреблением мяса крупного рогатого скота, содержащего прионы, вызывающие BSE, широко известную как болезнь коровьего бешенства (Dormont, 2002; Mok et al., 2017). Точно так же куру, еще одна прионная болезнь человека, может распространяться через каннибалистическое потребление инфицированного мозга (Haik and Brandel, 2014). В контексте этих болезней человека прионы очень вредны, но в других контекстах прионы могут давать полезные наследственные фенотипы. У дрожжей прионы Sup35 и Mot3 обладают селективными преимуществами в стрессовой и быстро меняющейся среде (Harvey et al., 2017; Ярош и Хурана, 2017; March et al., 2016; Шортер и Линдквист, 2005). Терминатор транскрипции Rho из Clostridium botulinum может образовывать прион в контексте E. coli и дрожжей, хотя эти предполагаемые прионы Rho не встречаются в C. botulinum , и неясно, могут ли они быть полезные, нейтральные или вредные (Yuan and Hochschild, 2017).
PMEL образует амилоид в органеллах биосинтеза меланина, называемых меланосомами (Berson et al., 2003; Fowler et al., 2006). Внутри меланосом фибриллы PMEL поддерживают архитектуру органелл и биосинтез меланина и не являются по своей природе токсичными для меланоцитов (Berson et al., 2003; Fowler et al., 2006). Доброкачественная природа амилоида PMEL является результатом жесткой пространственно-временной регуляции фибриллогенеза (рис. 2А). Фибрилляция PMEL строго локализована на участках биогенеза меланасомы, сводя к минимуму вредные взаимодействия с другими белками (Ho et al., 2016; Watt et al., 2013). PMEL синтезируется как интегральный мембранный гликопротеин в эндоплазматическом ретикулуме, входит в секреторный путь и посттрансляционно модифицируется в транс-сети Гольджи (рис.2А) (Ho et al., 2016; Watt et al., 2013). PMEL достигает плазматической мембраны и подвергается эндоцитозу перед сортировкой в эндосомные компартменты, которые созревают в меланосомы (Fig. 2A) (Ho et al., 2016; Watt et al., 2013). Только на этой стадии PMEL расщепляется на фибриллогенный фрагмент и высвобождается в просвет. Однако фибрилляция PMEL ограничена люминальной поверхностью внутрипросветных пузырьков (рис. 2A, стадии I и II) (Ho et al., 2016; Watt et al., 2013). Формирование супрамолекулярных структур маскирует амилоидогенное ядро фибрилл PMEL, уменьшая любую секвестрацию близлежащих белков (рис.2А, стадии III и IV) (Fowler et al., 2006; Raposo et al., 2001). Зрелые фибриллы PMEL способствуют биосинтезу меланина, ключевой функции меланосом (Fowler et al., 2006). Фибриллы PMEL укладываются сбоку, образуя листы, которые служат каркасом для концентрирования меланина (Fowler et al., 2006). Эти функции PMEL зависят от амилоидных структур, которые собираются локально и быстро. Таким образом, любые токсичные олигомеры PMEL, которые могут образовываться до образования амилоида, существуют лишь временно (Fowler et al., 2006).
Хотя функциональные амилоиды могут быть биофизически сходными с патологическими амилоидами, их агрегация в значительной степени регулируется строгой компартментализацией и посттрансляционным процессингом.Многие белки, которые образуют патологические амилоиды, также могут регулироваться с помощью этих механизмов, но легко избегают регуляторных проверок и подвергаются несоответствующему амилоидогенезу. Ярким примером является параллель между процессингом PMEL и белка-предшественника амилоида (APP). Оба белка-предшественника экспрессируются как мембранные белки и расщепляются до своих зрелых форм (Benilova et al., 2012; Rochin et al., 2013; Watt et al., 2013). Однако PMEL специфически разделен на меланосомы (Watt et al., 2013), тогда как образование нейротоксичных амилоид-бета (Aβ) пептидов (особенно Aβ42 и Aβ43) происходит из-за неправильного расщепления АРР β- и γ-секретазами вместо α-секретазы (Benilova et al., 2012). Таким образом, тонкие изменения в регуляции могут высвободить разрушительные амилоидогенные виды.
Хотя многие белки образуют функциональный амилоид, некоторые амилоиды являются патологическими. Высокая термодинамическая стабильность и проницаемость способствуют патогенности амилоида (Cushman et al., 2010; Го и Ли, 2014 год; Джакер и Уокер, 2013; Ноулз и др., 2014). Амилоиды могут размножаться посредством самовоспроизведения, что превращает нативно свернутые копии белков в амилоидную форму (Nelson et al., 2005). Стабильность амилоида способствует накоплению и препятствует протеостазу. Механизмы агрегации патологических белков и их токсичности до конца не изучены (Jucker and Walker, 2013; Knowles et al., 2014). Интересно, что в экспериментальных условиях и в условиях болезни амилоидные фибриллы могут распространяться между клетками внутри человека, внося свой вклад в классические модели прогрессирования заболевания (Clavaguera et al., 2009; Кушман и др., 2010; де Калиньон и др., 2012; Го и Ли, 2014 год; Джакер и Уокер, 2013; Улусой и др., 2013; Volpicelli-Daley et al., 2011). Кроме того, прионы могут естественным образом распространяться между людьми в популяции (вставка 2) (Choi et al., 2016; Cushman et al., 2010; Prusiner, 1998; Terry et al., 2016).
Болезнь Альцгеймера (БА) — распространенное нейродегенеративное заболевание, при котором Aβ собирается в нерастворимые амилоидные фибриллы, которые накапливаются во внеклеточных нейритных бляшках (Batarseh et al., 2016; Бенилова и др., 2012; Giasson et al., 2003b; Харди и Селькое, 2002; Селькое и Харди, 2016). Накопление бляшек сопровождается нарушением синаптической функции, атрофией нейронов гиппокампа и коры головного мозга, деменцией и когнитивными нарушениями (Braak, Braak, 1991; Khan et al., 2014; Thal et al., 2002). Некоторые предполагают, что фибриллы Aβ или растворимые олигомеры Aβ внутренне токсичны для клеток, в то время как другие предполагают, что олигомеры или фибриллы Aβ усиливают образование клубков тау (Guo and Lee, 2014; He et al., 2018). Фибриллы Aβ также участвуют в церебральной амилоидной ангиопатии (CAA), где они накапливаются в сосудистой сети головного мозга, вызывая кровотечение, инсульт и воспаление (Batarseh et al., 2016; Love et al., 2009).
Aβ образуется в результате расщепления мембранного белка APP β- и γ-секретазами с образованием пептидов Aβ из 36–43 аминокислот, включая амилоидогенные пептиды Aβ40, Aβ42 и Aβ43 (Benilova et al., 2012; Bossy-Wetzel et al., 2004; Селькое, 2001; Wälti et al., 2016). Обычно АРР расщепляется α- и γ-секретазами на пептиды-предшественники α и C83, из которых образуются пептиды p3 (Selkoe, 2001). Патологическое расщепление АРР β-секретазой происходит при спорадической БА, но миссенс-мутации АРР, такие как K595N / M596L в сайте β-расщепления, могут вызывать повышенную продукцию Aβ и раннее начало БА (Benilova et al., 2012; Citron et al. , 1992; Hardy, Selkoe, 2002; Selkoe, Hardy, 2016). Альтернативные миссенс-мутации в АРР, такие как арктическая мутация (E693G), вызывают снижение продукции Aβ, но усиливают образование протофибрилл Aβ (Benilova et al., 2012; Nilsberth et al., 2001; Сент-Джордж-Хислоп, 2000). Другие мутации в сайте γ-расщепления приводят к различным соотношениям Aβ40, Aβ42 и Aβ43 (St George-Hyslop, 2000).
ПептидыAβ проявляют дифференциальную токсичность. Aβ43 является наиболее цитотоксичным, а Aβ40 — наиболее благоприятным (Benilova et al., 2012; Burnouf et al., 2015; Saito et al., 2011; Seither et al., 2014). Фибриллы Aβ43 придают наибольшую токсичность in vivo и усиливают токсичность Aβ40 (Benilova et al., 2012; Burnouf et al., 2015; Сайто и др., 2011). Фибриллы Aβ40 и Aβ42 принимают S-образную конформацию коротких β-тяжей, связанных перегибами, образуя стеки в регистре параллельных перекрестных β-субъединиц (Colvin et al., 2016; Tycko, 2016; Wälti et al., 2016). Вероятно, важно, что C-концевой участок Aβ экспонируется на поверхности фибрилл Aβ42, но секвестрируется в сердцевине фибрилл Aβ40 (Colvin et al., 2016; Tycko, 2016; Wälti et al., 2016). Эти различия могут объяснить степень нейротоксического взаимодействия (Bertini et al., 2011; Колвин и др., 2016; Paravastu et al., 2008; Тыко, 2016; Wälti et al., 2016). Примечательно, что Aβ40 и Aβ42 образуют облако различных структур фибрилл при AD, при этом более быстро прогрессирующая AD связана с более отчетливыми структурами фибрилл Aβ40 и Aβ42 (Lu et al., 2013; Qiang et al., 2017).
Тау, изначально неупорядоченный, связывающий микротрубочки белок, также образует амилоиды, связанные с БА (Giasson et al., 2003b; Lee et al., 1991). Амилоидные фибриллы тау образуют внутриклеточные нейрофибриллярные клубки (NFT) в мозге с БА, а также обнаруживаются при лобно-височной деменции (FTD), болезни Пика, прогрессирующем надъядерном параличе, болезни Паркинсона (PD) и деменции с тельцами Леви (DLB) (Giasson et al., 2003b; Ли и др., 1991). Мутации в гене MAPT , кодирующем тау, связаны с FTD, и некоторые из них, включая P301L, V337M и R406W, ускоряют фибрилляцию тау (Ballatore et al., 2007; Goedert and Jakes, 2005; Nacharaju et al., 1999).
Видным белком, связанным с PD и DLB, является α-синуклеин (αSyn; кодируется SNCA ), который по своей природе неупорядочен и образует амилоидные включения, называемые тельцами Леви (LB) (Bossy-Wetzel et al., 2004; Chu and Kordower , 2010; Giasson et al., 2003b; Spillantini et al., 1997). LB образуются в различных областях мозга, вызывая спектр клинических проявлений. Классическая БП связана с патологией черной субстанции и двигательными симптомами, в то время как патология ДЛБ находится в лобной коре и вызывает когнитивные симптомы (Braak et al., 2003; Giasson et al., 2003b; Кляйн и Вестенбергер, 2012). Мутации в гене SNCA , таком как A53T, E46K и A30P, вызывают раннее начало болезни Паркинсона. A53T и E46K ускоряют фибрилляцию αSyn, тогда как A53T, E46K и A30P ускоряют образование токсичных преамилоидных олигомеров αSyn (Conway et al., 2000; Fredenburg et al., 2007; Greenbaum et al., 2005; Klein and Westenberger, 2012 ; Оно и др., 2011).
Болезнь Хантингтона (БХ) характеризуется хореей, поведенческими и психическими расстройствами, когнитивными нарушениями и в некоторых случаях деменцией (Roos, 2010).HD влияет на полосатое тело (Roos, 2010). При HD расширение CAG-повтора в экзоне 1 гена Хантингтина кодирует расширение полиглутаминового (polyQ) повтора в N-концевой области мутантного белка Хантингтина (Htt), ускоряя амилоидогенез (Scherzinger et al., 1997). Длина расширения обратно коррелирует с возрастом начала HD в доминирующей манере (Huntington’s Disease Collaborative Research Group, 1993; Lee et al., 2012). Инфракрасная микроспектроскопия включений Htt выявила значительную степень структурного полиморфизма, включая включения амилоида в более серьезно пораженных областях мозга (André et al., 2013; Nekooki-Machida et al., 2009). Примечательно, что расширения CAG-повторов также претерпевают связанную с повторами трансляцию не-ATG (RAN), давая полиаланиновые, полисериновые, полилейциновые и полицистеиновые пептидные повторы, которые агрегируются в головном мозге пациентов с HD (Bañez-Coronel et al., 2015).
Боковой амиотрофический склероз (БАС) проявляется прогрессирующим истощением мышц и слабостью, достигающей кульминации в параличе в результате дегенерации верхних и нижних мотонейронов (Taylor et al., 2016). БАС связан с белковыми агрегатами, которые не всегда реагируют с диагностическими амилоидными красителями (Bigio et al., 2013; Furukawa et al., 2011; Kerman et al., 2010; Lee and Kim, 2015; Robberecht and Philips, 2013; Робинсон и др., 2013). Мутации супероксиддисмутазы 1 (SOD1) лежат в основе ~ 20% семейных случаев БАС, а мутанты SOD1 могут образовывать амилоидные фибриллы (Иванова и др., 2014; Lee, Kim, 2015; Рентон и др., 2014). Трансгенные мыши, экспрессирующие человеческую SOD1 h56R / h58Q или ALS-связанные варианты SOD1 G37R, G85R или G93A, присутствующие с фибриллярными (тиофлавин-S-реактивными) включениями SOD1 (Wang et al., 2002). Кроме того, SOD1 образует фибриллы in vitro с амилоидоподобными характеристиками (Chan et al., 2013; Chia et al., 2010; Ivanova et al., 2014). Важно отметить, что синтетический амилоид SOD1 может размножаться в культурах нейронов и индуцировать ALS-подобные фенотипы у мышей (Ayers et al., 2016a, b; Münch et al., 2011).
Примерно в 97% случаев БАС цитоплазматические агрегаты TDP-43, RBP с прионоподобным доменом (PrLD), обнаруживаются в дегенерирующих двигательных нейронах (Guo and Shorter, 2017; Johnson et al., 2009; Ling et al., 2013; Neumann et al., 2006). Человеческие PrLD обладают аминокислотным составом, аналогичным прионным доменам дрожжей, которые представляют собой ЖК-дисплеи, обогащенные глицином и полярными незаряженными аминокислотами, включая глутамин, аспарагин, тирозин и серин (Alberti et al., 2009; Harrison and Shorter, 2017; Kim et al. ., 2013; March et al., 2016; Шортер, Линдквист, 2005). В случаях БАС без агрегатов TDP-43 или SOD1 цитоплазматические агрегаты FUS, другой RBP с PrLD, обнаруживаются в дегенерирующих нейронах (Harrison and Shorter, 2017; Ling et al., 2013; March et al., 2016; Sun et al., 2011). Дополнительные RBP с PrLD также объединяются в ALS, включая TAF15 и EWSR1 (Couthouis et al., 2012, 2011; Harrison and Shorter, 2017).
Мультисистемная протеинопатия (MSP) — это наследственное дегенеративное заболевание, которое может поражать мышцы, кости и нервную систему. Два других RBP с PrLD, гетероядерная (hn) RNPA1 и hnRNPA2, образуют цитоплазматические агрегаты в дегенерирующих тканях (Kim et al., 2013). TDP-43, FUS, hnRNPA1 и hnRNPA2 являются преимущественно ядерными RBP, которые перемещаются в цитоплазму и из нее, но секвестрируются в цитоплазматические агрегаты во время болезни (Harrison and Shorter, 2017). Эти RBP выполняют важные функции в транскрипции, трансляции, сплайсинге пре-мРНК, процессинге РНК, а также локализации и транспорте мРНК (Alami et al., 2014; Colombrita et al., 2009; Kiebler and Bassell, 2006; Kim et al., 2013 ). Мутации в последовательности ядерной локализации (NLS) FUS способствуют неправильной локализации цитоплазмы и вызывают БАС (Bosco et al., 2010; Дорманн и др., 2010; Квятковски и др., 2009; Ling et al., 2013; Vance et al., 2009). Напротив, большинство связанных с заболеванием мутаций в TDP-43, hnRNPA1 и hnRNPA2 локализуются в PrLD, что может усиливать склонность к фибрилляции (Johnson et al., 2009; Kim et al., 2013; March et al., 2016). ; Шортер и Тейлор, 2013).
Семейная амилоидная полинейропатия (FAP) отличается накоплением амилоидных отложений транстиретина (TTR) в периферической нервной системе (Eisele et al., 2015; Планте-Борденёв и Саид, 2011). TTR представляет собой стабильный тетрамерный белок, который транспортирует тироидный гормон, тироксин и ретинол-связывающий белок, связанный с ретинолом, в сыворотке и спинномозговой жидкости (Planté-Bordeneuve and Said, 2011). TTR также служит шапероном и ингибирует амилоидогенез Aβ и микробного CsgA (Jain et al., 2017; Liu and Murphy, 2006). При FAP мутации дестабилизируют тетрамеры TTR, способствуя диссоциации на мономеры, которые обнажают гидрофобные остатки, которые управляют быстрым амилоидогенезом посредством нисходящей полимеризации (DP, рис.1Б) (Hurshman et al., 2004). Накопление амилоида TTR приводит к снижению плотности нервных волокон и дегенерации периферических нейронов (Coelho et al., 2016).
Амилоидоз не ограничивается нейродегенеративным заболеванием. В самом деле, несколько полипептидов, включая TTR, легкие цепи иммуноглобулина и сывороточный амилоид А, образуют амилоиды, которые накапливаются до изнурительного уровня повреждения тканей (Wechalekar et al., 2016). Кроме того, амилин представляет собой пептидный гормон, секретируемый β-клетками поджелудочной железы, который ингибирует секрецию глюкагона.Почти у всех пациентов с диабетом II типа амилин накапливается в амилоидных отложениях в поджелудочной железе (Westermark and Westermark, 2013; Westermark et al., 2011). Фибриллы амилина и преамилоидные олигомеры способствуют дегенерации β-клеток поджелудочной железы при диабете II типа (Abedini et al., 2016; Cao et al., 2013; Hebda and Miranker, 2009; Krotee et al., 2017). Амилоидогенез также происходит при раке. Таким образом, p53 (также известный как Tp53) может секвестрироваться в амилоидные формы, что снижает его активность по подавлению опухоли в раковых клетках (Silva et al., 2014; Xu et al., 2011). Примечательно, что рационально разработанные пептидные ингибиторы амилоидогенеза p53 могут спасти опосредованное p53 подавление опухолей при карциномах яичников (Soragni et al., 2016).
Белки могут образовывать амилоиды посредством различных механизмов (Fig. 1B-D). Некоторые амилоидогенные белки, такие как тау и αSyn, изначально развернуты (Cleveland et al., 1977; Del Mar et al., 2005; Mukrasch et al., 2009; Weinreb et al., 1996). Структурное расстройство обнажает короткие сегменты белков, называемые стерическими застежками-молниями, которые могут образовывать перекрестно-β шипы амилоидных фибрилл посредством гомотипических встречно-штыревых взаимодействий в параллельном или антипараллельном расположении (Goldschmidt et al., 2010; Nelson et al., 2005; Rodriguez et al., 2015) ). Хотя стерические мотивы застежки-молнии являются общей чертой белков, они обычно располагаются в складчатых областях и поэтому недоступны для амилоидогенных взаимодействий (Goldschmidt et al., 2010). Многие белки имеют один внутренне развернутый домен (например,грамм. a PrLD), который может управлять амилоидогенезом, в то время как остальной белок остается правильно свернутым (King et al., 2012; Li et al., 2013). Кроме того, мутации в развернутых доменах могут привести к появлению мощных стерических застежек-молний, которые ускоряют фибрилляцию, наблюдаемую при заболеваниях, таких как MSP-сцепленная hnRNPA1 D262V и hnRNPA2 D290V (Kim et al., 2013; Molliex et al., 2015; Shorter and Taylor , 2013). Действительно, в этих случаях болезненная мутация, вероятно, смещает фибрилляцию к патологическому механизму, основанному на застежке-молнии, и от механизма низкой сложности, богатого ароматическими веществами, на основе изогнутого сегмента (LARK), который может лежать в основе биогенеза безмембранных органелл (Hughes et al., 2018). Экспансии глутаминовых повторов легко образуют кросс-β-структуры, как это видно с расширениями polyQ в Htt или в PrLD атаксина 1 (Banfi et al., 1994; March et al., 2016; Perutz et al., 1994; Scherzinger et al., 1997).
Для амилоидогенности мутации не нужны. При спорадических заболеваниях часто фибриллируется белок дикого типа (например, тау-белок при БА, αSyn при БП и TDP-43 при БАС). Любой белок, вероятно, может образовывать амилоид в определенных условиях окружающей среды (Fändrich and Dobson, 2002; Fändrich et al., 2001, 2003). Даже структурированные белки, такие как TTR, могут спонтанно переходить между состояниями сворачивания, способными к фибрилляции (Colon and Kelly, 1992; Hurshman et al., 2004). К развернутым состояниям можно получить доступ в стрессовых условиях, включая нагревание или денатурацию (Booth et al., 1997; Colon and Kelly, 1992; Eisele et al., 2015; Kelly, 1998). Альтернативно, внутренне развернутые домены белков дикого типа могут быть экспонированы после протеолиза, как при процессинге Aβ (Benilova et al., 2012; Hardy and Selkoe, 2002; Selkoe and Hardy, 2016).Более того, многие белки по своей природе разворачиваются, но не образуют амилоид (Dunker et al., 2008), указывая тем самым, что разворачивание необходимо, но недостаточно для амилоидогенеза. В самом деле, амилоидогенные мотивы распространены повсеместно, однако клетки, как правило, эффективны в предотвращении агрегации из-за сетей протеостаза (Balch et al., 2008).
Два различных механизма могут лежать в основе сборки амилоида: DP и ядерная конформационная конверсия (NCC) (Eisele et al., 2015). Используемый точный механизм зависит от конкретного белка. При DP лимитирующей стадией является диссоциация стабильных нативных олигомеров на амилоидогенные мономеры, которые быстро фибриллируют (рис. 1B) (Eisele et al., 2015; Hurshman et al., 2004; Lai et al., 1996). Здесь лаг-фаза сборки диктуется медленной разборкой нативных олигомеров (Eisele et al., 2015). FAP-связанные мутации в TTR дестабилизируют нативный тетрамер и способствуют образованию амилоидогенных мономеров (рис. 1B) (Eisele et al., 2015; Hammarstrom et al., 2003). Как правило, амилоиды, образующиеся посредством DP, демонстрируют низкую посевную активность (рис. 1B), что может препятствовать эффективной передаче амилоидного фенотипа (Castellano et al., 2015b; Eisele et al., 2015; Hurshman et al., 2004; Lai et al., др., 1996; Вестермарк, Вестермарк, 2008). Действительно, амилоид с плохой посевной активностью вряд ли будет проявлять прионное поведение (вставка 2).
NCC является разновидностью более ранних моделей нуклеированной полимеризации (Jarrett and Lansbury, 1993), но более точно объясняет сигмоидальную кинетику и концентрационную зависимость спонтанного амилоидогенеза (Lee et al., 2011b; Серио и др., 2000; Шортер и Линдквист, 2004). В NCC растворимые мономеры изначально находятся в равновесии с расплавленными растворимыми олигомерами (рис. 1C) (Scheibel and Lindquist, 2001; Serio et al., 2000). Во время лаг-фазы сборки эти расплавленные растворимые олигомеры постепенно перестраиваются в амилоидогенные олигомеры, которые быстро образуют кросс-β-ядра, завершая лаг-фазу (рис. 1C) (Krishnan et al., 2012; Krishnan and Lindquist, 2005; Scheibel and Lindquist, 2001; Serio et al., 2000; Shorter, Lindquist, 2004, 2005).После образования перекрестно-β-ядер фибрилляция происходит быстро, поскольку ядра рекрутируют и превращают растворимые мономеры (и расплавленные растворимые олигомеры) в перекрестно-β-форму на растущих концах фибрилл (рис. 1C) (Krishnan et al., 2012; Krishnan and Lindquist , 2005; Scheibel et al., 2004; Serio et al., 2000; Shorter, Lindquist, 2004). Преформированные фибриллы устраняют лаг-фазу образования амилоида посредством немедленного моделирования конформации амилоида (Fig. 1C) (Lee et al., 2011b; Serio et al., 2000; Shorter and Lindquist, 2005).Этот механизм посева позволяет амилоидам преобразовывать неамилоидные копии белка в амилоидное состояние и способствует передаче фенотипов, кодируемых амилоидом (Shorter, 2010; Shorter and Lindquist, 2005).
Обычно самотемплинг амилоидом является высокоспецифичным из-за структурных ограничений, обеспечиваемых первичной последовательностью (Del Mar et al., 2005; Riek and Eisenberg, 2016). Таким образом, другие копии того же белка эффективно превращаются в амилоидную форму.В редких случаях амилоидные формы одного белка могут «перекрестно» фибриллировать другой белок. В частности, αSyn может способствовать фибрилляции тау (Giasson et al., 2003a) и перекрестной полимеризации прионов Rnq1 прионов Sup35 (Derkatch et al., 2004; Duennwald et al., 2012). Перекрестный посев имеет тенденцию быть неэффективным, и после образования ядра амилоида преобладает самосев (Derkatch et al., 2004).
Высокие локальные концентрации развернутых ЖК-белков могут способствовать разделению фаз жидкость-жидкость (LLPS), которое лежит в основе образования безмембранных органелл, включая стрессовые гранулы (SG) и ядрышки (Brangwynne, 2013; Brangwynne et al., 2015; Feric et al., 2016; Franzmann et al., 2018; March et al., 2016; Нотт и др., 2016, 2015; Шин и Брэнгвинн, 2017; Короче, 2016б; Чжу и Брэнгвинн, 2015). LLPS управляется временными, слабыми межмолекулярными ассоциациями PrLD и других доменов внутри RBP, таких как hnRNPA1, TDP-43 или FUS (рис. 1D) (Burke et al., 2015; Conicella et al., 2016; Lin et al., 2015; Monahan et al., 2017; Shorter, 2017b). В жидком состоянии взаимодействия между PrLD лабильны, возможно, даже включая временные перекрестные β-взаимодействия (Molliex et al., 2015; Мураками и др., 2015; Мюррей и др., 2017; Patel et al., 2015). Однако, если эти RBP сохраняются в жидком состоянии с разделенной конденсированной фазой, они в конечном итоге образуют стабильные гидрогели и патологические фибриллы аналогично NCC, но в макроскопическом масштабе (рис. 1D) (Guo and Shorter, 2015; Kato et al. ., 2012; Kato, McKnight, 2017; Lin et al., 2015; Molliex et al., 2015; Murakami et al., 2015; Patel et al., 2015; Shin et al., 2017). Примечательно, что связанные с БАС мутации в PrLD hnRNPA1 и FUS ускоряют переходы из жидкого состояния в гелеобразное, что, вероятно, ускоряет болезнь (Molliex et al., 2015; Patel et al., 2015).
Как зрелые амилоидные фибриллы влияют на уровни токсичных растворимых олигомеров? Хотя ответ на этот вопрос обсуждается, кинетический анализ фибрилляции Aβ42 предполагает наличие вторичного механизма зародышеобразования: при критических концентрациях боковая сторона амилоидных фибрилл катализирует сборку мономерных пептидов или расплавленных олигомеров в токсичные растворимые олигомеры (рис. 1C). ) (Коэн и др., 2013). Боковые поверхности фибрилл действуют как матрица, по отношению к которой мономеры или расплавленные олигомеры могут быстро превращаться в амилоидогенные олигомеры. Эти амилоидогенные олигомеры затем отслаиваются и созревают в свои собственные фибриллы, внося вклад в порочную петлю прямой связи быстрой сборки амилоида (Cohen et al., 2013). Сочетание аспектов NCC, событий вторичной нуклеации и нечастой фрагментации фибрилл обеспечивает достаточную степень свободы для точного описания кинетики сборки амилоида (Cohen et al., 2013; Knowles et al., 2009, 2014).
Понимание того, какие шаги являются критическими в амилоидогенезе, дает представление о возможных вмешательствах. При NCC могут быть полезны агенты, которые предотвращают переход от расплавленных олигомеров к амилоидогенным ядрам, такие как полифенол чая EGCG, который способствует образованию нетоксичных олигомеров, не участвующих в метаболизме (Bieschke et al., 2010; Eisele et al., 2015; Робертс и др., 2009; Робертс и Шортер, 2008). Аналогичным образом, NCC с помощью Sup35 и Aβ42 ингибируется низкомолекулярным DAPH-12, который предотвращает созревание расплавленных олигомеров в амилоидогенные олигомеры (Wang et al., 2008).
Амилоидных фибрилл достаточно для кодирования болезни. Таким образом, введение синтетических амилоидов PrP мышам вызывает прионную болезнь (Choi et al., 2016; Colby et al., 2009; Legname et al., 2004, 2006; Wang et al., 2010), тогда как фибриллы αSyn вызывают PD -подобное заболевание (Luk et al., 2012). Однако, хотя амилоидных фибрилл достаточно, чтобы вызвать нейродегенерацию (Choi et al., 2016; Luk et al., 2012), растворимые неправильно свернутые олигомеры могут быть наиболее токсичными видами (Bucciantini et al., 2002; Конвей и др., 2000; Kayed et al., 2003; Martin et al., 2012). Теперь ясно, что неправильно свернутые олигомеры и амилоидные фибриллы неразрывно связаны, поскольку эти олигомеры образуются на боковых сторонах фибрилл (Buell et al., 2014; Cohen et al., 2013; Meisl et al., 2014). Таким образом, везде, где есть амилоид, вероятно, будут токсичные олигомеры. Белки могут приобретать токсическую функцию в неправильно свернутом состоянии, как в случае SOD1 (Bruijn et al., 1998) или FUS (Sharma et al., 2016), но белки также могут терять функциональность при неправильной укладке.Эта потеря функции может быть особенно важной для токсичности, когда основные белки, такие как TDP-43, секвестрируются в неправильно локализованных агрегированных состояниях (Guo and Shorter, 2017).
Кинетическая стабилизация полипептидов в их нативном состоянии может предотвращать амилоидогенез (Hammarstrom et al., 2001). Эта стратегия особенно привлекательна, если нативное состояние имеет определенную архитектуру, которая может быть стабилизирована небольшими молекулами (Hammarstrom et al., 2003). Действительно, амилоидогенез TTR может быть уменьшен с помощью небольшой молекулы тафамида, которая стабилизирует мутантный TTR в его нативной тетрамерной форме (рис. 1B) (Bulawa et al., 2012; Cho et al., 2015; Coelho et al., 2013, 2016). ). Тафамидис — это одобренный и эффективный метод лечения FAP в Европе, Японии, Бразилии, Аргентине, Мексике и Израиле (но, что удивительно, еще не в США). Тафамидис снижает количество амилоидов TTR и растворимых неправильно свернутых сборок TTR в FAP (Barroso et al., 2017; Coelho et al., 2012; Schonhoft et al., 2017), и остается единственным терапевтическим средством от нейродегенеративного заболевания, которое конкретно нацелено на лежащий в основе причинный амилоидогенез. Аналогичным образом, небольшие молекулы, стабилизирующие α-кристаллин, которые предотвращают и обращают вспять амилоидогенез, являются возбуждающими факторами для лечения катаракты (Makley et al., 2015).
Фибриллярная природа амилоида затрудняет определение его структуры при атомном разрешении, но были достигнуты важные успехи (Eisenberg and Sawaya, 2017; Riek and Eisenberg, 2016).Самокомплементарные β-тяжи амилоида выстраиваются перпендикулярно продольной оси фибрилл (рис. 1A), создавая поперечную β-четвертичную структуру (Nelson et al., 2005; Riek and Eisenberg, 2016; Sunde et al., 1997). . Хотя существует вариабельность амилоидов, образованных разными белками (рис. 1A), некоторые общие черты включают: β-нити, поддерживаемые стерическими застежками-молниями с участием гидрофобных боковых цепей или незаряженных полярных остатков, глутаминовые лестницы вдоль оси фибрилл и гидрофобная упаковка содержащих метил и ароматические остатки (Makin et al., 2005; Нельсон и др., 2005; Рик и Айзенберг, 2016). Различия в том, как выравниваются β-цепи, существуют среди фибрилл, образованных разными белками. Амилоидные β-листы могут выстраиваться параллельно (Benzinger et al., 1998; Nelson et al., 2005; Petkova et al., 2002). Однако также могут образовываться антипараллельные амилоидные β-листы (Qiang et al., 2012; Tycko et al., 2009).
Амилоиды также могут состоять из параллельных β-спиралей (Tsai et al., 2006).Например, HET-s образует функциональные прионы в Podospora anserina (Riek and Saupe, 2016). Прионообразующий домен HET-s собирается в параллельные β-листы, которые складываются в левостороннюю структуру β-соленоидов (Wasmer et al., 2008). Прионы Sup35 и PrP могут также принимать β-спиральные структуры (Govaerts et al., 2004; Krishnan and Lindquist, 2005; Wille et al., 2009). Примечательно, что при криоэлектронной микроскопии (крио-ЭМ) структуры тау-фибрилл пациента с БА выявляют сочетание классической укладки β-цепей и β-спиральной структуры (рис.1А) (Фитцпатрик и др., 2017). Структуры парных спиральных филаментов и прямых филаментов выявляют различия в упаковке между протофиламентами, которые придают ультраструктурный полиморфизм (Fig. 1A) (Fitzpatrick et al., 2017). Твердотельный ЯМР-анализ патогенных α-син-фибрилл выявил богатое глицином амилоидогенное ядро с расположением, напоминающим греческий ключ (рис. 1А) (Tuttle et al., 2016). Примечательно, что амилоидные фибриллы, образованные частью PrLD FUS, также имеют расположение греческих ключей, схожее с патогенными фибриллами αSyn (Murray et al., 2017). Сходным образом LARK складываются в изогнутые β-листы, которые соединяются в протофиламенты (Hughes et al., 2018).
Один белок может образовывать различные перекрестные β-структуры, называемые «штаммами». Концепция различных штаммов, кодирующих разные фенотипы, хорошо известна для прионов дрожжей и млекопитающих (Colby et al., 2009; Legname et al., 2006; Shorter, 2010; Tanaka et al., 2004). Интересно, что фенотипическая серьезность определяется, по крайней мере частично, оптимальной хрупкостью конкретного штамма фибрилл.Это означает, что скорость фрагментации фибрилл, которая высвобождает новые растущие концы фибрилл и, таким образом, образование семян и их размножение, является важным фактором в определении силы прионных фенотипов (Colby et al., 2009; Cushman et al., 2010; Legname et al., 2006; Shorter, 2010; Tanaka et al., 2006).
Амилоиды болезней человека также демонстрируют вариабельность штаммов, что приводит к гетерогенности болезни (Guo et al., 2013; Lu et al., 2013; Peelaerts et al., 2015; Qiang et al., 2017; Родригес и др., 2015). Некоторые ассоциированные с заболеванием белки могут иметь несколько стерических застежек-молний в развернутых областях, что дает несколько точек соприкосновения и, таким образом, вариации в структуре амилоида (Krotee et al., 2017; Tuttle et al., 2016). Разные штаммы фибрилл Aβ и αSyn различаются по структуре, токсичности и способности к размножению (Bousset et al., 2013; Brundin and Melki, 2017; Guo et al., 2013; King et al., 2012; Lu et al., 2013; Peelaerts et al., 2015; Qiang et al., 2017; Родригес и др., 2015). Разные штаммы Aβ и αSyn образуют in vitro в разных условиях окружающей среды (Peelaerts et al., 2015; Petkova et al., 2005; Qiang et al., 2017). Фибриллы Aβ, обнаруженные у пациентов с БА, могут быть полиморфными, при этом более агрессивные формы БА имеют более разнообразное облако структур (Lu et al., 2013; Petkova et al., 2005; Qiang et al., 2017). Отдельные штаммы выборочно засевают и размножают одну и ту же конформацию штамма in vitro (Peelaerts et al., 2015; Петкова и др., 2005; Qiang et al., 2017). Кроме того, штаммы обладают разной цитотоксичностью (Peelaerts et al., 2015). Взятые вместе, эти результаты предполагают механизм, с помощью которого один и тот же белок может лежать в основе заболеваний с различными клиническими симптомами.
В настоящее время исследуются несколько способов уменьшения или обращения вспять токсичности амилоида, в том числе стимулирование существующих механизмов разложения для ускорения выведения токсичного амилоида и олигомеров (Guo et al., 2014; Ван и Сондерс, 2014). Два основных пути внутриклеточной деградации, которые могут быть поддержаны терапевтически, — это аутофагия и убиквитин-протеасомная система (UPS) (рис. 3A – C) (Cho et al., 2014; Ciechanover and Kwon, 2015; Victoria and Zurzolo, 2015).
Аутофагия — важный путь деградации многих агрегатов, связанных с заболеванием (рис. 3A), например, образованных TDP-43 (Barmada et al., 2014), αSyn (Webb et al., 2003), полиглутамин (Yamamoto et al., 2006), тау (Falcon et al., 2017) и Aβ (Cho et al., 2014). Белки могут подвергаться опосредованной шапероном аутофагии, когда молекулярные шапероны доставляют белки в лизосому для деградации (рис. 3C) (Schneider and Cuervo, 2013) или макроаутофагии, когда они заключены в аутофагосому для доставки в лизосому посредством слияния мембран ( Рис. 3A, B) (Kulkarni, Maday, 2018; Maday, 2016). В нейронах макроаутофагия пространственно-временна организована таким образом, что аутофагосомы формируются дистально и транспортируют груз вдоль аксона для доставки к лизосомам в соме (рис.3B) (Maday and Holzbaur, 2012, 2014, 2016; Maday et al., 2012). Дефекты аутофагии, такие как нарушения каркасных белков, участвующих в транспорте аутофагосом, или неправильное закисление лизосом вовлечены в HD и AD и могут вызывать нейродегенерацию (Filimonenko et al., 2010; Hara et al., 2006; Lee et al., 2010b; Вонг и Хольцбаур, 2015). Таким образом, стимуляция аутофагии может снизить токсичность амилоида. Действительно, низкомолекулярные соединения, которые стимулируют аутофагию, улучшают клиренс TDP-43, уменьшают агрегаты и увеличивают выживаемость в нейронной модели БАС (Barmada et al., 2014). Однако при разработке активаторов аутофагии необходима осмотрительность, поскольку чрезмерная аутофагия может разрушать основные компоненты клеток или вызывать токсичность, ускоряя прогрессирование заболевания (Yamamoto and Simonsen, 2011; Zhang et al., 2011). Тем не менее, временная или периодическая активация аутофагии требует дальнейшего исследования в качестве терапевтической стратегии.
UPS — еще один путь, критически важный для деградации многих белков, и дефекты его активности были вовлечены в нейродегенерацию (рис.3C) (Ciechanover, Brundin, 2003). Таким образом, стимулирующий механизм, который доставляет неправильно свернутые белки к протеасоме (Guo et al., 2014) или стимулирует активность самой протеасомы (Leestemaker et al., 2017), может иметь терапевтическое значение. В самом деле, ингибирование деубиквитилирующего фермента Usp14 усиливает деградацию токсичных белков под действием UPS (Homma et al., 2015; Lee et al., 2010a). Также была выявлена взаимосвязь между агрегированным тау-белком и протеасомной дисфункцией (Myeku et al., 2016). Агрегаты тау связываются с протеасомой, ингибируя ее АТФазную и протеолитическую активность (Myeku et al., 2016). Этот дефект устраняется увеличением передачи сигналов цАМФ-протеинкиназа А (ПКА) с помощью ролипрама, небольшой молекулы, которая увеличивает уровни цАМФ путем ингибирования его деградации (рис. 3С). Ролипрам восстанавливает функцию протеасом, снижает совокупную нагрузку тау-белка и улучшает когнитивные функции у мышей с ранней стадией таупатии (Myeku et al., 2016). Повышение протеасомной активности в модели на ранней стадии устраняет токсичные олигомеры или мелкие фибриллы, которые вызывают размножение амилоида в соседних клетках, тем самым подавляя прогрессирование заболевания (Myeku et al., 2016). Однако Ролипрам оказался неэффективным при поздней стадии таупатии (Myeku et al., 2016).
Молекулярные шапероны и протеин-дезагрегазы поддерживают протеостаз (Mack and Shorter, 2016). Многие шапероны, например, из семейств Hsp70 и Hsp90, связывают возникающие и развернутые белки при стрессе (Mack and Shorter, 2016). Белки Hsp70 и Hsp90 способствуют укладке белков, защищая открытые гидрофобные области от агрегации (Mack and Shorter, 2016).Таким образом, шапероны являются важными ингибиторами образования амилоида (Lindberg et al., 2015). Белковые дезагрегазы могут безопасно обратить вспять образование токсичных растворимых неправильно свернутых олигомеров и амилоидных фибрилл, уменьшая количество токсичных видов и восстанавливая нативную функцию белков, секвестрированных внутри агрегатов (Mack and Shorter, 2016). Таким образом, протеин-дезагрегазы представляют собой многообещающую терапевтическую стратегию для борьбы с токсичностью как из-за увеличения, так и из-за потери функции (Shorter, 2008, 2016a, 2017a; Vashist et al., 2010).
Дрожжевой Hsp104 — одна из наиболее эффективных протеин-дезагрегаз.Hsp104 является членом семейства ААА + АТФаз размером 102 кДа с двумя нуклеотидсвязывающими доменами (Sweeny and Shorter, 2016). Шесть протомеров Hsp104 образуют смещенный гексамерный цилиндр, который гидролизует АТФ для перемещения полипептидов через его центральную пору и создания силы, необходимой для дезагрегации белков и прионов (Gates et al., 2017; Sweeny et al., 2015; Yokom et al., 2016) ). Hsp104 дезагрегирует неупорядоченные агрегаты, токсичные растворимые олигомеры, прионы дрожжей, образованные Sup35, Ure2 и Rnq1, и связанный с заболеванием амилоид, образованный αSyn, polyQ, тау, Aβ, PrP и амилином (рис.4A) (DeSantis et al., 2012; DeSantis and Shorter, 2012; Liu et al., 2011). Несмотря на отсутствие гомолога многоклеточных животных, Hsp104 надежно нейтрализует токсичность, вызываемую polyQ у червей, мух и грызунов, и αSyn A30P у крыс (Cushman-Nick et al., 2013; Lo Bianco et al., 2008; Perrin et al., 2007; Satyal et al., 2000; Vacher et al., 2005). Сконструированные потенцированные варианты Hsp104 проявляют повышенную дезагрегазную активность, которая более эффективно растворяет предварительно сформированные фибриллы αSyn, FUS и TDP-43 (Jackrel et al., 2014). Потенцированные варианты Hsp104 устраняют токсичность FUS, TDP-43 и αSyn у дрожжей, обратную агрегацию FUS в клетках млекопитающих и снижают индуцированную αSyn дофаминергическую нейродегенерацию у C. elegans (Jackrel et al., 2014; Torrente et al., 2016; Ясуда и др., 2017). Конструирование субстрат-специфических усиленных вариантов Hsp104 расширит возможности селективной дезагрегации специфических патологических субстратов для лечения амилоидозов и поможет избежать потенциальных побочных эффектов (Jackrel and Shorter, 2017).
Metazoa лишены Hsp104, но снабжены молекулярными шаперонами, способными дезагрегировать белки (Nillegoda and Bukau, 2015; Shorter, 2011; Torrente and Shorter, 2013). Дезагрегазная система многоклеточных животных состоит из членов семейств Hsp110, Hsp70, Hsp40 и малых белков теплового шока (рис. 4B) (Duennwald et al., 2012; Mattoo et al., 2013; Nillegoda and Bukau, 2015; Nillegoda et al. др., 2015, 2017; Rampelt et al., 2012; Короче, 2011; Торренте и Шортер, 2013). Дезагрегазная система многоклеточных животных дезагрегирует неупорядоченные агрегаты, а также фибриллы Sup35, αSyn и polyQ (Duennwald et al., 2012; Gao et al., 2015; Scior et al., 2018; Shorter, 2011). Hsp110, Hsp70 и Hsp40 разбирают SG у дрожжей и человека, что указывает на их способность дезагрегировать ALS-связанные белки, которые колокализуются с SG (Cherkasov et al., 2013; Kedersha et al., 1999; Kroschwald et al., 2015; Shorter and Taylor). , 2013; Walters et al., 2015; Уолтерс и Паркер, 2015). Hsp70 подавляет токсичность αSyn в клетках нейроглиомы, а фармакологическое ингибирование с помощью MAL3-101 или усиление с помощью 115-7c Hsp70 увеличивает или снижает токсичность соответственно (Kilpatrick et al., 2013). Небольшая молекула YM-01 также усиливает опосредованную Hsp70 протеасомную деградацию polyQ и tau (Abisambra et al., 2013; Wang et al. 2013). Таким образом, низкомолекулярная модуляция Hsp70 может терапевтически усилить дезагрегазную систему метазоа у пациентов.
HtrA1 представляет собой тримерную АТФ-независимую сериновую протеазу с одним C-концевым доменом PDZ, который участвует в распознавании и процессинге субстрата (рис. 4C) (Clausen et al., 2011; Hansen and Hilgenfeld, 2013; Truebestein et al., 2011). HtrA1 колокализуется с агрегатами Aβ и тау в образцах пациентов с AD, а также разбирает и разрушает фибриллы Aβ и тау (Fig. 4C) (Poepsel et al., 2015; Tennstaedt et al., 2012).HtrA1 может также разрушать амилоид TFFBI при дистрофии роговицы (Karring et al., 2012). Металлопорфирин-индуцированная олигомеризация HtrA1 усиливает его протеолитическую активность (Jo et al., 2014). Небольшие молекулы, которые увеличивают клиренс амилоида с помощью HtrA1, могут быть ценными терапевтическими средствами при некоторых нейродегенеративных заболеваниях.
Терапевтические средства, способные активировать деградацию и дезагрегацию амилоида, могут действовать совместно в борьбе с амилоидозами.Старение коррелирует с накоплением белковых агрегатов и снижением экспрессии шаперонов, аутофагии и активности протеасом (Bohnert and Kenyon, 2017; Gutsmann-Conrad et al., 1998; Kaushik and Cuervo, 2015). Таким образом, фармакологическое усиление дезагрегации, аутофагии и протеасомной активности может бороться с возрастным ухудшением протеостаза. Возможно одновременное нацеливание на несколько путей. Действительно, Hsp70 может буферизовать токсичность, способствовать убиквитилированию и деградации неправильно свернутых белков и управлять дезагрегацией белков (рис. 3C и 4B) (Abisambra et al., 2013; Auluck et al., 2002; Ebrahimi-Fakhari et al., 2013; Jinwal et al., 2013; Килпатрик и др., 2013; Мак и Шортер, 2016; Ниллегода и Букау, 2015; Торренте и Шортер, 2013; Warrick et al., 1999). Следовательно, усиление экспрессии или активности Hsp70 может стимулировать несколько путей борьбы с болезнью (Bonini, 2002). Действительно, доставка Hsp70 в качестве терапевтического средства показала перспективность при некоторых нарушениях в доклинических исследованиях (Auluck et al., 2002; Bobkova et al., 2015; Gehrig et al., 2012; Gifondorwa et al., 2007; Киркегаард и др., 2016, 2010; Warrick et al., 1999).
% PDF-1.7 % 1107 0 объект > эндобдж xref 1107 117 0000000016 00000 н. 0000004080 00000 н. 0000004326 00000 н. 0000004371 00000 п. 0000004414 00000 н. 0000004452 00000 п. 0000004832 00000 н. 0000004942 00000 н. 0000005052 00000 н. 0000005160 00000 н. 0000005267 00000 н. 0000005392 00000 п. 0000005477 00000 н. 0000005562 00000 н. 0000005648 00000 н. 0000005734 00000 н. 0000005820 00000 н. 0000005905 00000 н. 0000005990 00000 н. 0000006075 00000 н. 0000006160 00000 п. 0000006245 00000 н. 0000006384 00000 п. 0000006433 00000 н. 0000006480 00000 н. 0000006575 00000 н. 0000006676 00000 н. 0000006725 00000 н. 0000006929 00000 н. 0000007204 00000 н. 0000007589 00000 н. 0000007909 00000 н. 0000008328 00000 н. 0000008822 00000 н. 0000009011 00000 н. 0000009172 00000 н. 0000009251 00000 п. 0000010075 00000 п. 0000010797 00000 п. 0000011001 00000 п. 0000011179 00000 п. 0000011380 00000 п. 0000011540 00000 п. 0000012394 00000 п. 0000013148 00000 п. 0000013828 00000 п. 0000014523 00000 п. 0000015047 00000 п. 0000019179 00000 п. 0000019798 00000 п. 0000020282 00000 п. 0000023362 00000 н. 0000026583 00000 п. 0000026785 00000 п. 0000027162 00000 н. 0000027446 00000 н. 0000027805 00000 п. 0000255534 00000 н. 0000256082 00000 н. 0000256219 00000 н. 0000256242 00000 н. 0000256784 00000 н. 0000256909 00000 н. 0000256932 00000 н. 0000257472 00000 н. 0000257598 00000 н. 0000257621 00000 н. 0000257698 00000 н. 0000257761 00000 н. 0000257826 00000 н. 0000257885 00000 н. 0000257964 00000 н. 0000258007 00000 н. 0000258121 00000 н. 0000258196 00000 н. 0000258490 00000 н. 0000258598 00000 н. 0000258746 00000 н. 0000258870 00000 н. 0000259034 00000 н. 0000259152 00000 н. 0000259284 00000 н. 0000259424 00000 н. 0000259574 00000 н. 0000259731 00000 н. 0000259903 00000 н. 0000260009 00000 н. 0000260158 00000 п. 0000260388 00000 п. 0000260598 00000 н. 0000260794 00000 н. 0000260996 00000 н. 0000261212 00000 н. 0000261446 00000 н. 0000261646 00000 н. 0000261944 00000 н. 0000262142 00000 н. 0000262364 00000 н. 0000262530 00000 н. 0000262680 00000 н. 0000262818 00000 н. 0000263031 00000 н. 0000263125 00000 н. 0000263305 00000 н. 0000263441 00000 н. 0000263657 00000 н. 0000263789 00000 н. 0000263941 00000 н. 0000264095 00000 н. 0000264279 00000 н. 0000264409 00000 н. 0000264555 00000 н. 0000264689 00000 н. 0000264903 00000 н. 0000265081 00000 н. 0000265239 00000 н. 0000002636 00000 н. трейлер ] >> startxref 0 %% EOF 1223 0 объект > поток x ڴ U [pe> & _ R) iJ7`eF 뤔 8niiI + T) (& -v ڂ H # Z @ Uъ.ި0 Cupq30 MR fro6X3>! AUb YICL.ef7? F-K
Суетливость о нитях | Наука в классе
Сети актиновых волокон состоят из множества различных структур. Их пространственная организация поддерживает сложную регуляцию формы клеток. Динамика и механические свойства этих структур являются результатом сборки поляризованных актиновых филаментов. Филоподии, ретракционные волокна и центростремительные волокна состоят из параллельных нитей ( 1 , 2 ). Напряженные волокна и поперечные дуги имеют нити, расположенные антипараллельно ( 3 , 4 ).Ламеллиподий представляет собой плотный массив разветвленных нитей ( 5 ).
Глобальная архитектура актинового цитоскелета поддерживается за счет скоординированных действий большого количества регуляторных белков, которые модулируют сборку и разборку филаментов (6), а также за счет сократимости, управляемой моторными белками миозина ( 7 ). Моторные белки миозина также могут способствовать разборке филаментов ( 8 ). В совокупности эти наблюдения подтвердили механизм, в котором связь между сократимостью миозина и разборкой филаментов обеспечивает временную синхронность между ретроградным потоком актина спереди и разборкой филаментов в задней части мигрирующих клеток ( 9 ).
Центральным в этом механизме сцепления является то, что филаменты выбираются для сокращения или разборки, но неизвестно, какие факторы определяют ответ на сократительные силы миозина ( 10 ). Здесь мы использовали методы микроподборки геометрически контролируемых и поляризованных сетей актиновых филаментов ( 11 ), чтобы оценить, как общая полярность архитектуры актиновых филаментов определяет их реакцию — реорганизацию и / или разборку — на сократительные силы миозина.
Рост актиновых филаментов на полосчатых микрорельефах, покрытых доменом pWA белка синдрома Вискотта-Олдрича, фактором, стимулирующим актин, приводит к образованию плотной сети в области с микрорельефами и параллельному ряду нитей с зазубренными концами, ориентированными от сайт зарождения вне этой области ( 11 ) (фильм S1). Добавление миозинов к полимеризационной смеси, включая комплекс Arp2 / 3, мономеры профилина и актина, позволило нам исследовать сокращение этой сети (рис.S1). Мы использовали двуглавый (HMM) миозин VI ( 12 ), процессивный двигатель с заостренным концом, который может поддерживать постоянную силу и подвижность без необходимости самосборки в минифиламенты.
Миозины, меченные зеленым флуоресцентным белком (GFP), и мономеры актина, меченные Alexa 568, позволяют в реальном времени отслеживать рост актина и индуцированную миозином реорганизацию (Рис. 1). Миозины, связанные с сетью, индуцировали четкий двухфазный процесс, состоящий из деформации актиновых сетей с последующей массивной разборкой филаментов конденсированной центральной сети (рис.1A и фильм S2, короткие такты). В зависимости от геометрии рисунка, этот двухфазный процесс может привести к образованию волны разборки (рис. S2, длинные столбцы). Затем мы проверили, оказывает ли миозин с зазубринами, направленный на концы, подобный эффект на реорганизацию сети. Биполярные филаменты мышечного миозина II вызывали двухфазную деформацию-разборку сети, аналогичную той, что вызывается миозином VI, хотя степень деформации до разборки была локальной и менее выраженной (рис. 1B и фильм S3), предположительно из-за сопротивления со стороны сшивание нитей ( 13 ).В соответствии с этой интерпретацией, сшивающий агент актиновых филаментов, α-actinin, также минимизирует индуцированную миозином VI макроскопическую деформацию перед разборкой сети (Fig. 1C, Fig. S3, and movie S4). Различная концентрация миозина показала, что деформация и разборка происходили выше различных пороговых значений концентрации в зависимости от сетчатой актиновой сети (рис. S3).Рис. 1. Миозин-индуцированное сокращение и разборка актиновой сети. (A) Временные ряды индуцированного миозином VI сокращения сети на стержневом микрорельефе.Актиновые филаменты визуализировали с помощью флуоресцентных мономеров. Цветовая кодировка справочной таблицы «Огонь» выявляет вариации плотности актиновой сети, количественно определяемые с помощью линейного сканирования вдоль полосы в разные моменты времени. Пики плотности актина из-за деформации сети через 48 мин, затем падают из-за разборки сети. (B) То же, что (A), с сокращением, вызванным мышечным миозином II. (C) То же, что (A), с 100 нМ α-актинина в полимеризационной смеси.
Экспериментальный вопрос
Определенные типы миозиновых моторов движутся по актиновым филаментам и, как известно, играют роль в сокращении и разборке филаментов.Как миозиновые моторы решают, какие актиновые филаменты сокращать и разбирать? Влияет ли тип миозинового двигателя на это важное решение?
Метод
Чтобы исследовать экспериментальный вопрос, геометрическая ориентация актина контролировалась, миозиновые двигатели были добавлены в систему, и реакция актина была визуализирована с помощью флуоресцентной визуализации.
Расположение актина контролировали с помощью уникального метода, разработанного авторами для создания микропаттернов белка, который способствует образованию актина на стекле.
Цель микрорельефа в этом эксперименте — тщательно контролировать форму и ориентацию актина по мере его образования. После добавления форм актина и миозиновых моторов любое изменение в расположении актина можно интерпретировать как результат присутствия миозина. Этот метод микроподготовки для контроля образования актина особенно впечатляет, потому что актиновые филаменты и миозиновые двигатели ЧРЕЗВЫЧАЙНО малы (порядка одной миллиардной метра в длину!), И их трудно визуализировать или манипулировать ими.
Авторы опубликовали этот новый метод в виде патента США, а также в главе книги «Методы в клеточной биологии» .
1A Эксперимент
Анализ эмбриоидных тел, полученных из ESC, содержащих мотонейроны ChR2, с использованием конфокального сканирующего микроскопа. Эмбриоидные тельца иммуноокрашивают на маркер мотонейрона Isl 1/2. Проанализирована экспрессия следующих белков:
1) Isl1 / 2 (красный) является белком, важным для роста и поддержания двигательных нейронов, и экспрессируется во всех двигательных нейронах (т.е.е. маркер пан-мотонейрона).
2) GFP (зеленый) выражается в ESC, используемых для генерации моторных нейронов, и указывает происхождение ESC.
3) Экспрессия YFP (синий) из трансгенов ChR2-YFP указывает на происходящие из ESC двигательные нейроны, успешно экспрессирующие трансгены ChR2.
Чтобы узнать больше об иммуноокрашивании, некоторые основные принципы можно найти здесь.
Изображения были получены с помощью камеры (A), светового микроскопа (B) и сканирующего электронного микроскопа (C) и (D). Изображения, полученные с помощью микроскопии, были использованы для создания идеализированных рисунков на (E) и (F).
Наблюдение
Левая сторона (флуоресцентные изображения) на рис. 1, части A, B и C: для визуализации актина под микроскопом он был помечен («связан с») другим белком, который излучает флуоресцентный свет, когда светится другой флуоресцентный свет. Это. Этот тип микроскопии называется «флуоресцентная микроскопия». Для получения дополнительной информации о флуоресцентной микроскопии см. Это видео, опубликованное iBiology.org.
После введения миозиновых моторов в паттерны актина сеть актомиозина сжималась, деформировалась и затем разбиралась.Это наблюдается по интенсивности флуоресценции («яркости») света, испускаемого актином в течение времени после добавления миозина. «Очень яркий» означает высокую плотность актина, а «менее яркий» или «тусклый» означает низкую плотность актина. Деформация объясняется высокой плотностью актина, потому что, когда сеть деформируется, все ее волокна «сплющиваются» в одну область. Разборка объясняется низкой плотностью актина, потому что актиновые филаменты отделяются на отдельные мономеры.
(Правая часть [графики] рис.1, части A, B и C). Произвольные единицы используются для количественной оценки уровня яркости актина в три разных периода времени (красная, зеленая и синяя линии) и в разных местах вдоль полосчатого рисунка актина (x- оси, положение на линейном сканировании).
Промежуточная гипотеза и эксперимент
Оба миозина VI и II вызывают деформацию центральной сети актина перед разборкой, но миозин II индуцирует гораздо меньшую деформацию, чем миозин VI. Благодаря способности миозина II способствовать сшиванию актиновых филаментов, актиновая сеть может быть жесткой, что делает ее более устойчивой к деформации.Авторы предполагают, что сшивание актина является причиной снижения деформации актина при взаимодействии с миозином.
Чтобы проверить это, авторы вводят миозин VI в актин, как в первом эксперименте, но также добавляют белок, который сам индуцирует перекрестное связывание актина — α-актинин. Наблюдается меньшая деформация актина, чем то, что первоначально наблюдалось с одним миозином VI. Это подтверждает гипотезу о том, что сшивание актина снижает деформацию актина.
1B Результаты Новый вопрос
Параллельные и поляризованные актиновые филаменты, выходящие из участков с микрорельефом в форме стержня, не сжимаются и не разбираются ни с миозином VI, ни с II.Это указывает на то, что миозин сокращает актин по-разному в зависимости от ориентации актиновых сетей. Новый вопрос: реагируют ли случайно ориентированные актиновые филаменты на сокращение миозина иначе, чем параллельные актиновые филаменты?
Параллельные и поляризованные филаменты, выходящие из регионов с микрорельефом, их зазубренные концы ориентированы наружу (11) не сжимаются и не разбираются ни с миозином VI, ни с II (Fig. 1, A и B, и фильмы S2 и S3). Возможно, сети, состоящие из случайно ориентированных нитей, могут сжиматься и разбираться, тогда как параллельные массивы нитей — нет.Чтобы понять вклад полярности актиновых филаментов во время сокращения актомиозина, мы использовали микроскопию затухающих волн, чтобы проследить в реальном времени влияние миозина на растущую разветвленную сеть (рис. S4 и фильм S5). Сети не сокращались в присутствии миозина VI, когда они оставались отдельными участками разветвленных и параллельных нитей. Когда отдельные подсети взаимодействовали в антипараллельной ориентации, миозин быстро индуцировал деформацию сети, выстраиваясь в антипараллельные пучки (рис.S4 и фильм S5).
Этот «выбор ориентации» для избирательного сокращения и разборки антипараллельных филаментов миозином был дополнительно протестирован на сетях с контролируемой полярностью и архитектурой. Филаменты, зарождающиеся на радиальном массиве из восьми ветвей, приводят к формированию всего разнообразия в организации актина, обнаруженного в клетке, сети разветвленных и беспорядочно ориентированных актиновых филаментов на микрорельефе, пучков выровненных антипараллельных филаментов в самой центральной части массив, а пучки выровненных параллельных нитей в дистальной части массива ( 11 ) (рис.2А). Это определенное различие между зонами, содержащими параллельные, антипараллельные или разветвленные организации филаментов (Fig. 2G), позволило нам охарактеризовать региональную селективность реорганизации, индуцированной миозином. Myosin VI был выбран для того, чтобы индуцировать силы сокращения на этих структурах актина, потому что он является двигателем с заостренным концом и может тянуть филаменты с их зазубренными концами, указывающими из микропаттернов (рис. S5 и фильм S6). Добавление миозина VI в раствор привело к быстрому сокращению антипараллельных пучков и разветвленной сети с последующей их разборкой (рис.2B, центральная черная дыра после 1640 с; Рис. 2, C и D; и фильмы S7 и S8). Параллельные пучки оставались невозмущенными и продолжали вытягиваться до тех пор, пока мономеры, только что высвободившиеся при центральной разборке, не были израсходованы (рис. 2, D и E, и фильм S8), хотя миозины присутствовали на этих пучках (рис. 2F), по которым они могли перемещаться. (рис. S6). Эти процессы также можно было отслеживать на более крупных структурах, в которых было легче визуализировать антипараллельные сети (рис. S7). Таким образом, индуцированное миозином сокращение характерно для пучков антипараллельных нитей и разветвленной сети, а индуцированная миозином разборка этих структур дополнительно поставляет мономеры актина для роста параллельных пучков нитей (рис.2G).
Рис. 2. Региоселективное действие миозинов. (A) Временной ряд сборки сети на радиальном массиве с зарождением актина из восьми ветвей. (B) Временные ряды индуцированного myosin VI избирательного сокращения и разборки архитектуры (показаны актин, миозин и наложение). (C) Кимограмма флуоресценции актина вдоль параллельного пучка [синяя пунктирная линия на (B) 5180 с] и центральной области актиновых филаментов [пунктирный зеленый кружок на (B) 5180 с], показывающая различную локализацию удлинения и сокращения и разборка.(D) Интенсивность флуоресценции центральной зоны [пунктирный зеленый кружок на (B)] и параллельного пучка [синяя пунктирная линия в (B)] во времени. (E) Изменение длины параллельных пучков с течением времени в отсутствие или в присутствии миозинов. (F) Линейное сканирование интенсивности флуоресценции вдоль параллельного пучка, подтверждающее присутствие миозина на всем протяжении. (G) Схематическое изображение окончательной архитектуры на радиальном массиве с восьмью ветвями, зарождающим актин, в отсутствие или в присутствии миозинов в растворе.
Экспериментальная установка (часть A)
Чтобы проверить, как ориентация актина влияет на сократимость миозина, авторы создали новый радиальный паттерн актина, содержащий все возможные расположения актина: разветвленную сеть из случайно ориентированных актиновых филаментов, выровненные антипараллельные пучки в центральной области паттерна и выровненные параллельные пучки нитей в дистальной части узора.
Часть B
Часть B показывает только картину актина ( вверху, ), только плотность миозина ( посередине, ) и актин и миозин вместе ( внизу, ) во времени после добавления миозина VI к структуре. Антипараллельные пучки и разветвленная сетка (оба расположены в центральной области паттерна) демонстрируют сжатие, за которым следует их разборка. Об этом свидетельствует уменьшение яркости центральной области массива. Самые радиальные области массива (параллельные пучки волокон) со временем становятся длиннее.Почему это могло произойти?
, части C, D и E
Кимограф (C) показывает один «срез» радиального рисунка (отмеченный зелеными и синими точками в крайнем правом поле верхнего ряда Части B) во времени. В кимографе изображение одного и того же среза многократно снимается с течением времени и складывается рядом друг с другом (в этом случае каждый срез добавляется в конец предыдущего среза). Это интересный способ определить структурные изменения в конкретном пространственном местоположении с течением времени.Здесь параллельные пучки актина продолжают расти, поскольку антипараллельные филаменты продолжают разбираться.
Часть (D) количественно определяет рост параллельных пучков в срезе (синие точки в крайнем правом поле верхнего ряда Части B) и антипараллельных связок (зеленые точки в крайнем правом поле верхнего ряда Части B) используя интенсивность флуоресценции. На графике между вертикальными пунктирными линиями увеличение интенсивности света параллельных пучков (синяя линия) совпадает с резким уменьшением интенсивности актина в центральной зоне (зеленая линия).Это указывает на то, что плотность актиновых филаментов в центральной зоне уменьшается (разборка), тогда как параллельные филаменты увеличиваются (удлиняются). Чтобы подтвердить этот вывод, авторы оценивают только длину параллельных пучков нитей (Часть E). Этот анализ показал, что длина параллельных пучков филаментов значительно увеличивается при разборке с миозином, чем без миозина. Таким образом, миозин вызывает сокращение и разборку антипараллельных и разветвленных сетей, что в то же время вызывает удлинение параллельных пучков.Из этого авторы могут заключить, что мономеры актина, высвобождаемые при разборке актина в центральной зоне, включаются в параллельные пучки филаментов, вызывая их удлинение. Это отвечает на вопрос, заданный на вкладке «Часть B»!
Часть F и G
Несмотря на удлинение параллельных пучков актина, миозины остаются на этих пучках на протяжении всего процесса удлинения (Часть F). Мультипликационный набросок того, как выглядит паттерн актина с миозином или без него, показывает, как устроены различные ориентации актина (G).Обратите внимание на разницу между общей длиной параллельных нитей в случае «с миозином». Также обратите внимание на отсутствие разветвленной сетки и антипараллельных нитей в случае «с миозином».
Новый вопрос
Этот эксперимент установил, что миозин вызывает деформацию и разборку антипараллельного и разветвленного сетчатого актина и удлинение параллельных пучков филаментов. Мы знаем, что актин с антипараллельной и разветвленной сеткой различается по структуре — антипараллельный актин обычно устроен более упорядоченным образом, а разветвленная сетка представляет собой кластер случайно перемешанных актиновых филаментов.Новый вопрос: как миозин вызывает разборку антипараллельных филаментов в отличие от разветвленной сети актина?
Затем мы дополнительно охарактеризовали свойства сжатия пучков антипараллельных нитей и разветвленной сетки. Мы сравнили действие миозинов на актиновые кольца, в которых доля зон антипараллельных филаментов точно контролировалась (рис. 3А). Нити собираются в разветвленную сетку на полных кольцах (рис. 3А). На пунктирных кольцах нити образуют разветвленную сетку на точках, но, в частности, образуют пучки антипараллельных нитей между точками (рис.3А). Таким образом, пропорция пучков антипараллельных нитей масштабируется обратно пропорционально количеству точек в кольцах постоянного размера. Мы отслеживали сокращение и деформацию актиновой сети при добавлении миозина (рис. 3B и фильм S9). Мы измерили интенсивность флуоресценции актина и миозина во всех угловых секторах колец во время сокращения (рис. 3, C и D). Миозины сначала накапливались в актиновой сети без генерации глобальной деформации (рис. 3D, зеленая кривая до момента времени 0). Выше критического накопления миозинов началась деформация (рис.3D, время синей кривой 0). Деформация сети была связана с разборкой сети (рис. 3D, красная кривая). Кроме того, общее количество актина и миозина уменьшалось в соответствии с картиной распада, подобной таковой радиуса как полных, так и точечных колец (Рис. 3D). Как следствие, плотность актина была постоянной во время сокращения (рис. S8). Каждый сектор колец следует за тремя отдельными фазами во время ремоделирования (рис. 3E): во-первых, фаза задержки, во время которой филаменты выравниваются; во-вторых, фаза быстрого сокращения с постоянной скоростью; и, наконец, третья фаза, во время которой сеть была сильно уплотнена в центре кольца и сжатие замедлилось.Мы измерили скорость фазы быстрого сокращения, поскольку она отражает основную амплитуду изменения размера сектора. Мы сравнили скорость сжатия колец с непрерывными или пунктирными зонами зародышеобразования. Число точек и расстояние между ними были выбраны для изменения соотношения r между общей длиной разветвленной сетки, P разветвленной ( P b или Pb на фигурах) и периметром кольца P . Скорость сокращения значительно увеличивалась при уменьшении отношения r (рис.3F и фильм S10). Таким образом, для данной структуры актина скорость сокращения определяется относительными пропорциями антипараллельных пучков и разветвленной сети.
Рис. 3. Доля антипараллельных нитей регулирует скорость сокращения сети. (A) Схематическое изображение сетей актина, образованных на полных и пунктирных кольцах. (B) Временные ряды индуцированного миозином сокращения сетей актина, образованных полными (вверху) и пунктирными (внизу) кольцами. (C) Иллюстрация автоматизированного анализа сокращения сети (см. Материалы и методы).Каждый кружок представляет собой момент времени. (D) Радиус и общая интенсивность флуоресценции как актина, так и миозина были записаны для всех угловых секторов с течением времени. (E) Кинетика сужения кольца. Временные ряды значений длины (красные точки) могут быть разделены на три отдельные фазы (черная линия). (F) Измерения фазовой скорости быстрого сжатия сравнивали среди различных составов колец.
Основной вопрос
После того, как предыдущее исследование показало, что сократимость миозина ведет к деформации и разборке антипараллельного и разветвленного сетчатого актина, авторы стремятся понять, как относительное количество каждого типа актина влияет на сократимость.Главный вопрос заключается в том, как соотношение антипараллельных актиновых филаментов по отношению к количеству актина разветвленной сети влияет на сократимость, индуцированную миозином?
Экспериментальная установка (Часть A)
(Был создан другой паттерн актина, на этот раз в форме кольца. Когда создается полный кольцевой паттерн, образуется только разветвленный сетчатый актин. Это означает, что сайты зародышеобразования, полные актин-промотирующих белков, расположены очень близко друг к другу, образуя непрерывный Когда создается кольцевой узор с участками зародышеобразования, расположенными дальше друг от друга в виде «точек», актин образует разветвленную сеть в пунктирных областях, а между пунктирными областями образуются антипараллельные филаменты.Таким образом, при наличии кольца постоянного размера, чем больше разветвленных участков сетки («точечных»), тем меньше имеется участков пучка нитей («линейных»). Затем (часть B) авторы добавляют миозин к двум разным типам актиновых колец: (1) непрерывное кольцо разветвленной сети и (2) кольцо, состоящее из точечных областей разветвленной сети и прерывистых областей антипараллельных пучков филаментов.
, части C и D
Количество актина и миозина в каждом типе актинового кольца измеряли путем измерения интенсивности флуоресценции во всех областях кольца.После добавления миозина миозины накапливаются в актиновой сети в течение примерно 30 минут, не деформируя сеть. После накопления порогового уровня миозинов начинается деформация актиновой сети. После деформации актиновая сеть демонтировалась. Этот процесс был сходным как в непрерывном актиновом кольце, так и в пунктирном актиновом кольце. Когда актиновое кольцо деформировалось и разбиралось, радиус кольца уменьшался, и количество актина и миозина также уменьшалось. Как вы думаете, что это означает относительно количества актина и миозина до разборки (во время сокращения)?
Часть E и F
Актин претерпевает три фазы реорганизации после взаимодействия с миозином: (1) «медленная» фаза выравнивания филаментов, (2) «быстрая» фаза постоянного сокращения и (3) заключительная фаза замедления сокращения.Скорость сокращения во время второй фазы важна, потому что она представляет наибольшее изменение размера актинового кольца («размер сектора»). В части F сравнивается скорость сокращения во второй фазе для различных колец актина. Непрерывное кольцо актина, состоящее только из разветвленной сети, показывает самую низкую скорость сокращения. По мере уменьшения количества разветвленных нитей по отношению к общему периметру кольца (Pb / P) скорость сжатия увеличивается. Таким образом, скорость, с которой актин сокращается в результате действия миозина, зависит от количества присутствующего разветвленного и антипараллельного актина.
Скорость сокращения структуры in vivo, такой как цитокинетическое кольцо, увеличивается пропорционально ее размеру, этот процесс называется масштабируемостью, хотя молекулярные детерминанты лежащего в основе механизма не установлены ( 14 , 15 ). Чтобы оценить соответствующие вклады размера и состава кольца в скорость сокращения, мы изменили периметр кольца P и часть этого периметра, которая формирует разветвленную сетку P b (рис.4A и фильм S11). Когда P и P b увеличились одинаково, скорость сокращения не изменилась, хотя размер кольца увеличился (см. Черные и синие кольца на рис. 4A). Таким образом, масштабируемость не наблюдается, когда пропорция антипараллельных пучков и разветвленных сетей поддерживается постоянной во время увеличения размера. Когда P увеличивалось, а P b оставалось постоянным, скорость сокращения увеличивалась (см. Пары: черные, красные кольца и зеленые, синие кольца на рис.4А). Масштабируемость, таким образом, наблюдается только тогда, когда увеличение размера структуры актина сочетается с увеличением доли антипараллельных пучков.
Рис. 4. Пропорция разветвленной сети регулирует масштабируемость сжатия кольца. (A) Соответствующие эффекты размера и доли разветвленной сетки в кинетике сжатия. Мы изменили периметр кольца P и длину этого периметра, образовав разветвленную сетку P b .Изображения показывают ранний момент времени во время сборки актиновой сети на точках с микрорельефом. Измерения фазовой скорости быстрого сжатия сравнивались для различных конфигураций колец. (B) Описание модели. Филаменты собираются в антипараллельные пучки между областями зародышеобразования (левая схема). Области нуклеации (широкая черная полоса, правая схема) генерируют разветвленную сеть актина. Сила сокращения пропорциональна плотности миозинов на единицу длины филамента, ρ, силе, приходящейся на головку миозина, f , и части периметра соответствующей сети, P a для антипараллельные пучки и P b для разветвленной сетки.Плотность миозина постоянна по всему периметру P = P a + P b . Антипараллельные жгуты имеют сопротивление трения незначительно по сравнению с сопротивлением трения разветвленной сети, в которой эффективный коэффициент трения η имеет две причины: внешнее сопротивление из-за заякоривания сети в области зародышеобразования и внутреннее сопротивление из-за перепутывания ветвей нити. Баланс между общей силой сжатия и сопротивлением трения устанавливает скорость сжатия V , которая оказалась пропорциональной отношению P / P b , наблюдаемому во всех наших экспериментах.
Основной вопрос
Было установлено, что скорость сокращения выше при более низком соотношении разветвленных и антипараллельных актиновых филаментов. Это означает, что если количество разветвленных сеток осталось прежним, а количество антипараллельных нитей увеличилось (количество r = Pb / P уменьшается), скорость сокращения увеличится. Однако эта идея не рассматривает общий периметр кольца как фактор сжатия. Будет ли скорость сокращения всегда увеличиваться, если это соотношение уменьшается? Что, если общий периметр кольца также уменьшится на ту же величину, что и коэффициент? Если ответ на этот вопрос утвердительный, то процесс будет определен как «масштабируемый.«На последнем этапе этого исследования авторы решают вопрос, как доля разветвленных сетей влияет на масштабируемость скорости сжатия кольца?
Метод экспериментальной установки (Часть A)
Чтобы исследовать роль периметра кольца в скорости сократимости актина, были протестированы три сценария по отношению к контрольному случаю:
(1) увеличение количества только разветвленного актина,
(2) только увеличение периметра и
(3), увеличивая как , так и количество разветвленного актина и периметр.
Скорость сократимости изменялась обратно пропорционально изменению количества разветвленного актина, когда периметр оставался неизменным (случаи 1 и 2). Однако, когда периметр кольца и количество разветвленных сеток увеличивались одновременно, изменений в скорости сокращения не наблюдалось. Таким образом, скорость индуцированной миозином сократимости актина — это масштабируемый процесс!
Математическая модель
Поскольку биологические системы сложны и включают в себя интеграцию различных компонентов, часто бывает полезно описывать биологические явления с помощью математических моделей.Иногда создаются модели для прогнозирования биологической активности, которая еще не была обнаружена экспериментально. В других случаях модели разрабатываются для объяснения экспериментальных наблюдений. Модели предлагают возможность заменять различные гипотетические значения на переменные, которые могут обеспечить дополнительное понимание наблюдаемого процесса. Это может улучшить научную интерпретацию результатов, позволяя ученым продолжать эксперимент «вне лаборатории». Здесь авторы разрабатывают модель, которая поддерживает их наблюдения и описывает силы, проявляемые разными типами актина.Обратите внимание, что в этой статье силы никогда не измеряются и не сообщаются. Модель позволяет авторам учитывать влияние сил актина на систему, что дополняет результаты их исследования и помогает составить более полную картину процесса. Дополнительные сведения о математическом моделировании в биологии см. В опубликованном учебном пособии:
.http://www.jove.com/visualize/abstract/23063928/mat Mathematical-modeling-of-biological-systems
Интерпретация модели (Часть B)
Эта модель связывает общую силу сокращения актомиозиновой сети со скоростью сокращения.Как вы думаете, какие факторы влияют на общую силу сжатия?
Общая сила сокращения складывается из силы миозина, действующей на антипараллельные волокна, и силы миозина, действующей на разветвленную сеть. Это означает, что общая сила сжатия пропорциональна сумме сил от антипараллельных волокон и разветвленной сети:
Сокращение из-за антипараллельных нитей и разветвленной сети зависит от пропорций каждого типа актина (P a для антипараллельных и P b для разветвленных).Предполагается, что оба типа актина подвержены одинаковой плотности миозинов на единицу длины филамента (ρ) и миозин оказывает одинаковую силу на миозиновую головку (f). Подставляя это в приведенное выше уравнение, получаем:
Есть третья сила, которая влияет на сократимость актомиозина — сила «сопротивления». Сила сопротивления — это сила, препятствующая движению. В этом случае сила сопротивления представляет собой сопротивление, создаваемое жидкостью, движущейся внутри ячейки. Сопротивление создается за счет прикрепления актиновой сети к цитоскелету и скоплениям запутанных разветвленных нитей.Здесь сила сопротивления зависит от константы, называемой коэффициентом трения (η), плотности актина разветвленной сети (P b ) и скорости сокращения (V). Антипараллельные пучки актина действительно производят сопротивление, но оно настолько мало по сравнению с сопротивлением, создаваемым разветвленной сеткой, что не учитывается в этой модели. Таким образом, сила сопротивления определяется как:
Чтобы понять взаимосвязь между общей силой сжатия и силой сопротивления, можно использовать следующее соотношение:
Изменение этого уравнения может дать новое понимание того, как скорость сокращения зависит от количества актина разветвленной сети относительно периметра кольца:
Поскольку ρ, f и η являются константами, они могут быть включены в одну переменную (в данном случае C).Таким образом, скорость сокращения пропорциональна отношению количества разветвленной сетки к периметру, что подтверждает экспериментальные данные, представленные в статье.
Эти результаты демонстрируют, что вариации скорости сокращения являются результатом пропорции антипараллельных пучков филаментов, которая контролируется размером и расстоянием между областями зародышеобразования. Во всех испытанных условиях скорость V была пропорциональна отношению P / P b (рис.S9). Эти наблюдения могут быть зафиксированы с помощью простой физической модели, в которой сила сокращения была пропорциональна количеству миозинов на единицу длины филамента, а сопротивление трением было пропорционально длине разветвленной сети (рис. 4B). В этой модели разборка сети миозинами играет пассивную роль, потому что она просто предотвращает эластичную реакцию, которая может возникать из-за уплотнения сети во время сокращения, но более активная роль разборки сети во время сокращения остается возможной.
Таким образом, миозины действуют на актиновые сети способом, который зависит от ориентации актиновых филаментов. Параллельные нити выравниваются и удлиняются, тогда как антипараллельные нити сжимаются и разбираются. Мы называем такие правила селективности миозина механизмом «выбора ориентации», который не должен вызывать глобальный коллапс клеток, а должен вместо этого поддерживать общую пространственную координацию различных структур актина, регулируя их специфическую переориентацию, деформацию и разборку.
Ссылки и примечания
Л.П. Крамер, Т. Дж. Митчисон, Миозин участвует в распространении постмитотических клеток. J. Cell Biol. 131 , 179 (1995).
D. Vignjevic et al ., Формирование филоподий-подобных пучков in vitro из дендритной сети. J. Cell Biol. 160 , 951 (2003).
Л. П. Крамер, М. Зиберт, Т. Дж. Митчисон, Идентификация новых пучков актиновых нитей с градуированной полярностью в движущихся фибробластах сердца: значение для генерации движущей силы. J. Cell Biol. 136 , 1287 (1997).
А. Б. Верховский, Т. М. Свиткина, Г. Г. Борисы, Сборки филаментов Myosin II в активной ламелле фибробластов: их морфогенез и роль в формировании пучков актиновых филаментов. J. Cell Biol . 131 , 989 (1995).
Т. М. Свиткина, А. Б. Верховский, К. М. Маккуэйд, Г. Г. Бориси, Анализ системы актин-миозин II в эпидермальных кератоцитах рыб: механизм транслокации клеточного тела. J. Cell Biol. 139 , 397 (1997).
Т. Д. Поллард, Г. Г. Бориси, Подвижность клеток, управляемая сборкой и разборкой актиновых филаментов. Сотовый 112 , 453 (2003).
К. Вейгель, К. Ф. Шмидт, Перемещение в клетку: исследования молекулярных моторов с помощью одной молекулы в сложных средах. Nat. Rev. Mol. Cell Biol. 12 , 163 (2011).
Л.Хавив, Д. Гилло, Ф. Бакуш, А. Бернхейм-Гросвассер, специалист по сносу цитоскелета: Миозин II действует как агент деполимеризации актина. J. Mol. Биол. 375 , 325 (2008).
C. A. Wilson et al. ., Myosin II вносит вклад в тредмиллинг актиновой сети на клеточном уровне посредством разборки сети. Природа 465 , 373 (2010).
С. М. Броули, Р. С. Рок, Нетрадиционный трафик миозина в клетках выявляет избирательный актиновый цитоскелет. Proc. Natl. Акад. Sci. США 106 , 9685 (2009).
A.-C. Рейманн и др. . Геометрия нуклеации определяет упорядоченные структуры актиновых сетей. Nat. Матер. 9 , 827 (2010).
Э. М. Де Ла Крус, Э. М. Остап, Х. Л. Суини, Кинетический механизм и регуляция миозина VI. J. Biol. Chem. 276 , 32373 (2001).
Г. Х. Кендеринк и др. ., Активная биополимерная сеть, управляемая молекулярными двигателями. Proc. Natl. Акад. Sci. США 106 , 15192 (2009).
A. Carvalho, A. Desai, K. Oegema, Структурная память в сократительном кольце делает продолжительность цитокинеза независимой от размера клетки. Ячейка 137 , 926 (2009 г.).
M. E. Calvert et al ., Концентрация миозина лежит в основе зависящей от размера клетки масштабируемости сужения актомиозинового кольца. J. Cell Biol. 195 , 799 (2011).
H. Isambert et al. . Гибкость актиновых филаментов, обусловленная тепловыми колебаниями. Влияние связанных нуклеотидов, фаллоидинов и белков регуляции мышц. J. Biol. Chem . 270 , 11437 (1995).
C. Egile et al., Активация эффекторного N-WASP CDC42 белком IcsA Shigella flexneri способствует нуклеации актина комплексом Arp2 / 3 и подвижности бактерий на основе актина. J. Cell Biol. 146 , 1319 (1999).
Дж. П. Роббли, А. О. Оливарес, Э. М. де ла Круз, Механизм связывания нуклеотидов с актомиозином VI: доказательства аллостерической связи голова-голова. J. Biol. Chem. 279 , 38608 (2004).
Т. Д. Поллард, Очистка и характеристика миозина. Methods Cell Biol. 24 , 333 (1982).
Т. Винно и др. ., Перепрограммирование формы клеток с помощью лазерного нано-паттерна. J. Cell Sci. (2012). DOI: 10.1242 / jcs.104901
М. Б. Смит, и др., ., Сегментация и отслеживание филаментов цитоскелета с использованием открытых активных контуров. Цитоскелет 67 , 693 (2010) (Хобокен).
Благодарности: Мы благодарим C. Sykes и J. Faix за белок мышечного миозина II, F. Senger за анализ изображений и K. John за обсуждения вычислительной модели.Эта работа была поддержана грантами Human Frontier Science Program (RGP0004 / 2011 предоставлено LB и EMDLC), Agence Nationale de la Recherche (ANR-08-BLANC-0012 предоставлено LB), Institut National du Cancer (INCA-2011-141 присуждается MT), NIH (GM097348 присуждается EMDLC) и докторская степень. Стипендия программы Irtelis CEA (присуждена A.C.R.). E.M.D.L.C. Ученый исследователь Американской кардиологической ассоциации, обладатель премии NSF Career Award (MCB-0546353) и член семьи Хеллмана.Использование субстратов с микрорельефом для управления самосборкой актиновой сети защищено патентом EP2011 / 063676. Данные, представленные в этой рукописи, сведены в таблицы в основной статье и в дополнительных материалах.
Требуется разборка | From the Grapevine
Фотожурналист превращает детали винтажной техники в произведения искусства.
Есть что-то терапевтическое в том, чтобы разбирать старые гаджеты и знать, что вам не нужно собирать их снова.А может, это просто навязчивое хобби. Но это то, что тель-авивский фотограф Габриэль Менаше находит удовлетворением в своем побочном бизнесе, который он точно описывает в своем блоге Take Apart.
Менаше тщательно разбирает старинные технологии 1960–80-х годов — магнитофоны, будильники, видеокамеры, калькулятор для печати — и раскрывает их внутреннее устройство. Чтобы задокументировать процесс, он делает фотографии «до» и «после» и продал некоторые из полученных отпечатков по всему миру.
Для Менаше фотографии вдыхают новую жизнь, даже бессмертие, в предметы, которые другие выбрасывают. «Я уважаю этот предмет, отдаю дань уважения», — сказала Менаше изданию The Grapevine. «Я делаю фотографию, которая будет длиться вечно».
Каждую пятницу Менаше можно найти на блошиных рынках своего родного города Яффо в поисках сокровищ, которые он может разрушить во имя искусства. «Если вы идете на блошиный рынок, это как кладбище вещей. Иногда можно увидеть жизнь кого-то в коробке.Кто-то умер, а кто-то другой приносит свои вещи на барахолку ».
На данный момент Менаше разобрал чуть более десятка предметов, в том числе Sony Walkman и Discman, диктофон Panasonic, телефон с набором номера и два будильника.
Фотографии тщательно скомпонованы, каждая деталь находится на своем месте, опираясь на навыки Менаше за десятилетие работы фотожурналистом в местных газетах. Когда он перешел на работу в офисе, Менаше начал понимать, что скучает по фотографиям.
По словам Менаше, новое хобби преодолело разрыв, объединив две страсти: фотографирование и просмотр блошиных рынков.
Принимая решение, какие предметы разбирать, Менаше говорит, что следует трем правилам:
Он не заплатит больше 11 или 12 долларов. Гаджет не нужно ремонтировать, и когда он разбирает части, он никогда их не ломает. Иногда ему приходится использовать дрель, чтобы удалить детали, но он всегда умел разбирать детали.По его словам, он даже купил дорогие отвертки, используемые часовщиками, и очки, увеличивающие в три-четыре раза больше, чем используют хирурги.
Удалив все кусочки, он кладет их в форму для выпечки, чтобы не потерять. «Если кто-то смотрит на фотографию, он не знает, нет ли на ней винтов. Для меня важно, чтобы все было на месте. Я не буду ничего публиковать, если чего-то не хватает. Я не буду им пользоваться ».
В том же духе Менаше понимает, что даже если один винт отсутствует, оригинальная штуковина не сможет работать.
«Когда вы что-то разбираете, вы видите гениальность деталей. Я думаю про себя: кто это придумал? Это потрясающе ».
Менаше — не единственный фотограф, который разделяет эту специальность. Тодд Маклеллан из Торонто, Канада, написал книгу о своей работе «Вещи расходятся: руководство для современной жизни». и выставляет свои фотографии по всему миру.
«Когда я начал исследовать это в 2009 году, меня познакомили с миром холдинга, о существовании которого я даже не подозревал», — сказал Маклеллан журналу «Виноградная лоза» между выставками в Японии.Knolling — это процесс разборки гаджетов, расстановки их частей и фотографирования.
«Моя серия разборки началась с изучения старых объектов, которые у меня были, и все они были механическими. Затем я продолжил изучать самую современную электронику. Все разобрано и выложено методично, как было разобрано ».
Менаше, который надеется когда-нибудь выставить свои работы, говорит, что он собирает свои произведения, основываясь на интуиции и своем чувстве хорошей композиции.«Я должен это почувствовать. Что-то со мной связано ».
Среди своих следующих проектов Менаше планирует разобрать пишущие машинки, видеокамеру, часы с кукушкой и, наконец, старинный автомобиль. Если кто-то подарит ему одну, то есть.
Фотожурналист превращает детали винтажной техники в произведения искусства.
Промежуточные волокна | Celebrate Cytochemistry
Промежуточные филаменты — важные компоненты цитоскелетной системы клетки. Они могут стабилизировать органеллы, такие как ядро, или могут быть вовлечены в специализированные соединения.Они отличаются от «тонких нитей» своим размером (8-10 нм) и очевидной подвижностью тонких нитей. Однако недавние данные показывают, что промежуточные нити также могут обладать динамическими свойствами. См. Боковую панель для некоторых фотографий.
Промежуточные филаменты — это один из трех типов цитоскелетных элементов. Два других — это тонкие филаменты (актин) и микротрубочки. Часто эти три компонента работают вместе, чтобы улучшить как структурную целостность, форму клеток, так и подвижность клеток и органелл.Промежуточные нити стабильны, долговечны. Они имеют диаметр от 8 до 10 нм (средний размер по сравнению с тонкими нитями и микротрубочками). Они заметны в клетках, которые выдерживают механическое воздействие, и являются наиболее нерастворимой частью клетки. Промежуточные волокна могут диссоциировать с помощью мочевины.
Существует пять различных типов промежуточных волокон:
- Типы I и II: кислотный кератин и основной кератин, соответственно. Вырабатывается разными типами эпителиальных клеток (мочевой пузырь, кожа и т. Д.).
- Тип III. Промежуточные филаменты распределены в нескольких типах клеток, включая: Виментин в фибробластах, эндотелиальных клетках и лейкоцитах; десмин в мышце; глиальный фибриллярный кислотный фактор в астроцитах и других типах глии и периферин в периферических нервных волокнах.
- Нейрофиламент IV типа H (тяжелый), M (средний) и L (низкий). Модификаторы относятся к молекулярной массе белков NF. Другой тип IV — это «интернексин», и некоторые нестандартные IV обнаруживаются в волокнах хрусталика глаза (филенсин и факинин).
- Тип V — это ламины, которые имеют ядерную сигнальную последовательность, поэтому они могут образовывать нитевидную опору внутри внутренней ядерной мембраны. Ламины жизненно важны для восстановления ядерной оболочки после деления клеток.
Полимеризация промежуточных волокон.
Мономер:
Каждый промежуточный мономер филамента состоит из домена спирального стержня альфа, который соединяет амино (головной) и карбоксильный (хвостовой) концы. На рисунке ниже (16-12 от Alberts et al., Biology of the cell, Garland Publishing, N.Y. 1996) показывает несколько примеров мономеров.
Формирование протофиламента
Стержни наматываются на другую нить накала, как веревка, чтобы сформировать димер.Клеммы N и C каждой нити накала выровнены. Некоторый Промежуточные филаменты образуют гомодимеры; другие формы гетеродимеров.
Эти димеры затем образуют шахматные тетрамеры, которые выстраиваются в линию голова-хвост. Обратите внимание, что карбокси и аминоконцы выступают из этого протофиламента. Этот тетрамер считается основной субъединицей промежуточного филамента.
Последняя нить 10 нм представляет собой спиральную матрицу из этих тетрамеров.
Правила сборки и разборки промежуточных нитей.
Большинство промежуточных волокон полностью полимеризовано. Однако есть свидетельства того, что даже эти устойчивые конструкции обладают динамическими свойствами. В цитоплазме есть свободный тетрамер, как будто это основная субъединица для сборки новых филаментов.Кроме того, если один фосфорилирует остатки серина на аминоконцах, это может вызвать разборку.
Добавьте меченый тетрамер в ячейку, которая производит этот тип промежуточной нити. Можно наблюдать, как тетрамер включается в цитоскелетную систему, и метка видна в линейном или волнистом массиве. Если вы добавите его в клетку, которая обычно не производит тетрамер, то он не будет складываться и цитоскелетная система не будет «загораться».
Это можно проверить с помощью восстановления флуоресценции после фотообесцвечивания (FRAP)
В этом методе используется УФ-лазерный свет для обесцвечивания области этикетки в ячейке.Затем можно рассчитать время восстановления этикетки либо после введения нового материала с этикеткой, либо путем простого перемещения этикетки в структуру. В случае промежуточных филаментов FRAP позволяет обнаруживать включение меченых тетрамеров в обесцвеченное пятно цитоскелета. Можно сравнить время включения разных типов тетрамеров в разные типы промежуточных филаментов. Также можно наблюдать подвижность этих структур. В документе, который будет прочитан для этой лекции, приведены примеры обоих этих типов тестов.В ячейке ниже после лазерного фотообесцвечивания образуется темное пятно. Пятно меньше через 30 минут и почти исчезло через 2 часа.
Белки, ассоциированные с промежуточными филаментами
Белки, ассоциированные с промежуточными филаментами, могут связывать филаменты в поперечном сшивании (для повышения стабильности), или они могут связывать филаменты с другими структурами. Ниже приведены некоторые примеры.
- Плектин: перекрестные связи с микротрубочками
- Ламиновый рецептор B: связывается с внутренней ядерной мембраной
- Анкирин: связывает актин с промежуточными филаментами в основании клетки
- филаментов Desmoplus десмосомы
Типы промежуточных филаментов
Ламины
В эволюции ламины, вероятно, были первыми промежуточными филаментами.У них очень длинный стержневой домен и они несут ядерный транспортный сигнал, потому что они находятся в ядре прямо под ядерной оболочкой. Они есть непрерывно, за исключением перерыва в участках ядерно-порового комплекса.
Выше показано, что они образуют решетчатый массив (от Alberts и др., Гарланд Пресс, Нью-Йорк). Фигура слева — это электронная микрофотография область, содержащая ламины, внутри ядерной оболочки. Они есть трудно отличить от ближайшего плотного гетерохроматина.
Ламины фосфорилируются в конце профазы, и это приводит к их разложению, так как ядерная оболочка также разрушается. Затем фосфат удаляется непосредственно перед формированием ядер дочерней клетки, и ламинатные нити снова собираются вокруг каждого набора хомосом под внутренней ядерной мембраной каждой дочерней клетки. Блокировать этот процесс можно, добавив антитела к ламинам до образования ядерных мембран.
Специализированные соединения
Промежуточные нити типов I и II представляют собой кислые и основные кератины соответственно.Их мономеры находятся в одних и тех же клетках, и димеры должны содержать по одному каждого типа (гетеродимер). Если дать меченые мономеры только одного типа, несколько клеток добавят метку в цитоскелетную систему. Однако если дать мономеры обоих типов, кератиновые цитоскелетные системы будут сильно помечены.
Кератины также имеют подтипы, уникальные для разных эпителиальных клеток (мочевой пузырь, кожа и т. Д.) Или даже разные подмножества одного типа клеток (например, базальные эпидермальные клетки). Это полезно для определения происхождения клеток в опухоли, особенно клеток, которые дали метастазы.
В эпителии промежуточные нити кератина образуют соединения, которые удерживают клетки вместе (десмосомы) или прикрепляют клетки к матрице (гемидесмосомы). В мышечных клетках промежуточные нити, образующие десмосомы, являются «десминами».
Десмосомы: две бляшки на соседних клетках (содержащие десмоплакин и другие белки) связаны молекулами кадгерина. Эти молекулы связаны кальцием. Промежуточные нити петли в бляшках, распространяющихся в цитоплазму. Это структурно связывает две ячейки вместе.Кератины
Вышеупомянутые клетки взяты из кожи, и клетки выглядят так, как будто у них есть выступающие шипы, которые касаются шипов соседних клеток. На самом деле это участки соединения десмосом, которые являются жизненно важным соединением в коже. Техника фиксации привела к тому, что клетки сморщились, оставив видимыми места соединения. Слева видна электронная микрофотография десмосомы. Промежуточные нити закручиваются почти параллельно.
У пациентов, вырабатывающих антитела к молекулам кадгерина, десмосомы слабые или отсутствуют, а на коже образуются волдыри. Эти заполненные жидкостью области будут лежать в областях, где находятся клетки с шипами.
Гемидесмосомы: представляют собой участки соединения в основании эпителиальной клетки с матрицей. На рисунке ниже показаны компоненты. Промежуточные филаменты застревают в бляшке (например, в десмосомной бляшке), а молекулы интегрина (рецепторы для белков матрикса) помогают соединить участок с матрицей.
‘
Промежуточные волокна типа III
Обнаружены в различных типах ячеек. Каждый из них уникален для данного типа клеток и используется для идентификации ткани, содержащей этот тип клеток. Виментин содержится в клетках мезодермы: фибробластах, эндотелиальных клетках, лейкоцитах;
Десмин находится в мышечных клетках, соединяющих Z-диски и может соединять центры сократительных единиц. Также обнаружено, что он соединяется с десмосомами в специализированных узлах (сердечной мышце).
Глиальный фибриллярный кислый белок обнаружен в глиальных клетках центральной нервной системы.
Промежуточные филаменты IV типа
Включают нейрофиламенты L, M или H (названные в честь низкой, средней или высокой молекулярной массы. Эти нейрофиламенты связаны плектиновыми поперечными мостиками друг с другом и с микротрубочками. Это увеличивает прочность и расстояние между ними)
Белки нейрофиламентов увеличивают диаметр аксона и, следовательно, влияют на его функцию (более крупные аксоны проводят быстрее).
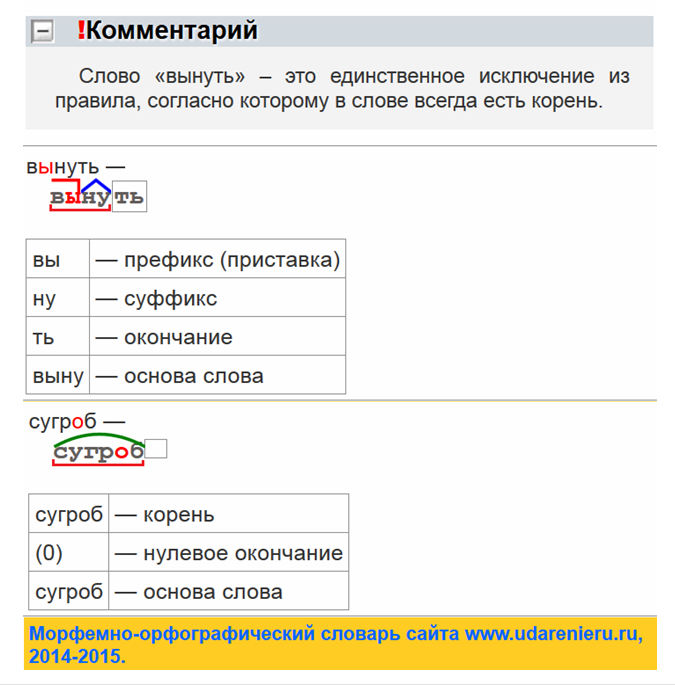
 .рёзах опадают а сосны всю зиму ст..ят з..лёные.
.рёзах опадают а сосны всю зиму ст..ят з..лёные. По дороге мы встретили несколько знакомых. Они тоже ходили за покупками.
По дороге мы встретили несколько знакомых. Они тоже ходили за покупками. 

 .бака лает а трусливого кусает. М..двед/ть питается пл..дами поч?ками. Зубы (у)белки то стирают?ся то (под)растают. Свет солнеч?ных лучей (про)никает сквоз/сь л..ству кусты и ветви. (На)л..сной п..ляне с..неют кр..снеют ж..лтеют и б..леют цв..ты. Работяги мурав?и носят ст..бельки хв..инки л..сточ?ки (к)себе д..мой.
.бака лает а трусливого кусает. М..двед/ть питается пл..дами поч?ками. Зубы (у)белки то стирают?ся то (под)растают. Свет солнеч?ных лучей (про)никает сквоз/сь л..ству кусты и ветви. (На)л..сной п..ляне с..неют кр..снеют ж..лтеют и б..леют цв..ты. Работяги мурав?и носят ст..бельки хв..инки л..сточ?ки (к)себе д..мой. Ручей падает с камня на кам..нь и проп..дает в траве. Птичка ныряет (на)дно а потом выскакивает (на)бер..(г,к).
Ручей падает с камня на кам..нь и проп..дает в траве. Птичка ныряет (на)дно а потом выскакивает (на)бер..(г,к). Редкое исключение – сомнительная продукция безымянных компаний по неоправданно низкой цене;
Редкое исключение – сомнительная продукция безымянных компаний по неоправданно низкой цене;