Урок 16. свойства сложения. применение переместительного и сочетательного свойств сложения — Математика — 2 класс
Математика, 2 класс
Урок № 16. Свойства сложения. Применение переместительного и сочетательного свойств сложения
Перечень вопросов, рассматриваемых в теме:
— Что такое сочетательное свойство сложения?
-В каких случаях можно использовать свойства сложения?
Глоссарий по теме:
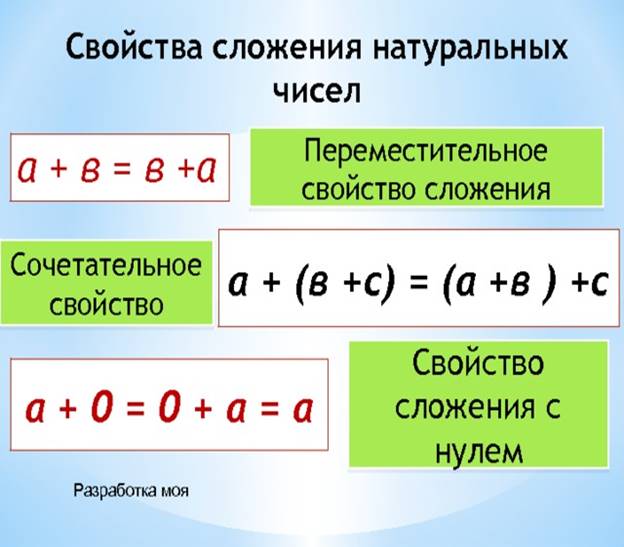
Переместительное свойство сложения: слагаемые можно переставлять местами, при этом значение суммы не изменится.
Сочетательное свойство сложения: результат сложения не изменится, если соседние слагаемые заменить их суммой.
Основная и дополнительная литература по теме урока (точные библиографические данные с указанием страниц):
1. Математика. 2 класс. Учебник для общеобразовательных организаций. В 2 ч. Ч.1/ М. И. Моро, М.А.Бантова, Г.В.Бельтюкова и др. –8-е изд. – М.: Просвещение, 2017. – с.44-47
– с.44-47
2. Математика. КИМы. 2 кл: учебное пособие для общеобразовательных организаций/ Глаголева Ю.И., Волкова А.Д.-М.: Просвещение, Учлит, 2017, с.18, 19
3. Математика. Проверочные работы. 2 кл: учебное пособие для общеобразовательных организаций/ Волкова С.И.-М.: Просвещение, 2017.- с.28, 29
Теоретический материал для самостоятельного изучения
Сравним выражения и их значения:
6+9 *9+6
45+5*5+45
Сумма чисел шесть и девять равна сумме чисел девять и шесть.
Сумма чисел сорок пять и пять равна сумме чисел пять и сорок пять.
6+9 =9+6
45+5=5+45
Что заметили?
Значения выражений равны, так как от перестановки слагаемых значение суммы не меняется. Вспомним, как в математике называется данное свойство сложения?
Правильно, оно называется переместительным свойством сложения.
Решим задачу.
В школьном спортзале 3 волейбольных мяча, 5 баскетбольных мячей и 4 футбольных мяча. Сколько всего мячей в спортзале?
Первый способ решения.
Сначала узнаем, сколько волейбольных и баскетбольных мячей, затем прибавим число футбольных мячей. Запишем: к сумме чисел три и пять прибавить четыре, получится двенадцать.
(3+5)+4=12 (м.)
Второй способ решения.
Прибавим к числу волейбольных мячей сумму баскетбольных и футбольных мячей. Запишем: к трем прибавить сумму чисел пять и четыре равно двенадцать.
3+(5+4)=12 (м.)
В обоих случаях получили одинаковый результат, значит, выражения равны между собой. Можем записать так: (3+5)+4=3+(5+4)
Теперь ты знаешь еще одно свойство сложения: результат сложения не изменится, если соседние слагаемые заменить их суммой. Это свойство называется сочетательным свойством сложения.
Знание этих двух свойств сложения позволит нам решать примеры на сложение удобным способом.
Решим выражение: 1+7+9+3=?
Мы знаем, что слагаемые можно менять местами и соседние слагаемые заменять их суммой. Воспользуемся свойствами сложения и найдем сумму.
1+7+9+3= (1+9)+(7+3)=10+10=20
В данном случае удобно сложить попарно 1 и 9, 7 и 3. А затем сложить полученные результаты. Получим 20.
Делаем вывод: используя переместительное и сочетательное свойства сложения можно складывать числа в любом порядке, как удобнее.
Тренировочные задания.
1. Вычислите суммы удобным способом
30 + 3 + 7 + 40 = _________ 4 + 10 + 6 + 70=_______________
Правильный ответ:
1. 30 + 3 + 7 + 40 = (3+7)+(30+40)=80 2. 4 + 10 + 6 + 70= (10+70)+(4+6)
2. Совместите название математического свойства с его значением и выражением
Результат сложения не изменится, если соседние слагаемые заменить их суммой.
Слагаемые можно переставлять местами, при этом значение суммы не изменится.
9+5+1+5 = (9+1) + (5+5)
9+6 = 6 + 9
Правильный ответ:
Результат сложения не изменится, если соседние слагаемые заменить их суммой.
Слагаемые можно переставлять местами, при этом значение суммы не изменится.
9+5+1+5 = (9+1) + (5+5)
9+6 = 6 + 9
Свойства умножения: переместительное, сочетательное и распределительное
Переместительное свойство умножения
От перестановки сомножителей местами произведение не меняется.
Следовательно, для любых чисел a и b верно равенство:
a · b = b · a,
выражающее переместительное свойство умножения.
Примеры:
6 · 7 = 7 · 6 = 42;
4 · 2 · 3 = 3 · 2 · 4 = 24.
Обратите внимание, что данное свойство можно применять и к произведениям, в которых более двух множителей.
Сочетательное свойство умножения
Результат умножения трёх и более множителей не изменится, если какую-либо группу множителей заменить их произведением.
Следовательно, для любых чисел a, b и c верно равенство:
a · b · c = (a · b) · c = a · (b · c),
выражающее сочетательное свойство умножения.
Пример:
3 · 2 · 5 = 3 · (2 · 5) = 3 · 10 = 30
или
3 · 2 · 5 = (3 · 2) · 5 = 6 · 5 = 30.
Сочетательное свойство используется для удобства и упрощения вычислений при умножении. Например:
25 · 15 · 4 = (25 · 4) · 15 = 100 · 15 = 1500.
В данном случае можно было вычислить всё последовательно:
25 · 15 · 4 = (25 · 15) · 4 = 375 · 4 = 1500,
но проще и легче сначала умножить 25 на 4 и получить 100, а уже потом умножить 100 на 15.
Распределительное свойство умножения
Сначала рассмотрим распределительное свойство умножения относительно сложения:
Чтобы число умножить на сумму чисел, можно это число умножить отдельно на каждое слагаемое и полученные произведения сложить.
Следовательно, для любых чисел a, b и m верно равенство:
m · (a + b) = m · a + m · b,
выражающее распределительное свойство умножения.
Так как в данном случае число и сумма являются множителями, то, поменяв их местами, используя переместительное свойство, можно сформулировать распределительное свойство так:
Чтобы сумму чисел умножить на число, можно каждое слагаемое отдельно умножить на это число и полученные произведения сложить.
Следовательно, для любых чисел a, b и m верно равенство:
(a + b) · m = a · m + b · m.
Теперь рассмотрим распределительное свойство умножения относительно вычитания:
Чтобы число умножить на разность чисел, можно это число умножить отдельно на уменьшаемое и вычитаемое и из первого полученного произведения вычесть второе.
Следовательно, для любых чисел a, b и m верно равенство:
m · (a — b) = m · a — m · b.
Так как в данном случае число и разность являются множителями, то поменяв их местами, используя переместительное свойство, можно сформулировать распределительное свойство так:
Чтобы разность чисел умножить на число, можно уменьшаемое и вычитаемое отдельно умножить на это число и из первого полученного произведения вычесть второе.
Следовательно, для любых чисел a, b и m верно равенство:
(a — b) · m = a · m — b · m.
Переход от умножения:
m · (a + b) и m · (a — b)
соответственно к сложению и вычитанию:
m · a + m · b и m · a — m · b
называется раскрытием скобок.
Переход от сложения и вычитания:
m · a + m · b и m · a — m · b
к умножению:
называется вынесением общего множителя за скобки.
Свойства сложения и вычитания. Переместительное и сочетательное
Свойства сложения
Сложение — это арифметическое действие, в котором единицы двух чисел объединяются в одно новое число
Для записи сложения используют знак «+» (плюс), который ставят между слагаемыми.
Слагаемые — это числа, единицы которых складываются.
Сумма — это число, которое получается в результате сложения.
Рассмотрим пример 2 + 5 = 7, в котором:
- 2 — это первое слагаемое,
- 5 — второе слагаемое,
- 7 — это сумма.

При этом саму запись (2 + 5) можно тоже назвать суммой.
Сложение двух чисел можно проверить вычитанием. Для этого вычитаем из суммы одно из слагаемых. Если разность окажется равной другому слагаемому — сложение выполнено верно.
Впервые мы сталкиваемся со свойствами сложения во 2 классе. С каждым годом задания усложняются, и появляются новые правила и законы. Рассмотрим свойства сложения для 4 класса.
Свойства сложения
|
На заметку!
При сложении нескольких чисел, их можно объединять в группы и переставлять в любом порядке. Например: a + b + с = (a + b) + c = a + (b + c).
Свойства вычитания
Вычитание— это арифметическое действие, в котором отнимают меньшее число от большего.
Для записи вычитания используется знак «-» (минус), который ставится между уменьшаемым и вычитаемым.
Уменьшаемое — это число, из которого вычитают.
Вычитаемое — это число, которое вычитают.
Разность — это число, которое получается в результате вычитания.
Рассмотрим пример 9 — 4 = 5, в котором:
При этом саму запись (9 — 4) тоже можно назвать разностью.
Свойства вычитания
|
На заметку!
Есть случаи, когда скобки не имеют значения при вычитании, и их можно опустить. Например: (a — b) — c = a — b — c.
Например: (a — b) — c = a — b — c.
Примеры использования свойств сложения и вычитания
Мы узнали основные свойства сложения и вычитания — осталось попрактиковаться. Чтобы ничего не забыть, используйте эту шпаргалку:
Скачать
Пример 1
Вычислить сумму слагаемых с использованием разных свойств:
а) 4 + 3 + 8
б) 9 + 11 + 2
в) 30 + 0 + 13
Как решаем:
а) 4 + 3 + 8 = (4 + 3) + 8 = 7 + 8 = 15
б) 9 + 11 + 2 = (9 + 2) + 11 = 11 + 11 = 22
в) 30 + 0 + 13 = 30 + 13 = 43
Пример 2
Применить разные свойства при вычислении разности:
а) 25 — 0 — 2
б) 18 — 1 — 4
в) 55 — 55
Как решаем:
а) 25 — 0 — 2 = 25 — 2 = 23
б) 18 — (1 + 4) = 18 — 1 — 4 = 17 — 4 = 13
в) 55 — 55 = 0
Пример 3
Найти значение выражения удобным способом:
а) 11 + 10 + 3 + 9
б) 16 + (4 — 3) + 7
в) 0 + 2 + 4 — 0
Как решаем:
а) 11 + 10 + 3 + 9 = (11 + 10) + (3 + 9) = 21 + 11 = 32
б) 16 — (4 + 3) + 7 = 16 — 4 — 3 + 7 = (16 — 4) — 3 + 7 = 12 — 3 + 7 = 9 + 7 = 16
в) 0 + 2 + 4 — 0 = 2 + 4 = 6
Сочетательное и распределительное свойства умножения
Начертим на листке в клетку прямоугольник со сторонами 5 см и 3 см. Разобьем его на квадраты со стороной 1 см (рис. 143). Подсчитаем количество клеток, расположенных в прямоугольнике. Это можно сделать, например, так.
Разобьем его на квадраты со стороной 1 см (рис. 143). Подсчитаем количество клеток, расположенных в прямоугольнике. Это можно сделать, например, так.
Количество квадратов со стороной 1 см равно 5 * 3. Каждый такой квадрат состоит из четырех клеток. Поэтому общее число клеток равно (5 * 3) * 4.
Эту же задачу можно решить иначе. Каждый из пять столбцов прямоугольника состоит из трех квадратов со стороной 1 см. Поэтому в одном столбце содержится 3 * 4 клеток. Следовательно, всего клеток будет 5 * (3 * 4).
Подсчет клеток на рисунке 143 двумя способами иллюстрирует сочетательное свойство умножения для чисел 5, 3 и 4. Имеем: (5 * 3) * 4 = 5 * (3 * 4).
Чтобы произведение двух чисел умножить на третье число, можно первое число умножить на произведение второго и третьего чисел.
В буквенном виде это свойство записывают так:
(ab)c = a(bc)
Из переместительного и сочетательно свойств умножения следует, что при умножении нескольких чисел множители можно менять местами и заключать в скобки, тем самым определяя порядок вычислений.
Например, верны равенства:
abc = cba,
17 * 2 * 3 * 5 = (17 * 3) * (2 * 5).
На рисунке 144 отрезок AB делит рассмотренный выше прямоугольник на прямоугольник и квадрат.
Подсчитаем количество квадратов со стороной 1 см двумя способами.
С одной стороны, в образовавшемся квадрате их содержится 3 * 3, а в прямоугольнике − 3 * 2. Всего получим 3 * 3 + 3 * 2 квадратов. С другой стороны, в каждой из трех строчек данного прямоугольника находится 3 + 2 квадрата. Тогда их общее количество равно 3 * (3 + 2).
Равенсто 3 * (3 + 2) = 3 * 3 + 3 * 2 иллюстрирует распределительное свойство умножения относительно сложения.
Чтобы число умножить на сумму двух чисел, можно это число умножить на каждое слагаемое и полученные произведения сложить.
В буквенном виде это свойство записывают так:
a(b + c) = ab + ac
Из распределительного свойства умножения относительно сложения следует, что
ab + ac = a(b + c).
Это равенство позволяет формулу P = 2a + 2b для нахождения периметра прямоугольника записать в таком виде:
P = 2(a + b).
Заметим, что распределительное свойство справедливо для трех и более слагаемых. Например:
a(m + n + p + q) = am + an + ap + aq.
Также справедливо распределительное свойство умножения относительно вычитания: если b > c или b = c, то
a(b − c) = ab − ac
Пример 1. Вычислите удобным способом:
1) 25 * 867 * 4;
2) 329 * 75 + 329 * 246.
Решение.
1) Используем переместительное, а затме сочетательное свойства умножения:
25 * 867 * 4 = 867 * (25 * 4) = 867 * 100 = 86 700.
2) Имеем:
329 * 754 + 329 * 246 = 329 * (754 + 246) = 329 * 1 000 = 329 000.
Пример 2. Упростите выражение:
1) 4a * 3b;
2) 18m − 13m.
Решение.
1) Используя переместительное и сочетательное свойства умножения, получаем:
4a * 3b = (4 * 3) * ab = 12ab.
2) Используя распределительное свойство умножения относительно вычитания, получаем:
18m − 13m = m(18 − 13) = m * 5 = 5m.
Пример 3. Запишите выражение 5(2m + 7) так, чтобы оно не содержало скобок.
Решение.
Согласно распределительному свойству умножения относительно сложения имеем:
5(2m + 7) = 5 * 2m + 5 * 7 = 10m + 35.
Такое преобразование называют раскрытием скобок.
Пример 4. Вычислите удобным способом значение выражения 125 * 24 * 283.
Решение. Имеем:
125 * 24 * 283 = 125 * 8 * 3 * 283 = (125 * 8) * (3 * 283) = 1 000 * 849 = 849 000.
Пример 5. Выполните умножение: 3 сут 18 ч * 6.
Решение. Имеем:
3 сут 18 ч * 6 = 18 сут 108 ч = 22 сут 12 ч.
При решении примера было использовано распределительное свойство умножения относительно сложения:
3 сут 18 ч * 6 = (3 сут + 18 ч) * 6 = 3 сут * 6 + 18 ч * 6 = 18 сут + 108 ч = 18 сут + 96 ч + 12 ч = 18 сут + 4 сут + 12 ч = 22 сут 12 ч.
Свойства действий с рациональными числами
- Главная
- Справочники
- Справочник по математике 5-9 класс
- Рациональные числа
- Свойства действий с рациональными числами
Свойства сложения рациональных чисел
Из приведенных свойств сложения чисел следует, что в сумме нескольких рациональных чисел слагаемые можно менять местами и расставлять скобки, тем самым определяя наиболее удобный порядок выполнения действий.
Примеры:
1) 9 + 4 = (9 4) = 4 и 4 + (9) = (9 4) = 5;
2 + (6) = (2 + 6) = 8 и 6 + (2) = (6 + 2) = 8;
2) (5 + 2,5) + 1,5 = (5 2,5) + 1,5 = 2,5 + 1,5 = (2,5 1,5) = 1 и 5 + (2,5 + 1,5) = 5 + 4 = (5 4) = 1;
3) 3 + 0 = 3.
Свойства умножения рациональных чисел
Примеры:
1) (2)3 = (23) = 6 и 3(2) = 6;
(5)(2) = 10 и (2)(5) = 10;
2) (23)4 = 64 = 24 и 2(34) = 212 = 24;
3) 5(3 + 2) = 53 + (5)2 = 15 + (10) = 15 10;
4) 41 = 4;
5) ;
6) 70 = 0.
Из приведенных свойств умножения следует, что в произведении нескольких рациональных чисел множители можно менять местами, расставлять и раскрывать скобки, тем самым определяя наиболее удобный порядок выполнения действий.
Коэффициент
| Если выражение является произведением числа и одной или нескольких букв, то это число называют числовым коэффициентом или просто коэффициентом. |
Примеры:
1) В выражении коэффициентом является число 0,5.
2) В выражении коэффициентом является число .
3) В выражении коэффициентом является число 1, т.к. .
4) В выражении коэффициентом является число 1, т.к. .
5) В выражении ни одно из чисел 3 и 5 не является коэффициентом. Но данное выражение можно преобразовать, используя переместительное и сочетательное свойства умножения, получим новое выражение , в котором коэффициентом является число 15.
Обратите внимание, в выражении коэффициентом является число 3, но, как правило, коэффициент записывают перед буквенными множителями: .
Поделись с друзьями в социальных сетях:
Советуем посмотреть:
Положительные и отрицательные числа. Координаты на прямой
Модуль числа
Рациональные числа
Сравнение рациональных чисел
Сложение рациональных чисел
Вычитание рациональных чисел
Умножение рациональных чисел
Деление рациональных чисел
Раскрытие скобок
Решение уравнений
Рациональные числа
Правило встречается в следующих упражнениях:
6 класс
Номер 984, Мерзляк, Полонский, Якир, Учебник
Номер 5, Мерзляк, Полонский, Якир, Учебник
Задание 1206, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1250, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1253, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1261, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1305, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1338, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1342, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
Задание 1481, Виленкин, Жохов, Чесноков, Шварцбург, Учебник
© budu5. com, 2021
com, 2021
Пользовательское соглашение
Copyright
Предмет: Математика | Класс: 6 | 2 четверть | Урок № 49 | |
Тема | Переместительное и сочетательное свойства умножения рациональных чисел | |||
| Учебник: Математика 6 класс часть 1 глава 2 | |||
Дополнительные материалы (ссылки на видеоматериалы): Видеоуроки
И.Жабровский. youtube.com›playlist?list=PL63ACBA1E85108554 Яндекс.Видео›видеоуроки 6 класс презентации в билим | ||||
Иллюстративный материал: Презентации | ||||
Цель урока | Сегодня на уроке вы изучите: 1.Как применять переместительное и сочетательное свойство умножения; 2.Как упрощать выражения используя эти свойства; | |||
Проверка учебного задания | Задание 1. Найдите значение выражения: (-0,54 – 1,56) = ( — 1 ) = = — Задание 2. Найдите корни уравнения: 6х -9 =0 6х = 9 х = 1,5 4х – 0,4 = 0 4х=0,4 х=0,1 | |||
Ответить на вопросы | 1.Результат умножения двух чисел называется? 2. 3.Как умножать два числа с разными знаками? 4.Как умножать два отрицательных числа? | |||
Краткий тезисный конспект урока | От перестановки множителей значение произведения не меняется Сочетательное свойство умножения рациональных чисел Чтобы произведение двух чисел умножить на третье число,можно первое число умножить на произведение второго и третьего числа. формулы переместительного и сочетательного свойств сложения и умножения — переместительное свойство относительно сложения;(повторим) — переместительное свойство относительно умножения; — сочетательное свойство относительно сложения;(повторим) —
сочетательное свойство относительно умножения.
Ответы: | |||
Более подробную информацию по данной теме, вы сможете получить, прочитав учебник математики 6 класс часть 1 глава 2 Просмотрев видеоуроки и презентации. | ||||
Учебные задания
| Задание 1: Вставьте пропущенные слова.
ü От перестановки мест слагаемых/множителей сумма/произведение ______________________________. ü Чтобы к сумме двух чисел прибавить ___________ число можно
к первому числу прибавить сумму ____________и третьего числа. ü Чтобы ________________двух чисел умножить на третье число можно первое число ___________________на произведение второго и третьего чисел. ü При сложении нескольких чисел их можно как угодно объединять в группы и_____________________. ü При умножении нескольких чисел можно как угодно __________________в группы и переставлять.
Задание 2: Найдите значение выражения рациональным способом.
Задание 3: Учебник — учить правила. | |||
Обратная связь с учителем | Уважаемый учащийся, все выполненные задания необходимо отправить на данную электронную почту либо в WhatsApp по номеру телефона | |||
Переместительное и сочетательное свойства умножения рациональных чисел.
 Коэффициент
КоэффициентПредставим себе такую историю…
– Саша, чем ты занимаешься? – спросил у друга Паша.
– К следующему уроку математики нам задали решить пример. Он мне кажется сложным, – ответил Саша.
– Покажи мне, – попросил Паша. – Может, я смогу тебе помочь.
– Вот смотри: . Здесь надо перемножить три числа, и для этого придётся потрудиться, – грустно сказал Саша.
– Не расстраивайся. Может, можно как-то упростить эту задачу, – успокоил друга Паша. – А помнишь, на прошлом уроке мы говорили, что для рациональных чисел можно пользоваться переместительным свойством умножения? Тогда, чтобы быстро и легко решить этот пример, мы могли бы поменять местами 25 и , ведь произведение 25 и 4 даёт нам 100.
– А как же быть со скобками, в которые взяты первый и второй множители? – спросил Саша.
–
Это хороший вопрос… Интересно, может, для рациональных чисел действует и
сочетательное свойство умножения, – задумался Паша.
– Давай спросим у Мудряша, – предложил Саша.
– Давай, – ответил Паша.
– Ребята, прежде чем я отвечу на ваш вопрос, давайте немного разомнёмся и выполним устные задания, – предложил Мудряш.
– Теперь сверимся! – сказал Мудряш. – Посмотрите, что у вас должно было получиться!
– А сейчас вернёмся к вашему вопросу, – начал Мудряш. – Ребята, на прошлом уроке мы с вами сказали, что для рациональных чисел справедливо переместительное свойство умножения. Мы умножили на 4 и получили . И умножили 4 на и тоже получили . То есть произведение и 4 равно произведению 4 и .
У
вас возник вопрос, справедливо ли сочетательное свойство умножения для
рациональных чисел. Конечно, справедливо. Давайте вернёмся к вашему примеру: .
Вы для удобства вычислений поменяли местами первый и второй множители: .
Теперь заключим в скобки 25 и 4: .
Произведение в скобках равняется 100. Умножим на
100.
Для этого перенесём запятую в десятичной дроби на два знака вправо, так как
умножаем на 100, и получим .
Умножим на
100.
Для этого перенесём запятую в десятичной дроби на два знака вправо, так как
умножаем на 100, и получим .
Запомните! Для любых рациональных чисел , и справедливы равенства:
– переместительное свойство умножения;
– сочетательное свойство умножения.
Теперь
с помощью только что рассмотренных свойств умножения упростим вот такое
выражение: .
Напомним,
что в буквенных выражениях знак умножения между буквенными множителями, а также
между числовым и буквенным множителями, как правило, не ставится. Запишем
вначале все числовые множители и возьмём их в скобки, а затем – буквенные: . Произведение
и
даёт
нам .
Знаем, что при умножении на получаем
число, противоположное ,
то есть .
Буквенную часть оставим без изменений. Тогда наше выражение принимает вид: .
Здесь числовой множитель называют
коэффициентом.
Ребята, посмотрите на следующие выражения: ; ; ; ; ; ; . Назовите их коэффициенты, – предложил Мудряш.
– В выражении коэффициент равен , – начали мальчики, – в выражении коэффициент равен , в выражении коэффициент равен . А в выражении чему равен коэффициент?
– В этом выражении коэффициент равен , – ответил Мудряш. – Просто он здесь записан после буквенных множителей, а, как правило, его записывают перед буквенными множителями.
– В выражении коэффициент равен или ? – снова задали вопрос Саша и Паша.
– В этом выражении ни одно из чисел не является коэффициентом. Чтобы найти здесь коэффициент, надо записать все числовые множители перед буквенными: . Затем перемножить эти числовые множители. Тогда число будет являться коэффициентом в полученном выражении, – объяснил Мудряш.
–
А чему равны коэффициенты в выражениях и
?
– спросили мальчишки.
– Выражение мы можем с вами записать так: . Поэтому коэффициент здесь равен единице. Выражение можно записать как , а значит, коэффициент в этом выражении равен .
– Паша, Саша, а сейчас давайте выполним несколько заданий, – сказал Мудряш.
Задание первое: Вычислите:
а) ; б) ; в) .
Решение: в примере для удобства вычисления воспользуемся сочетательным свойством умножения и заключим в скобки второй и третий множители: . Умножим на и получим произведение . Теперь перенесём запятую в десятичной дроби на три знака вправо, так как умножаем на , и в результате получим .
В
примере воспользуемся
переместительным свойством умножения и поменяем местами второй и третий
множители: . Теперь заключим в скобки первый и второй множители: .
Произведение двух отрицательных чисел в скобках равняется произведению модулей
этих чисел и равняется 10. Осталось .
Для этого перенесём запятую в десятичной дроби на один знак вправо и в
результате получим .
Осталось .
Для этого перенесём запятую в десятичной дроби на один знак вправо и в
результате получим .
Следующий
пример . Давайте
запишем первый множитель в виде неправильной дроби: .
Обратите внимание, что нам будет удобно перемножить и
,
и
.
А значит, воспользуемся переместительным свойством умножения и поменяем местами
второй и третий множители: .
Теперь заключим в скобки первый и второй
множители, третий и четвёртый множители: .
Перемножим дроби в первых скобках: .
Их произведение будет отрицательным, так как они имеют разные знаки.
Произведение числителей запишем в числитель, произведение знаменателей запишем
в знаменатель: .
Сократим на 9, выполним вычисления и получим .
Перемножим дроби во вторых скобках: .
Их произведение также будет отрицательным, так как они имеют разные знаки.
Произведение числителей запишем в числитель, произведение знаменателей запишем
в знаменатель: . Сократим на 4, выполним вычисления и получим .
Теперь запишем полученные значения в наше выражение: .
Произведение двух отрицательных дробей будет положительным. Произведение
числителей запишем в числитель, произведение знаменателей запишем в знаменатель:
.
Сократить мы не можем, поэтому выполним вычисления и получим .
Сократим на 4, выполним вычисления и получим .
Теперь запишем полученные значения в наше выражение: .
Произведение двух отрицательных дробей будет положительным. Произведение
числителей запишем в числитель, произведение знаменателей запишем в знаменатель:
.
Сократить мы не можем, поэтому выполним вычисления и получим .
Второе задание: упростите выражение и укажите его коэффициент:
а) ; б) ; в) ; г) .
Решение: в первом выражении воспользуемся переместительным свойством умножения и поменяем местами второй и третий множители: . Заключим в скобки числовые множители: . Произведение числовых множителей будет положительным, так как они оба отрицательны. Перемножим их и в результате получим . Коэффициентом в полученном выражении является число .
Во
втором выражении воспользуемся
переместительным свойством умножения и поменяем местами второй и третий
множители: . Заключим в первые скобки числовые множители,
во вторые скобки – буквенные множители: .
Произведение в первых скобках будет отрицательным, так как множители имеют
разные знаки. Перемножим их и получим .
Запишем буквенную часть без изменений и в результате получим .
Коэффициентом в полученном выражении является число .
Заключим в первые скобки числовые множители,
во вторые скобки – буквенные множители: .
Произведение в первых скобках будет отрицательным, так как множители имеют
разные знаки. Перемножим их и получим .
Запишем буквенную часть без изменений и в результате получим .
Коэффициентом в полученном выражении является число .
В
следующем выражении также
воспользуемся переместительным свойством умножения и поменяем местами второй и
третий множители: .
В первые скобки заключим первый и второй множители, во вторые скобки – третий и
четвёртый множители: .
Выполним умножение в первых скобках: .
Запишем второй множитель в виде неправильной дроби: .
Произведение получится отрицательным, так как множители имеют разные знаки. Произведение
числителей запишем в числитель, произведение знаменателей запишем в знаменатель:
.
Сократим на 3 и на 7.
Выполним вычисления и получим .
Запишем в
наше выражение, буквенную часть оставим без изменений и в результате получим . Коэффициентом в этом выражении является число .
Коэффициентом в этом выражении является число .
И последнее выражение . В первую очередь последний множитель запишем в виде произведения и : . Воспользуемся переместительным свойством умножения таким образом, чтобы все числовые множители оказались на первом месте, а за ними были буквенные множители: . Заключим в первые скобки все числовые множители, во вторые – все буквенные: . Теперь выполним умножение в первых скобках: . , . Буквенную часть оставим без изменений и в результате получим выражение . Коэффициент в этом выражении равен .
Определение реакции двойного вытеснения и примеры
Реакция двойного замещения — это тип реакции, в которой два реагента обмениваются ионами с образованием двух новых соединений. Реакции двойного вытеснения обычно приводят к образованию продукта в виде осадка.
Реакции двойного вытеснения имеют вид:
AB + CD → AD + CB.
Ключевые выводы: реакция двойного вытеснения
- Реакция двойного вытеснения — это тип химической реакции, в которой ионы реагента обмениваются местами с образованием новых продуктов.
- Обычно реакция двойного вытеснения приводит к образованию осадка.
- Химические связи между реагентами могут быть ковалентными или ионными.
- Реакция двойного замещения также называется реакцией двойного замещения, реакцией метатезиса солей или двойным разложением.
Реакция происходит чаще всего между ионными соединениями, хотя технически связи, образованные между химическими частицами, могут быть ионными или ковалентными по природе.Кислоты или основания также участвуют в реакциях двойного замещения. Связи, образованные в соединениях продукта, представляют собой тот же тип связей, что и в молекулах реагентов. Обычно растворителем для этого типа реакции является вода.
Альтернативные термины
Реакция двойного замещения также известна как реакция метатезиса солей, реакция двойного замещения, обмен или иногда реакция разложения двойной , хотя этот термин используется, когда один или несколько реагентов не растворяются в растворителе.
Примеры реакций двойного вытеснения
Реакция между нитратом серебра и хлоридом натрия представляет собой реакцию двойного вытеснения. Серебро обменивает свой нитрит-ион на хлорид-ион натрия, в результате чего натрий захватывает нитрат-анион.
AgNO 3 + NaCl → AgCl + NaNO 3
Вот еще один пример:
BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (с.) + 2 NaCl (водн.)
Как распознать реакцию двойного смещения
Самый простой способ идентифицировать реакцию двойного вытеснения — проверить, обмениваются ли катионы анионами друг с другом.Другой ключ, если указаны состояния вещества, — это поиск водных реагентов и образование одного твердого продукта (поскольку реакция обычно приводит к образованию осадка).
Типы реакций двойного вытеснения
Реакции двойного вытеснения можно разделить на несколько категорий, включая противоионный обмен, алкилирование, нейтрализацию, кислотно-карбонатные реакции, водный метатезис с осаждением (реакции осаждения) и водный метатезис с двойным разложением (реакции двойного разложения).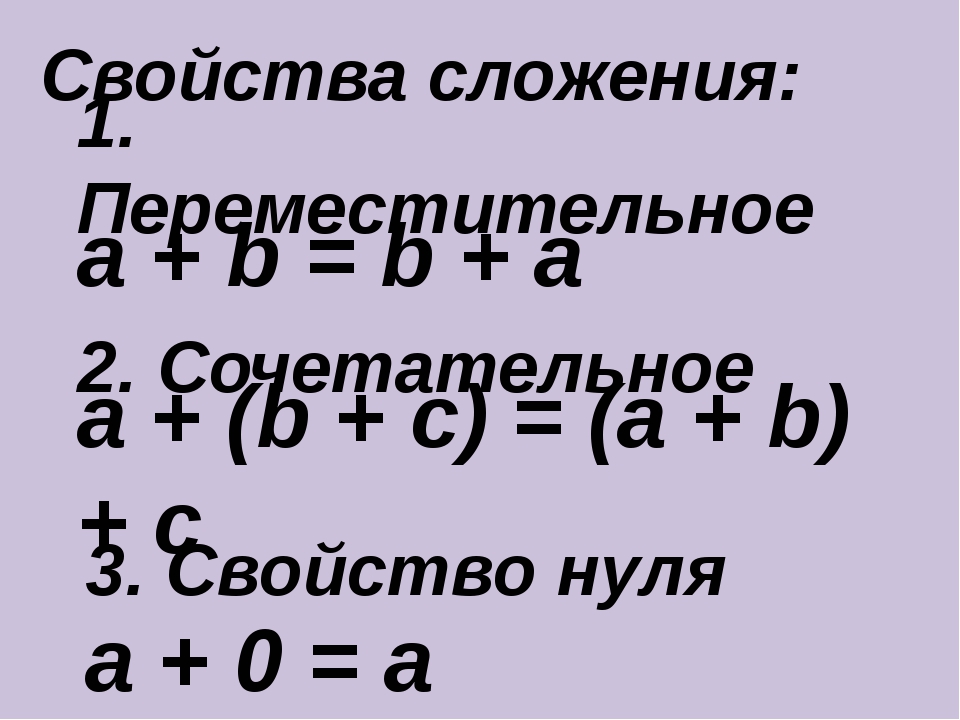 Два типа, наиболее часто встречающиеся на уроках химии, — это реакции осаждения и реакции нейтрализации.
Два типа, наиболее часто встречающиеся на уроках химии, — это реакции осаждения и реакции нейтрализации.
Реакция осаждения происходит между двумя водными ионными соединениями с образованием нового нерастворимого ионного соединения. Вот пример реакции между нитратом свинца (II) и иодидом калия с образованием (растворимого) нитрата калия и (нерастворимого) иодида свинца.
Pb (NO 3 ) 2 (водн.) + 2 KI (водн.) → 2 KNO 3 (водн.) + PbI 2 (с)
Иодид свинца образует так называемый осадок, в то время как растворитель (вода) и растворимые реагенты и продукты называются супернатантом или супернатантом.Образование осадка продвигает реакцию вперед по мере того, как продукт покидает раствор.
Реакции нейтрализации — это реакции двойного вытеснения между кислотами и основаниями. Когда растворителем является вода, реакция нейтрализации обычно дает ионное соединение — соль. Этот тип реакции протекает в прямом направлении, если по крайней мере один из реагентов представляет собой сильную кислоту или сильное основание. Реакция между уксусом и пищевой содой в классическом вулкане пищевой соды является примером реакции нейтрализации.Эта конкретная реакция затем продолжается с выделением газа (углекислого газа), который отвечает за возникающее шипение. Первоначальная реакция нейтрализации:
Реакция между уксусом и пищевой содой в классическом вулкане пищевой соды является примером реакции нейтрализации.Эта конкретная реакция затем продолжается с выделением газа (углекислого газа), который отвечает за возникающее шипение. Первоначальная реакция нейтрализации:
NaHCO 3 + CH 3 COOH (водн.) → H 2 CO 3 + NaCH 3 COO
Вы заметите, что катионы обмениваются анионами, но из-за того, что составы написаны, немного сложнее заметить обмен анионов. Ключом к определению реакции как двойного вытеснения является рассмотрение атомов анионов и их сравнение с обеих сторон реакции.
Источники
- Dilworth, J. R .; Hussain, W .; Hutson, A.J .; Jones, C.J .; Mcquillan, F. S. (1997). «Анионы тетрагалооксорхената». Неорганические синтезы , т. 31. С. 257–262. DOI: 10.1002 / 9780470132623.ch52
- ИЮПАК. Сборник химической терминологии (2-е изд.
 ) («Золотая книга»). (1997).
) («Золотая книга»). (1997). - Марш, Джерри (1985). Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.). Нью-Йорк: Вили. ISBN 0-471-85472-7.
- Майерс, Ричард (2009). Основы химии . Издательская группа «Гринвуд». ISBN 978-0-313-31664-7.
7.3 Классификация химических реакций | Вводная химия
Цели обучения
К концу этого раздела вы сможете:
- Определите пять общих типов химических реакций (однократное замещение, двойное замещение, состав, разложение и горение).
- Отнесите химические реакции к одному из этих трех типов, учитывая соответствующие описания или химические уравнения.
До сих пор мы представляли химические реакции как тему, но мы не обсуждали, как можно предсказать продукты химической реакции. Здесь мы начнем изучение определенных типов химических реакций, которые позволяют нам предсказать, какими будут продукты реакции.
Состав Реакция
Реакция состава (иногда также называемая реакцией комбинации или реакцией синтеза ) дает единое вещество из нескольких реагентов.Единичное вещество как продукт является ключевой характеристикой реакции композиции. Для вещества может быть коэффициент, отличный от единицы, но если в реакции используется только одно вещество в качестве продукта, ее можно назвать реакцией композиции. В реакции
[латекс] \ large {\ text {2 H}} _ {2} \ text {(} g \ text {)} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ стрелка вправо {\ text {2 H}} _ {2} \ text {O (} l \ text {)} [/ latex]
вода производится из водорода и кислорода. Хотя образуются две молекулы воды, в качестве продукта используется только одно вещество — вода.Итак, это композиционная реакция.
Реакция разложения
Реакция разложения начинается с одного вещества и дает более одного вещества; то есть разлагается. Одно вещество в качестве реагента и более одного вещества в качестве продуктов являются ключевой характеристикой реакции разложения. Например, при разложении гидрокарбоната натрия (также известного как бикарбонат натрия)
Одно вещество в качестве реагента и более одного вещества в качестве продуктов являются ключевой характеристикой реакции разложения. Например, при разложении гидрокарбоната натрия (также известного как бикарбонат натрия)
[латекс] \ large {\ text {2 NaHCO}} _ {3} \ text {(} s \ text {)} \ rightarrow {\ text {Na}} _ {2} \ text {CO} _ {3 } \ text {(} s \ text {)} + {\ text {CO}} _ {2} \ text {(} g \ text {)} + {\ text {H}} _ {2} \ text { O (} l \ text {)} [/ латекс]
карбонат натрия, диоксид углерода и вода производятся из одного вещества гидрокарбоната натрия.
Состав и реакции разложения трудно предсказать; однако их должно быть легко распознать.
Пример 1:
Реакции состава и разложенияОбозначьте каждое уравнение как реакцию состава, реакцию разложения или ни то, ни другое.
- [латекс] \ large {\ text {Fe}} _ {2} \ text {O} _ {3} \ text {(} s \ text {)} + \ text {3 SO} _ {3} \ текст {(} g \ text {)} \ rightarrow {\ text {Fe}} _ {2} {\ text {(} {\ text {SO}} _ {4} \ text {)}} _ {3} [/ латекс]
- [латекс] \ large {\ text {NaCl}} \ text {(} aq \ text {)} + {\ text {AgNO}} _ {3} \ text {(} aq \ text {)} \ rightarrow { \ text {NaNO}} _ {3} \ text {(} aq \ text {)} + \ text {AgCl (} s \ text {)} [/ latex]
- [латекс] \ large {\ text {(} {\ text {NH}} _ {4} \ text {)}} _ {2} {\ text {Cr}} _ {2} \ text {O} _ {7} \ text {(} s \ text {)} \ rightarrow \ text {Cr} _ {2} \ text {O} _ {3} \ text {(} s \ text {)} + {\ text { 4 H}} _ {2} {\ text {O}} \ text {(} l \ text {)} + {\ text {N}} _ {2} \ text {(} g \ text {)} [ / латекс]
- В этом уравнении два вещества объединяются в одно вещество.
 Это композиционная реакция.
Это композиционная реакция. - Два разных вещества вступают в реакцию с образованием двух новых веществ. Это не соответствует определению ни реакции композиции, ни реакции разложения, поэтому не является ни тем, ни другим. Фактически, вы можете распознать это как реакцию двойной замены.
- Одно вещество реагирует с образованием нескольких веществ. Это реакция разложения.
Определите уравнение как реакцию состава, реакцию разложения или ни то, ни другое.
[латекс] \ large {\ text {C}} _ {3} \ text {H} _ {8} \ text {(} g \ text {)} \ rightarrow {\ text {C}} _ {3} \ text {H} _ {4} \ text {(} g \ text {)} + \ text {H} _ {2} \ text {(} g \ text {)} [/ latex]
Покажи ответреакция разложения
Реакция с однократной заменой
Реакция однократного замещения (иногда называемая реакцией однократного замещения ) — это химическая реакция, в которой один элемент замещается другим элементом в соединении, образуя новый элемент и новое соединение как продукты. Например,
Например,
[латекс] \ large \ text {2 HCl} \ text {(} aq \ text {)} + {\ text {Zn}} \ text {(} s \ text {)} \ rightarrow {\ text {ZnCl} } _ {2} \ text {(} aq \ text {)} + {\ text {H}} _ {2} \ text {(} g \ text {)} [/ latex]
является примером реакции одиночного замещения. Атомы водорода в HCl заменяются атомами Zn, и при этом образуется новый элемент — водород. Другой пример реакции одиночного замещения —
[латекс] \ large \ text {2 NaCl} \ text {(} aq \ text {)} + {\ text {F}} _ {2} \ text {(} g \ text {)} \ rightarrow {\ текст {2 NaF}} \ text {(} aq \ text {)} + {\ text {Cl}} _ {2} \ text {(} g \ text {)} [/ latex]
Реакция двойной замены
Реакция двойного замещения (иногда называемая реакцией двойного замещения ) происходит, когда части двух ионных соединений обмениваются, образуя два новых соединения.Уравнение с двойной заменой характеризуется наличием двух соединений в качестве реагентов и двух различных соединений в качестве продуктов. Пример:
Пример:
[латекс] \ large {\ text {CuCl}} _ {2} \ text {(} aq \ text {)} + {\ text {2 AgNO}} _ {3} \ text {(} aq \ text { )} \ rightarrow \ text {Cu} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} \ text {(} aq \ text {)} + \ text {2 AgCl (} s \ text {)} [/ латекс]
Есть два эквивалентных способа рассмотрения уравнения двойной замены: либо катионы меняются местами, либо анионы меняются местами.(Вы не можете поменять местами оба; в конечном итоге вы получите те же вещества, с которых начали.) Любая перспектива должна позволить вам предсказывать правильные продукты, если вы соединяете катион с анионом, а не катион с катионом или анионом. с анионом.
Пример 2:
Реакции замещенияПредскажите произведения этого уравнения с двойной заменой:
[латекс] \ large {\ text {Na}} _ {2} \ text {SO} _ {4} \ text {(} aq \ text {)} + \ text {BaCl} _ {2} \ text { (} g \ text {)} \ rightarrow {\ text {?}} [/ latex]
Покажи ответ Если рассматривать реакцию как переключение катионов или анионов, мы ожидаем, что продуктами будут BaSO 4 и NaCl.
Предскажите произведения этого уравнения с двойной заменой:
[латекс] \ large {\ text {KBr}} \ text {(} aq \ text {)} + {\ text {AgNO}} _ {3} \ text {(} aq \ text {)} \ rightarrow { \ text {?}} [/ latex]
Покажи ответKNO 3 и AgBr
Предсказать, произойдет ли реакция двойного замещения, несколько сложнее, чем предсказать реакцию одиночного замещения. Однако есть один тип реакции двойного замещения, который мы можем предсказать: реакция осаждения.Реакция осаждения происходит, когда два ионных соединения растворяются в воде и образуют новое ионное соединение, которое не растворяется; это новое соединение выпадает из раствора в виде твердого осадка . Образование твердого осадка является движущей силой, которая заставляет реакцию продолжаться.
Чтобы судить, будут ли происходить реакции двойного замещения, нам нужно знать, какие типы ионных соединений образуют осадки.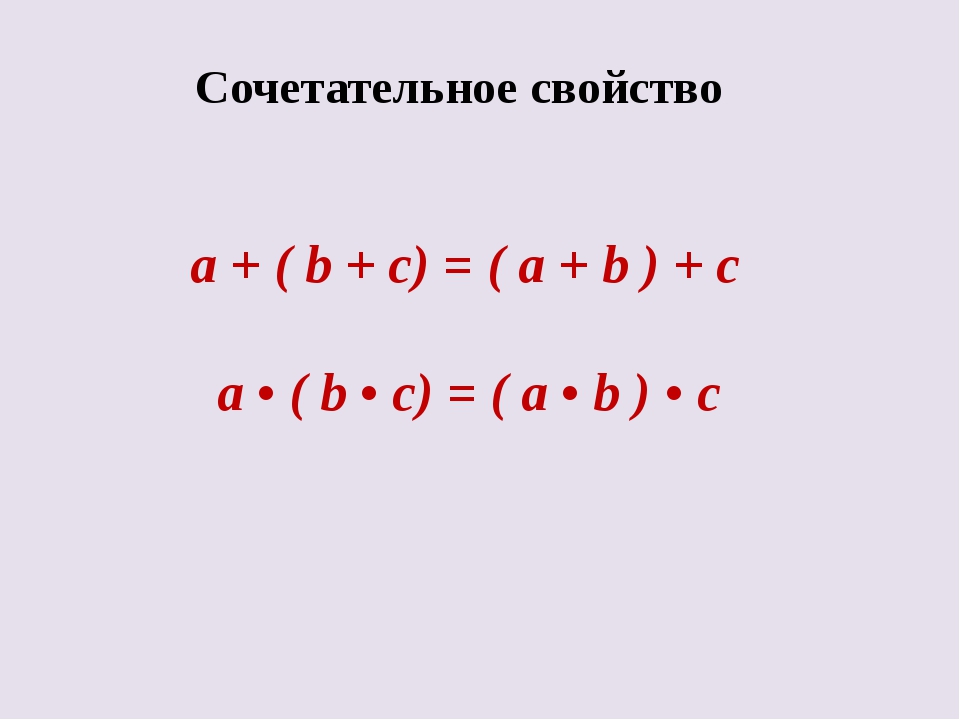 Для этого мы используем правила растворимости , которые представляют собой общие утверждения, которые предсказывают, какие ионные соединения растворяются (растворимы), а какие нет (не растворимы или нерастворимы).В таблице 1 «Некоторые полезные правила растворимости» перечислены некоторые общие правила растворимости. Нам необходимо рассмотреть каждое ионное соединение (как реагенты, так и возможные продукты) в свете правил растворимости в таблице 1 «Некоторые полезные правила растворимости». Если соединение растворимо, мы используем метку (aq), указывающую, что оно растворяется. Если соединение нерастворимо, мы используем метку (и) с ним и предполагаем, что оно выпадет в осадок из раствора. Если все растворимо, то никакой реакции не ожидается.
Для этого мы используем правила растворимости , которые представляют собой общие утверждения, которые предсказывают, какие ионные соединения растворяются (растворимы), а какие нет (не растворимы или нерастворимы).В таблице 1 «Некоторые полезные правила растворимости» перечислены некоторые общие правила растворимости. Нам необходимо рассмотреть каждое ионное соединение (как реагенты, так и возможные продукты) в свете правил растворимости в таблице 1 «Некоторые полезные правила растворимости». Если соединение растворимо, мы используем метку (aq), указывающую, что оно растворяется. Если соединение нерастворимо, мы используем метку (и) с ним и предполагаем, что оно выпадет в осадок из раствора. Если все растворимо, то никакой реакции не ожидается.
Таблица 1 Некоторые полезные правила растворимости
| Эти соединения обычно растворяются в воде (растворимы): | Исключения: |
| Все соединения Li + , Na + , K + , Rb + , Cs + и NH 4 + | Нет |
| Все соединения NO 3 — и C 2 H 3 O 2 — | Нет |
| Соединения Cl —, Br —, I — | Ag + , Hg 2 2+ , Pb 2+ |
| Соединения SO 4 2 | Hg 2 2+ , Pb 2+ , Sr 2+ , Ba 2+ |
| Эти соединения обычно не растворяются в воде (нерастворимы): | Исключения: |
| Соединения CO 3 2- и PO 4 3- | Соединения Li + , Na + , K + , Rb + , Cs + и NH 4 + |
| Соединения OH — | Соединения Li + , Na + , K + , Rb + , Cs + , NH 4 + , Sr 2+ и Ba 2+ |
Яркий пример выпадения осадка наблюдается при смешивании растворов йодида калия и нитрата свинца, в результате чего образуется твердый йодид свинца:
[латекс] \ large2 \ text {KI (} aq \ text {)} + \ text {Pb} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2 } \ text {(} aq \ text {)} \ rightarrow {\ text {PbI}} _ {2} \ text {(} s \ text {)} + 2 {\ text {KNO}} _ {3} \ текст {(} aq \ text {)} [/ latex]
Это наблюдение согласуется с рекомендациями по растворимости: единственным нерастворимым соединением среди всех вовлеченных является йодид свинца, одно из исключений из общей растворимости йодидных солей.
Йодид свинца — это ярко-желтое твердое вещество, которое раньше использовалось в качестве художественного пигмента, известного как йодно-желтый (рис. 1). Свойства чистых кристаллов PbI 2 делают их полезными для изготовления детекторов рентгеновского и гамма-излучения.
Рекомендации по растворимости, обсужденные выше, можно использовать для прогнозирования того, будет ли происходить реакция осаждения при смешивании растворов растворимых ионных соединений. Нужно просто идентифицировать все ионы, присутствующие в растворе, а затем подумать, может ли образование пары катион / анион привести к нерастворимому соединению.
Например, смешивание растворов нитрата серебра и фторида натрия даст раствор, содержащий ионы Ag + , NO —, Na + и F —. Помимо двух ионных соединений, изначально присутствующих в растворах, AgNO 3 и NaF, из этого набора ионов могут быть образованы два дополнительных ионных соединения: NaNO 3 и AgF. Нормы растворимости указывают, что все соли нитратов растворимы, но AgF является одним из исключений из общей растворимости солей фторидов.Следовательно, прогнозируется реакция осаждения, описываемая следующим уравнением:
Нормы растворимости указывают, что все соли нитратов растворимы, но AgF является одним из исключений из общей растворимости солей фторидов.Следовательно, прогнозируется реакция осаждения, описываемая следующим уравнением:
[латекс] \ large {\ text {NaF}} \ text {(} aq \ text {)} + {\ text {AgNO}} _ {3} \ text {(} aq \ text {)} \ rightarrow { \ text {AgF}} \ text {(} s \ text {)} + {\ text {NaNO}} _ {3} \ text {(} aq \ text {)} [/ latex]
Рис. 1. При смешивании растворов, содержащих Pb 2+ и I —, образуется осадок PbI 2 . (Источник: Der Kreole / Wikimedia Commons)
Пример 3:
Прогнозирование реакций осадкаПроизойдет ли реакция двойного замещения? Если да, укажите продукты.
- [латекс] \ large {\ text {KBr}} \ text {(} aq \ text {)} + \ text {Ca} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} \ text {(} aq \ text {)} \ rightarrow {\ text {?}} [/ Latex]
- [латекс] \ large {\ text {NaOH}} \ text {(} aq \ text {)} + \ text {Fe} \ text {Cl} _ {2} \ text {(} aq \ text { )} \ rightarrow {\ text {?}} [/ latex]
Согласно правилам растворимости, оба Ca (NO 3 ) 2 и KBr являются растворимыми. Теперь мы рассмотрим, какими будут продукты с двойным замещением при смене катионов (или анионов), а именно CaBr 2 и KNO 3 .Однако правила растворимости предсказывают, что эти два вещества также будут растворимы, поэтому осадок не образуется. Таким образом, мы не прогнозируем никакой реакции в этом случае.
Теперь мы рассмотрим, какими будут продукты с двойным замещением при смене катионов (или анионов), а именно CaBr 2 и KNO 3 .Однако правила растворимости предсказывают, что эти два вещества также будут растворимы, поэтому осадок не образуется. Таким образом, мы не прогнозируем никакой реакции в этом случае.
Согласно правилам растворимости, как NaOH, так и FeCl 2 должны быть растворимыми. Если мы предполагаем, что может происходить реакция двойного замещения, нам необходимо рассмотреть возможные продукты, которыми могут быть NaCl и Fe (OH) 2 . NaCl растворим, но, согласно правилам растворимости, Fe (OH) 2 — нет.Следовательно, произойдет реакция, и Fe (OH) 2 (s) выпадет в осадок из раствора. Вычисленное химическое уравнение
[латекс] \ large {\ text {2 NaOH}} \ text {(} aq \ text {)} + \ text {Fe} \ text {Cl} _ {2} \ text {(} aq \ text {) } \ rightarrow \ text {2 NaCl} \ text {(} aq \ text {)} + \ text {Fe} {\ text {(} {\ text {OH}} \ text {)}} _ {2} \ текст {(} s \ text {)} [/ латекс]
Проверьте свои знания Возникнет ли уравнение двойной замены? Если да, укажите продукты.
[латекс] \ large \ text {Sr} {\ text {(} {\ text {NO}} _ {3} \ text {)}} _ {2} \ text {(} aq \ text {)} + \ text {K} \ text {Cl} \ text {(} aq \ text {)} \ rightarrow \ text {?} [/ latex]
Покажи ответНет реакции; все возможные продукты растворимы.
Реакция горения
A реакция горения происходит, когда реагент соединяется с кислородом, многократно из атмосферы, с образованием оксидов всех других элементов в качестве продуктов; любой азот в реагенте превращается в элементарный азот, N 2 . Многие реагенты, называемые топлива , содержат в основном атомы углерода и водорода, реагируя с кислородом с образованием CO 2 и H 2 O. Например, сбалансированное химическое уравнение для горения метана, CH 4 , имеет следующий вид: следующим образом:
[латекс] \ large {\ text {CH}} _ {4} \ text {(} g \ text {)} + {\ text {2 O}} _ 2 \ text {(} g \ text {)} \ стрелка вправо {\ text {CO}} _ {2} \ text {(} g \ text {)} + {\ text {2 H}} _ {2} \ text {O (} g \ text {)} [/ латекс]
Керосин можно аппроксимировать формулой C 12 H 26 , а уравнение его горения —
[латекс] \ large \ text {2 C} _ {12} \ text {H} _ {26} \ text {(} l \ text {)} + {\ text {37 O}} _ 2 \ text {( } g \ text {)} \ rightarrow {\ text {24 CO}} _ {2} \ text {(} g \ text {)} + {\ text {26 H}} _ {2} \ text {O ( } г \ текст {)} [/ латекс]
Иногда топливо содержит атомы кислорода, которые необходимо учитывать при балансировании химического уравнения. Одним из распространенных видов топлива является этанол, C 2 H 5 OH, уравнение горения которого составляет
Одним из распространенных видов топлива является этанол, C 2 H 5 OH, уравнение горения которого составляет
[латекс] \ large \ text {C} _ {2} \ text {H} _ {5} \ text {OH} \ text {(} l \ text {)} + {\ text {3 O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {2 CO}} _ {2} \ text {(} g \ text {)} + {\ text {3 H}} _ {2} \ текст {O (} g \ text {)} [/ latex]
Если в исходном топливе присутствует азот, он преобразуется в N 2 , а не в азотно-кислородное соединение. Таким образом, для сжигания топлива динитроэтилена, формула которого C 2 H 2 N 2 O 4 , имеем
[латекс] \ large \ text {2 C} _ {2} \ text {H} _ {2} \ text {N} _ {2} \ text {O} _ {4} \ text {(} l \ text {)} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {4 CO}} _ {2} \ text {(} g \ text {)} + {\ text {2 H}} _ {2} \ text {O (} g \ text {)} + \ text {N} _ {2} \ text {(} g \ text {)} [/ latex]
Пример 4:
Реакции горения Заполните и сбалансируйте каждое уравнение горения.
- Сгорание пропана, C 3 H 8
- Сгорание NH 3
Продуктами реакции являются CO 2 и H 2 O, поэтому наше несбалансированное уравнение составляет
[латекс] \ large \ text {C} _ {3} \ text {H} _ {8} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text { CO}} _ {2} \ text {(} g \ text {)} + {\ text {H}} _ {2} \ text {O (} g \ text {)} [/ latex]
Балансировка (и вам, возможно, придется пройти несколько раз, чтобы сбалансировать это), мы получаем
[латекс] \ large \ text {C} _ {3} \ text {H} _ {8} + {\ text {5 O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {3 CO}} _ {2} \ text {(} g \ text {)} + {\ text {4 H}} _ {2} \ text {O (} g \ text {)} [/ latex]
- Атомы азота в аммиаке будут реагировать с образованием N 2 , а атомы водорода будут реагировать с O 2 с образованием H 2 O.
 [латекс] \ large \ text {N} \ text {H} _ {3} \ text {(} g \ text {)} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {N}} _ {2} \ text {(} g \ text {)} + {\ text {H}} _ {2} \ text {O (} g \ text {)} [/ латекс]
[латекс] \ large \ text {N} \ text {H} _ {3} \ text {(} g \ text {)} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {N}} _ {2} \ text {(} g \ text {)} + {\ text {H}} _ {2} \ text {O (} g \ text {)} [/ латекс]Балансировка (и вам, возможно, придется пройти несколько раз, чтобы сбалансировать это), мы получаем
[латекс] \ large \ text {4 N} \ text {H} _ {3} \ text {(} g \ text {)} + {\ text {3 O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {2 N}} _ {2} \ text {(} g \ text {)} + {\ text {6 H}} _ {2} \ text {O (} g \ text {)} [/ латекс]
Заполните и сбалансируйте уравнение горения для циклопропанола, C 3 H 6 O.
Покажи ответ[латекс] \ large \ text {C} _ {3} \ text {H} _ {6} \ text {O} \ text {(} l \ text {)} + {\ text {4 O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {3 CO}} _ {2} \ text {(} g \ text {)} + {\ text {3 H}} _ {2} \ текст {O (} g \ text {)} [/ latex]
Пропан — это топливо, используемое для обогрева некоторых домов. Пропан хранится в больших резервуарах, подобных показанному здесь. Источник: «Цветы и пропан» от vistavision под лицензией Creative Commons Attribution-NonCommercial-NoDerivs 2.0 Generic
Пропан хранится в больших резервуарах, подобных показанному здесь. Источник: «Цветы и пропан» от vistavision под лицензией Creative Commons Attribution-NonCommercial-NoDerivs 2.0 Generic
Основные выводы
- В результате реакции композиции образуется одно вещество из нескольких реагентов.
- В результате реакции разложения из одного реагента образуется несколько продуктов.
- Реакции горения — это сочетание одного соединения с кислородом с образованием оксидов других элементов в виде продуктов (хотя атомы азота реагируют с образованием N 2 ).
- Реакция однократного замещения заменяет один элемент на другой в соединении.
- В реакции двойного замещения происходит обмен катионов (или анионов) двух ионных соединений.
- Реакция осаждения — это реакция двойного замещения, в которой один продукт представляет собой твердый осадок.
- Правила растворимости используются, чтобы предсказать, произойдут ли какие-либо реакции двойного замещения.

Упражнения
1. Какая реакция является композиционной, а какая нет?
а. NaCl + AgNO 3 → AgCl + NaNO 3
г. CaO + CO 2 → CaCO 3
2. Какая реакция является композиционной, а какая нет?
а. H 2 + Cl 2 → 2 HCl
г. 2 HBr + Cl 2 → 2 HCl + Br 2
3.Что представляет собой композиционная реакция, а какая нет?
а. 2 SO 2 + O 2 → 2 SO 3
г. 6 C + 3 H 2 → C 6 H 6
4. Какая реакция является композиционной, а какая нет?
а. 4 Na + 2 C + 3 O 2 → 2 Na 2 CO 3
г. Na 2 CO 3 → Na 2 O + CO 2
5. Что такое реакция разложения, а какая нет?
а.HCl + NaOH → NaCl + H 2 O
г. CaCO 3 → CaO + CO 2
CaCO 3 → CaO + CO 2
6. Что такое реакция разложения, а какая нет?
а. 3 О 2 → 2 О 3
г. 2 KClO 3 → 2 KCl + 3 O 2
7. Что такое реакция разложения, а какая нет?
а. Na 2 O + CO 2 → Na 2 CO 3
г. H 2 SO 3 → H 2 O + SO 2
8.Что такое реакция разложения, а какая нет?
а. 2 C 7 H 5 N 3 O 6 → 3 N 2 + 5 H 2 O + 7 CO + 7 C
г. C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
9. Что такое реакция горения, а какая нет?
а. C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O
г.2 Fe 2 S 3 + 9 O 2 → 2 Fe 2 O 3 + 6 SO 2
10. Что такое реакция горения, а какая нет?
Что такое реакция горения, а какая нет?
а. CH 4 + 2 F 2 → CF 4 + 2 H 2
г. 2 H 2 + O 2 → 2 H 2 O
11. Что такое реакция горения, а какая нет?
а. П 4 + 5 O 2 → 2-пол. 2 O 5
г.2 Al 2 S 3 + 9 O 2 → 2 Al 2 O 3 + 6 SO 2
12. Что такое реакция горения, а какая нет?
а. C 2 H 4 + O 2 → C 2 H 4 O 2
г. C 2 H 4 + Класс 2 → C 2 H 4 Класс 2
13. Может ли реакция композиции быть также реакцией горения? Приведите пример, подтверждающий вашу позицию.
14. Может ли реакция разложения быть реакцией горения? Приведите пример, подтверждающий вашу позицию.
15. Заполните и сбалансируйте каждое уравнение горения.
а. C 4 H 9 OH + O 2 →?
г. CH 3 NO 2 + O 2 →?
16. Заполните и сбалансируйте каждое уравнение горения.
а. B 2 H 6 + O 2 →? (Образовавшийся оксид бора — B 2 O 3 .)
г. Al 2 S 3 + O 2 →? (Образовавшийся оксид серы SO 2 .)
г. Al 2 S 3 + O 2 →? (Образовавшийся оксид серы SO 3 .)
17. Предполагая, что происходит каждая реакция с одним замещением, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а. Zn + Fe (NO 3 ) 2 →?
г. F 2 + FeI 3 →?
18.Предполагая, что происходит каждая реакция с одним замещением, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а. Li + MgSO 4 →?
г. NaBr + Cl 2 →?
19. Предполагая, что происходит каждая реакция с однократным замещением, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а. Sn + H 2 SO 4 →?
г. Al + NiBr 2 →?
20. Предполагая, что происходит каждая реакция с одним замещением, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а. Mg + HCl →?
г. HI + Br 2 →?
21. Предполагая, что происходит каждая реакция двойного замещения, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а. Zn (NO 3 ) 2 + NaOH →?
г. HCl + Na 2 S →
22. Предполагая, что происходит каждая реакция двойного замещения, предскажите продукты и запишите каждое сбалансированное химическое уравнение.
а. Ca (C 2 H 3 O 2 ) 2 + HNO 3 →?
г. Na 2 CO 3 + Sr (NO 2 ) 2 →?
Na 2 CO 3 + Sr (NO 2 ) 2 →?
23. Предполагая, что происходит каждая реакция двойного замещения, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а. Pb (NO 3 ) 2 + KBr →?
г. K 2 O + MgCO 3 →?
24. Предполагая, что происходит каждая реакция двойного замещения, спрогнозируйте продукты и запишите каждое сбалансированное химическое уравнение.
а.Sn (OH) 2 + FeBr 3 →?
г. CsNO 3 + KCl →?
25. Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и если да, напишите сбалансированное химическое уравнение.
а. Na 2 CO 3 + Sr (NO 2 ) 2 →?
г. (NH 4 ) 2 SO 4 + Ba (NO 3 ) 2 →?
26. Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и если да, напишите сбалансированное химическое уравнение.
Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и если да, напишите сбалансированное химическое уравнение.
а. KC 2 H 3 O 2 + Li 2 CO 3 →?
г. КОН + AgNO 3 →?
27. Используйте правила растворимости, чтобы предсказать, будет ли происходить каждая реакция двойного замещения, и если да, запишите сбалансированное химическое уравнение.
а. K 3 PO 4 + SrCl 2 →?
г. NaOH + MgCl 2 →?
Показать ответы на избранные вопросы1. а) не состав, б) состав
3. а) состав, б) состав
5. а) без разложения, б) с разложением
7. а) без разложения, б) с разложением
9. а) горение, б) горение
11. а) горение, б) горение
13. Да; 2 H 2 + O 2 → 2 H 2 O (ответы могут быть разными)
Да; 2 H 2 + O 2 → 2 H 2 O (ответы могут быть разными)
15. a) C 4 H 9 OH + 6 O 2 → 4 CO 2 + 5 H 2 O, b) 4 CH 3 NO 2 + 3 O 2 → 4 CO 2 + 6 H 2 O + 2 N 2
17. а) Zn + Fe (NO 3 ) 2 → Zn (NO 3 ) 2 + Fe, б) 3 F 2 + 2 FeI 3 → 3 I 2 + 2 FeF 3
19. а) Sn + H 2 SO 4 → SnSO 4 + H 2, б) 2 Al + 3 NiBr 2 → 2 AlBr 3 + 3 Ni
21. а) Zn (NO 3 ) 2 + 2 NaOH → Zn (OH) 2 + 2 NaNO 3, б) 2 HCl + Na 2 S → 2 NaCl + H 2 S
23. a) Pb (NO 3 ) 2 + 2 KBr → PbBr 2 + 2 KNO 3 , b) K 2 O + MgCO 3 → K 2 CO 3 + MgO
27. а) 2 K 3 PO 4 + 3 SrCl 2 → Sr 3 (PO 4 ) 2 (с) + 6 KCl, б) 2 NaOH + MgCl 2 → 2 NaCl + Mg (OH) 2 (т)
а) 2 K 3 PO 4 + 3 SrCl 2 → Sr 3 (PO 4 ) 2 (с) + 6 KCl, б) 2 NaOH + MgCl 2 → 2 NaCl + Mg (OH) 2 (т)
Комбинированная реакция также может быть реакцией замещения.Укажите истину или ложь.
Математические комбинации: формулы и примеры задач
Комбинации — это расположение предметов, порядок которых не имеет значения.В этом уроке тренер баскетбольной команды Wildcats использует комбинации, чтобы помочь своей команде подготовиться к предстоящему сезону.
Перестановка: определение, формула и примеры
В этом уроке мы рассмотрим математический метод вычисления количества способов, которыми мы можем упорядочить группу отдельных объектов. Это предполагает использование математической концепции, известной как перестановка.
Это предполагает использование математической концепции, известной как перестановка.
Круговая перестановка: формулы и примеры
Этот урок знакомит с концепцией круговых перестановок и их формулой.Узнайте, как определить количество способов расположить предметы по кругу, и когда вы закончите, пройдите тест, чтобы узнать, что вы узнали.
Перестановка и комбинация: проблемы и практика
В этом уроке мы попрактикуемся в решении различных задач перестановки и комбинирования с использованием формул перестановки и комбинирования. Мы можем продолжить нашу практику, пройдя тест в конце урока.
Мы можем продолжить нашу практику, пройдя тест в конце урока.
Введение в вероятность: формулы и примеры
Вы когда-нибудь рискнули? Прежде чем воспользоваться этим шансом, вы хотели знать, каковы ваши шансы на фактическую победу? Тогда вы имели дело с вероятностью, вероятностью того, что конкретное событие произойдет.
Как использовать фундаментальный принцип счета
Есть много ситуаций, в которых вам придется принимать несколько решений одновременно. Фундаментальный принцип подсчета поможет вам определить, сколько существует различных возможных результатов, когда вам нужно принять несколько одновременных решений.
Фундаментальный принцип подсчета поможет вам определить, сколько существует различных возможных результатов, когда вам нужно принять несколько одновременных решений.
Комбинаторика и принцип голубятни
В этом уроке мы исследуем раздел математики, называемый комбинаторикой.Мы также рассмотрим хорошо известный принцип комбинаторики, называемый принципом ящика, и рассмотрим несколько простых примеров, в которых этот принцип может быть применен.
По мере того, как математика становится все более и более сложной, и число летающих вокруг становится все больше и больше, становится действительно удобно поместить все эти числа в красивую организованную сетку. .. привет матрицы! Узнайте о том, что они из себя представляют и почему они используются.
.. привет матрицы! Узнайте о том, что они из себя представляют и почему они используются.
Что такое вероятность в математике? — Определение и обзор
Помните, как бросали четверть и кричали орел или решку? Узнайте, какое отношение это имеет к вероятности.Также узнайте, как вы можете использовать полученные из этого урока навыки, чтобы решить, стоит ли вам вообще играть орлом или решкой!
Радианы и градусы: определение и примеры
Радианы и градусы — это два способа измерения углов. В этом уроке вы узнаете определение каждого метода, узнаете, как преобразовать один метод в другой, и решите некоторые практические задачи. Также в конце урока есть викторина.
В этом уроке вы узнаете определение каждого метода, узнаете, как преобразовать один метод в другой, и решите некоторые практические задачи. Также в конце урока есть викторина.
децилей в наборе данных: определение, формула и примеры
При работе с большими объемами данных часто бывает полезно сгруппировать данные перед дальнейшим анализом.Учитывая, что мы работаем с десятичной системой счисления, логично, что мы могли бы захотеть использовать деления на 10 или децили в качестве основной формы числовой группировки.
Практические задачи для логарифмических свойств
По мере того, как вы углубляетесь в математику, логарифмы будут появляться все больше и больше. Цель этого урока — научить вас справляться с ними и научить вас понимать, что делать, когда вы видите целую строку, заполненную ими!
Цель этого урока — научить вас справляться с ними и научить вас понимать, что делать, когда вы видите целую строку, заполненную ими!
Факторные практические задачи
Хотя определение факториала несложно, их легко усложнить, сложив множество из них вместе и добавив некоторые дроби.Проверьте свои навыки здесь с помощью некоторых алгебраических примеров, которые заставят вас использовать факториалы без множества чисел.
Условная вероятность: определение и использование
Мы знаем, что монета может упасть либо орлом, либо решкой. Но что произойдет, если один подбрасывание монеты изменится на следующий? В этом уроке мы рассмотрим события, которые зависят друг от друга, и узнаем, как вычислить вероятность того, что два события происходят в сочетании.
Но что произойдет, если один подбрасывание монеты изменится на следующий? В этом уроке мы рассмотрим события, которые зависят друг от друга, и узнаем, как вычислить вероятность того, что два события происходят в сочетании.
Посмотрев этот видеоурок, вы сможете определять части круга.Вы узнаете названия четырех различных частей круга, а также то, что каждая часть делает для круга.
Реакция одиночного смещения: определение и примеры — стенограмма видео и урока
Как мы уже говорили ранее, мы обычно заменяем что-то, если замена лучше или лучше подходит для наших целей. Замена обычно аналогична оригинальному объекту. Таким же образом, для реакции одинарного смещения элемент может быть заменен только в том случае, если элемент, занимающий его место, является более реактивным. В реакциях однократного вытеснения металл заменяет металл, а неметалл — неметалл. В периодической таблице мы можем видеть, где расположены металлы и неметаллы. Металлы расположены с левой стороны лестницы, а неметаллы — с правой стороны.
В реакциях однократного вытеснения металл заменяет металл, а неметалл — неметалл. В периодической таблице мы можем видеть, где расположены металлы и неметаллы. Металлы расположены с левой стороны лестницы, а неметаллы — с правой стороны.
Как узнать, какой элемент может заменить другой? Мы ссылаемся на серию мероприятий. Это говорит нам о реакционной способности металлов и неметаллов.Более химически активный металл заменяет менее химически активный металл. Более реактивный неметалл заменяет менее реактивный неметалл.
Если мы посмотрим на ряд активности металлов, мы увидим, что H включен, хотя H не является металлом. Это связано с тем, что для реакций однократного вытеснения H обычно ведет себя как металл в химических реакциях. В ряду активности металлов мы можем сказать, что Li может заменить K в реакции одинарного замещения, потому что Li более реактивен, чем K. То же самое можно сказать и о неметаллах: F может заменить Br в реакции одинарного вытеснения, потому что F более реактивен, чем Br. Br имеет относительно ту же реакционную способность, что и O.
То же самое можно сказать и о неметаллах: F может заменить Br в реакции одинарного вытеснения, потому что F более реактивен, чем Br. Br имеет относительно ту же реакционную способность, что и O.
Например, в этой реакции Cu заменяет Ag, потому что Cu более реактивна, чем Ag. Мы можем подтвердить это, посмотрев на ряды активности металлов.
Всегда важно правильно предсказать продукты химической реакции и убедиться, что окончательное химическое уравнение сбалансировано.В этой реакции она показывает, как мы уравновесили химическое уравнение. Мы ставим коэффициент 2 перед AgNO3 и Ag, чтобы сбалансировать количество атомов Ag и NO3 с обеих сторон.
Теперь, в этой химической реакции, более реактивный неметалл заменяет менее реактивный неметалл. В этом случае Cl заменяет Br, потому что Cl является более реакционноспособным неметаллом.
Следует отметить, что, когда Cl заменяет Br, Br имеет нижний индекс 2 на стороне продуктов. Это потому, что Cl и Br находятся в одной группе в периодической таблице, поэтому мы знаем, что они ведут себя одинаково.
Это потому, что Cl и Br находятся в одной группе в периодической таблице, поэтому мы знаем, что они ведут себя одинаково.
Как завершить реакцию одиночного вытеснения
Чтобы завершить реакцию одиночного вытеснения, мы должны пройти несколько шагов, чтобы убедиться, что наши продукты и наша окончательная реакция верны.
Шаг первый: Определите, произойдет ли реакция.
Реакция будет продолжаться только в том случае, если элемент, который заменяет исходный элемент, более реактивен.В этой реакции возникает вопрос: может ли Zn заменить H? Нам нужно обратиться к серии занятий. Это говорит нам о том, что Zn может заменять H, поэтому эта реакция будет происходить.
Шаг второй: Определите продукты.
Когда H заменяется на Zn, H естественно встречается как h3, поэтому со стороны продуктов одним из продуктов является h3. Цинк, металл, будет соединяться с неметаллом Cl. Поскольку Zn находится во второй группе периодической таблицы, он будет иметь заряд +2. Поскольку Cl находится в группе галогенов в периодической таблице, мы знаем, что он имеет заряд -1.
Поскольку Cl находится в группе галогенов в периодической таблице, мы знаем, что он имеет заряд -1.
Нам нужно объединить атомы Zn и Cl так, чтобы сумма их зарядов была равна нулю. В этом случае будет 1 атом цинка и 2 атома хлора. Тогда нашими продуктами будут ZnCl2 и h3.
Шаг третий: сбалансируйте химическую реакцию.
В этой реакции количество атомов H и Cl не сбалансировано, поэтому нам необходимо сбалансировать их, задав коэффициенты перед реагентами и продуктами, если необходимо.
В этом случае мы ставим коэффициент 2 перед HCl, чтобы уравновесить атомы H и Cl с обеих сторон.
Примеры реакций одинарного вытеснения
В нашем первом примере мы исследуем реакцию между Mg и CuSO4 . Эта реакция будет происходить, потому что Mg более реакционноспособен, чем Cu в ряду активности.
Cu, или медь, в природе встречается в твердом виде, поэтому одним из продуктов будет просто Cu.Mg находится в группе 2, поэтому у него будет заряд +2. SO4 можно рассматривать как отдельную группу атомов, а заряд SO4 равен -2.
В реакции будут продукты Cu и MgSO4. Как видим, реакция уже сбалансирована, так что это наш окончательный ответ.
Для нашего второго примера мы рассмотрим реакцию между Ca и h3O . Ca может заменять H в соответствии с рядом активности, поэтому эта реакция будет продолжаться.Когда мы сталкиваемся с подобными реакциями однократного вытеснения, мы перепишем уравнение как Ca + HOH.
H в природе встречается как h3, поэтому он станет одним из продуктов. Ca находится в группе 2, поэтому заряд Ca будет +2. Са соединяется с ОН, а общий заряд ОН равен -1. Эти два вместе станут Ca (OH) 2.
Са соединяется с ОН, а общий заряд ОН равен -1. Эти два вместе станут Ca (OH) 2.
В реакции будут продукты h3 и Ca (OH) 2.Чтобы уравновесить реакцию, нам нужно поставить коэффициент 2 перед HOH. В финальной реакции мы пишем HOH как h3O.
Итоги урока
Давайте рассмотрим. Реакция одинарного вытеснения происходит, когда элемент заменяет другой элемент в соединении. Металл заменяет только металл, а неметалл заменяет только неметалл. Только более реактивный элемент может заменить другой элемент в соединении, с которым он реагирует.Нам необходимо обратиться к серии активности , чтобы определить реакционную способность металлов и неметаллов.
Чтобы правильно завершить реакцию одинарного смещения, нам сначала нужно определить, произойдет ли реакция, посмотрев на ряд активности. Затем нам нужно определить правильные продукты, определив правильную степень окисления. Наконец, нам нужно убедиться, что химическая реакция сбалансирована.
Наконец, нам нужно убедиться, что химическая реакция сбалансирована.
Результаты обучения
Когда вы закончите, вы сможете:
- Вспомнить, что такое реакция одинарного смещения
- Понять, что такое серия действий и ее цель
- Обсудите шаги для завершения реакции одинарного смещения
хлор | Использование, свойства и факты
Хлор (Cl) , химический элемент, второй по легкости член галогенных элементов или Группа 17 (Группа VIIa) периодической таблицы.Хлор — это токсичный едкий газ зеленовато-желтого цвета, раздражающий глаза и дыхательную систему.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 17 | ||
|---|---|---|---|
| атомный вес | от 35,446 до 35,457 | ||
| точка плавления | −103 ° C (−153 ° F) | 50 | −34 ° C (−29 ° F) |
| плотность (1 атм, 0 ° C или 32 ° F) | 3,214 г / литр (0,429 унции / галлон) | ||
| степени окисления | −1, +1, +3, +5, +7 | ||
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 3 с 2 3 p 5 |
История
Каменная соль (поваренная соль или хлорид натрия) известна уже несколько тысяч лет.Это основной компонент солей, растворенных в морской воде, из которых он был получен в Древнем Египте путем испарения. В римские времена солдатам частично платили солью ( salarium , корень современного слова salarium ). В 1648 году немецкий химик Иоганн Рудольф Глаубер получил сильную кислоту, которую он назвал спиртом соли, путем нагревания влажной соли в угольной печи и конденсации паров в приемнике. Позже он получил тот же продукт, который теперь известен как соляная кислота, путем нагревания соли с серной кислотой.
В римские времена солдатам частично платили солью ( salarium , корень современного слова salarium ). В 1648 году немецкий химик Иоганн Рудольф Глаубер получил сильную кислоту, которую он назвал спиртом соли, путем нагревания влажной соли в угольной печи и конденсации паров в приемнике. Позже он получил тот же продукт, который теперь известен как соляная кислота, путем нагревания соли с серной кислотой.
Ионная связь в хлориде натрия. Атом натрия (Na) отдает один из своих электронов атому хлора (Cl) в химической реакции, и образующиеся положительный ион (Na + ) и отрицательный ион (Cl —) образуют стабильное ионное соединение. (хлорид натрия; поваренная соль) на основе этой ионной связи.
Encyclopædia Britannica, Inc. В 1774 году шведский химик Карл Вильгельм Шееле обработал порошкообразный черный оксид марганца соляной кислотой и получил зеленовато-желтоватый газ, который он не смог распознать как элемент. Истинная природа газа как элемента была признана в 1810 году английским химиком Хамфри Дэви, который позже назвал его хлором (от греческого chloros , что означает «желтовато-зеленый») и объяснил его отбеливающее действие.
Истинная природа газа как элемента была признана в 1810 году английским химиком Хамфри Дэви, который позже назвал его хлором (от греческого chloros , что означает «желтовато-зеленый») и объяснил его отбеливающее действие.
Возникновение и распространение
Помимо очень небольшого количества свободного хлора (Cl) в вулканических газах, хлор обычно находится только в форме химических соединений. Он составляет 0,017 процента земной коры. Природный хлор представляет собой смесь двух стабильных изотопов: хлора-35 (75.53 процента) и хлор-37 (24,47 процента). Наиболее распространенным соединением хлора является хлорид натрия, который в природе встречается в виде кристаллической каменной соли, часто обесцвеченной из-за примесей. Хлорид натрия также присутствует в морской воде, средняя концентрация которой составляет около 2 процентов от этой соли. Некоторые моря, не имеющие выхода к морю, такие как Каспийское море, Мертвое море и Большое соленое озеро в штате Юта, содержат до 33 процентов растворенной соли. В крови и молоке присутствует небольшое количество хлорида натрия.Другими хлорсодержащими минералами являются сильвит (хлорид калия [KCl]), бишофит (MgCl 2 ∙ 6H 2 O), карналлит (KCl ∙ MgCl 2 ∙ 6H 2 O) и каинит (KCl ∙ MgSO 4 ∙ 3H 2 O). Он содержится в минералах эвапорита, таких как хлорапатит и содалит. В желудке присутствует свободная соляная кислота.
В крови и молоке присутствует небольшое количество хлорида натрия.Другими хлорсодержащими минералами являются сильвит (хлорид калия [KCl]), бишофит (MgCl 2 ∙ 6H 2 O), карналлит (KCl ∙ MgCl 2 ∙ 6H 2 O) и каинит (KCl ∙ MgSO 4 ∙ 3H 2 O). Он содержится в минералах эвапорита, таких как хлорапатит и содалит. В желудке присутствует свободная соляная кислота.
Солевые месторождения на юго-западном берегу Мертвого моря недалеко от Масады, Израиль.
З. Радован, Иерусалим Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас Современные солевые отложения, должно быть, образовались в результате испарения доисторических морей, сначала кристаллизовались соли с наименьшей растворимостью в воде, а затем соли с большей растворимостью. Поскольку хлорид калия более растворим в воде, чем хлорид натрия, некоторые отложения каменной соли, например, в Штассфурте, Германия, были покрыты слоем хлорида калия. Чтобы получить доступ к хлориду натрия, сначала удаляют калиевую соль, важную как удобрение.
Чтобы получить доступ к хлориду натрия, сначала удаляют калиевую соль, важную как удобрение.
Галогены в водном растворе и реакции их замещения | Эксперимент
Галогены в небольшой степени реагируют с водой, образуя кислые растворы с отбеливающими свойствами. Они также подвергаются окислительно-восстановительным реакциям с галогенидами металлов в растворе, вытесняя менее реактивные галогены из своих соединений. Эти реакции замещения используются для установления порядка реактивности вниз по 17-й группе периодической таблицы.
Эта серия простых экспериментов иллюстрирует некоторые химические свойства галогенов после введения в физические свойства элементов Группы 17.Это может быть демонстрация или классный эксперимент.
Исследование растворимости галогенов в неполярном растворителе может быть опущено или показано только в качестве демонстрации.
Если упражнение проводится в качестве демонстрации, оно должно занять около 15 минут. Если это будет классный эксперимент, вы должны выделить 30 минут.
Оборудование
Аппарат
- Защита глаз
- Штатив для пробирок на 10 пробирок
- Пробирки x10
- Пробковые или резиновые заглушки по размеру, 4 шт.
- Пластиковые пипетки-капельницы x6
- Плитка белая
- Белая плитка
- Стеклянный стержень
- Бумажное полотенце или салфетка
Химическая промышленность
- Около 10 см 3 каждого из следующих растворов галогенов в закрытых пробирках (см. Примечания 1 и 2):
- Хлорная вода, 0.1% (мас. / Об.) (ВРЕДНО)
- Бромная вода, 0,1% (мас. / Об.) (ВРЕДНО)
- Раствор йода, 0,1 М
- Половина пробирки с 0,1 М растворами каждого из следующих веществ:
- Калий хлористый
- Бромид калия
- Иодид калия
- Универсальная индикаторная бумага (полоски около 2 см), 3 шт.
Дополнительно
- Циклогексан (легковоспламеняющийся, ВРЕДНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) или другой подходящий неполярный растворитель, около 10 см 3 (см.
 Примечание 1)
Примечание 1)
Примечания к химическим веществам
- Каждой группе студентов должны быть предоставлены пробирки с пробками, содержащие около 10 см. 3 каждого из водных растворов галогенов и одного раствора циклогексана (по желанию).
- Растворы галогенов можно дополнительно разбавить, чтобы минимизировать количество выделяемых паров хлора или брома, но не следует разбавлять их настолько, чтобы их отличительный цвет не был четко виден в пробирках (для хлорной воды может потребоваться белый фон).
- По окончании экспериментов все смеси и растворы должны быть возвращены в подходящий контейнер для отходов в вытяжном шкафу для безопасной утилизации.
Примечания по технике безопасности и охране труда
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности.
- Всегда используйте защитные очки.
- Позаботьтесь о том, чтобы ограничить воздействие паров хлора и брома на учащихся.
 У некоторых учащихся с респираторными проблемами может проявляться аллергическая реакция на хлор, начало которой может быть отложено.
У некоторых учащихся с респираторными проблемами может проявляться аллергическая реакция на хлор, начало которой может быть отложено. - Хлорная вода, Cl 2 (водн.) — см. CLEAPSS Hazcard HC022b и CLEAPSS Recipe Book RB025. Сам по себе раствор является НИЗКОЙ ОПАСНОСТЬЮ, но газообразный хлор (ТОКСИЧНЫЙ, ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) улетучивается, поэтому маркировка ВРЕДНО будет разумной.
- Бромная вода, Br 2 (водный), (ВРЕДНО) — см. CLEAPSS Hazcard HC015b и книгу рецептов CLEAPSS RB017.
- Раствор йода, I 2 (водный) — см. CLEAPSS Hazcard HC054 и CLEAPSS Recipe Book RB050. Раствор йода — это на самом деле йод, растворенный в водном растворе йодида калия.
- Растворы хлорида калия, KCl (водн.), Бромида калия, KBr (водн.) И йодида калия, KI (водн.) — НИЗКАЯ ОПАСНОСТЬ — см. CLEAPSS Hazcard HC047b и CLEAPSS Recipe Book RB068.Если соли калия недоступны, можно использовать натриевые соли. Концентрацию раствора йодида калия следует отрегулировать так, чтобы он давал светло-коричневый раствор при добавлении хлорной воды.
 Если реагенты слишком концентрированы, вместо коричневого раствора часто образуется черный осадок йода.
Если реагенты слишком концентрированы, вместо коричневого раствора часто образуется черный осадок йода. - Циклогексан, C 6 H 12 (l), (ОЧЕНЬ ВОСПЛАМЕНЯЮЩИЙСЯ, ВРЕДНО, ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC045b.
Процедура
Галогены в воде и углеводородном растворителе (необязательно)- Налейте около 2 см 3 каждого из водных растворов галогенов в отдельные пробирки.Добавьте равные объемы углеводородного растворителя в каждую пробирку, закройте пробирку и, удерживая большой палец над пробкой, встряхните смесь, перевернув пробирку несколько раз.
- Дайте двум слоям осесть. Наблюдайте и записывайте цвет каждого слоя. Может потребоваться снова встряхнуть пробирки для переноса большего количества галогена из воды в углеводородный слой.
- Положите кусок универсальной индикаторной бумаги на белую плитку.
 С помощью стеклянной палочки нанесите каплю хлорной воды на бумагу. Обратите внимание на цвет бумаги и запишите его.
С помощью стеклянной палочки нанесите каплю хлорной воды на бумагу. Обратите внимание на цвет бумаги и запишите его. - Протрите стеклянный стержень и плитку бумажным полотенцем или салфеткой. Положите на плитку свежий кусок индикаторной бумаги и с помощью стеклянной палочки нанесите на нее каплю бромной воды. Обратите внимание на цвет бумаги.
- Повторите шаг 2, используя раствор йода.
- Используя пластиковую пипетку, нанесите две капли раствора хлора в каждую из трех ямок на плитке для пятен, как показано ниже.Таким же образом, используя чистую пластиковую пипетку для каждого раствора, добавьте бромную воду и раствор йода к плитке для пятен.
- Добавьте две капли раствора хлорида калия в каждую из трех ямок в столбце 1 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
- Добавьте две капли раствора бромида калия в каждую из трех ямок в столбце 2 плитки.
 Наблюдайте и записывайте любые происходящие изменения цвета.
Наблюдайте и записывайте любые происходящие изменения цвета. - Добавьте две капли раствора йодида калия в каждую из трех ямок в столбце 3 плитки. Наблюдайте и записывайте любые происходящие изменения цвета.
Дополнительно
- Для реакций, в которых предполагается образование брома или йода, реакцию можно повторить с 2 см 3 каждого раствора в пробирке, а затем можно добавить гексан для подтверждения присутствия брома или йода.
Учебные заметки
Таблица результатов, подобная приведенной ниже, может использоваться для записи результатов.Он был завершен с ожидаемыми наблюдениями.
| Цвет после встряхивания с углеводородным растворителем | Влияние на индикаторную бумагу | Реакция с раствором хлорида калия | Реакция с раствором бромида калия | Реакция с раствором йодида калия | |
|---|---|---|---|---|---|
| Хлор | Водный слой: от бледно-желто-зеленого до бесцветного Углеводородный слой: от бесцветного до бледно-желто-зеленого | Становится красным, затем быстро обесцвечивается | Нет реакции | Появляется желто-оранжевый цвет брома | Появляется коричневый цвет йода |
| Бромная вода | Водный слой: от желто-оранжевого до бесцветного Углеводородный слой: от бесцветного до бледно-желто-оранжевого | Становится красным, затем медленно обесцвечивается | Нет реакции | Нет реакции | Цвет темнеет от желто-оранжевого до коричневого |
| Раствор йода | Водный слой: от коричневого до бесцветного Углеводородный слой: от бесцветного до фиолетового | Бумага морилка коричневая | Нет реакции | Нет реакции | Нет реакции |
Галогены более растворимы в углеводородах и перемещаются в этот верхний слой при встряхивании с углеводородным растворителем. Для хлора и брома цвет не меняется. Вам может понадобиться белый фон, чтобы увидеть цвет раствора хлора. Однако для йода наблюдается изменение цвета от коричневого в воде до пурпурного в углеводородном слое.
Для хлора и брома цвет не меняется. Вам может понадобиться белый фон, чтобы увидеть цвет раствора хлора. Однако для йода наблюдается изменение цвета от коричневого в воде до пурпурного в углеводородном слое.
Если между раствором галогена и раствором галогенида не происходит реакции замещения, может наблюдаться некоторое осветление цвета раствора, что можно объяснить эффектом разбавления.
Позаботьтесь о том, чтобы ограничить воздействие паров хлора и брома на учащихся.У некоторых учащихся с респираторными проблемами может проявляться аллергическая реакция на хлор, начало которой может быть отложено.
Йод наименее растворим в воде из галогенов. Он более растворим в растворе йодида калия, поэтому «раствор йода» здесь на самом деле йод в растворе йодида калия.
Обратите внимание студентов на сходство между цветом паров йода и его цветом в неполярном растворителе. Молекулы полярной воды взаимодействуют с молекулами йода, изменяя длину волны света, которую они поглощают.
Все три галогена реагируют с водой с образованием сильной кислоты (HX) и слабой кислоты (HOX), которая обладает отбеливающими свойствами и является окислителем.
X 2 (водн.) + H 2 O (л) → HX (водн.) + HOX (водн.)
Степень реакции снижается в группе 17. С йодом она настолько мала, что кислотные и отбеливающие свойства раствора не наблюдаются в этом эксперименте.
В реакциях замещения хлор вытесняет бром и йод из их соединений, а бром замещает йод.Например:
Cl 2 (водн.) + 2KI (водн.) → I 2 (водн.) + 2KCl (водн.)
Таким образом, реакционная способность будет следующей: хлор> бром> йод. Более продвинутая обработка идентифицирует галогены как окислители, принимающие электрон для образования галогенид-ионов:
Cl 2 (водн.) + 2I — (водн.) → I 2 (водн.) + 2Cl — (водн.)
Вопреки мнению многих студентов, реакция не имеет ничего общего с реакционной способностью калия «захватить» хлор. Калий здесь присутствует только в виде очень инертных ионов калия (ионов-наблюдателей) в растворе.
Калий здесь присутствует только в виде очень инертных ионов калия (ионов-наблюдателей) в растворе.
Живые науки для Науки 7 класса Глава 8
Стр. № 87:
Вопрос 1:
Что из этого является химическим изменением?
(a) Образуется субакне с разными химическими свойствами.
(b) Образуется вещество в другом состоянии, но с аналогичными химическими свойствами.
(c) Молекулы веществ не претерпевают никаких изменений.
(d) Образуется вещество другой формы и размера, но схожими химическими свойствами.
Ответ:
(a) Образуется вещество с различными химическими свойствами.
Химическое изменение происходит, когда два вещества вступают в химическую реакцию с образованием новых веществ с разными химическими свойствами.
Стр. № 87:
Вопрос 2:
Что из этого является необратимым физическим изменением?
(а) ржавление железа
(б) замерзание воды
(в) реакция двойного разложения
(г) разбитие стеклянного стакана
Ответ:
(d) разбитие стеклянного стакана
Разрушение стеклянного стакана является необратимым физическим изменением. Ржавчина железа — это химическое изменение. Замерзание воды — это обратимое физическое изменение. Реакция двойного разложения — это химическое изменение.
Ржавчина железа — это химическое изменение. Замерзание воды — это обратимое физическое изменение. Реакция двойного разложения — это химическое изменение.
Стр. № 87:
Вопрос 3:
Стрелка, направленная вниз в химической реакции, показывает
(a) выделение газа
(b) образование осадков
(c) окисление
(d) вытеснение
Ответ:
(b) образование осадка
В химической реакции стрелка, направленная вниз, показывает образование осадка, а стрелка, направленная вверх, показывает выделение газа.
Стр. № 87:
Вопрос 4:
Химическая реакция, при которой выделяется тепло, называется
(a) экзотермическая реакция
(b) эндотермическая реакция
(c) реакция разложения
(d) реакция нейтрализации
Ответ:
(а) экзотермическая реакция
Экзотермические реакции сопровождаются выделением тепла. Эндотермические реакции сопровождаются поглощением тепла.
Эндотермические реакции сопровождаются поглощением тепла.
Стр. № 87:
Вопрос 5:
Сколько продуктов образуется в реакции сочетания?
(a) только два
(b) только один или два
(c) только один
(d) номер не может быть указан
Ответ:
(c) только один
В реакции сочетания из его элементов образуется соединение.Например, вода и кислород вместе образуют воду.
Стр. № 87:
Вопрос 6:
Что происходит при реакции вытеснения?
(a) Более реактивный элемент заменяет менее реактивный элемент.
(b) Менее реактивный элемент заменяет более реактивный элемент.
(c) Элемент заменяет элемент, обладающий равной реактивностью.
(d) Любой элемент может заменить любой другой элемент, не имеющий отношения к реактивности.
Ответ:
(a) Более реактивный элемент заменяет менее реактивный элемент.
В реакции замещения более реактивный элемент заменяет менее реактивный элемент из своего соединения.
Стр. № 87:
Вопрос 7:
Реакция нейтрализации — это реакция разложения
(а).
(б) реакция вытеснения.
(c) реакция комбинации.
(г) реакция двойного вытеснения.
Ответ:
(г) реакция двойного вытеснения.
Реакция нейтрализации — это реакция двойного замещения, в которой кислота реагирует с основанием и радикалы обмениваются с образованием соли и воды.
Стр. № 87:
Вопрос 8:
Реакция окисления включает добавление
(a) только кислорода
(b) только водорода
(c) кислорода или удаления водорода
(d) водорода или удаления кислорода
Ответ:
(c) кислород или удаление водорода
Реакция окисления включает добавление кислорода или удаление водорода из вещества.
Стр. № 87:
Вопрос 9:
Если в какой из следующих реакций присутствует только один реагент?
(а) реакция комбинации
(б) реакция разложения
(в) реакция одинарного вытеснения
(г) реакция двойного вытеснения
Ответ:
(b) реакция разложения
В реакции разложения соединение (реагент) распадается на два или более веществ (продуктов).
Стр. № 87:
Вопрос 10:
Если A более реактивен, чем B, что из следующего верно?
(a) A заменит B солью B.
(b) B заменит A солью A.
(c) Оба могут вытеснять друг друга из своих солей.
(d) Оба не могут вытеснить друг друга из своих солей.
Ответ:
(a) A заменит B из соли B.
Данная реакция является примером реакции замещения, в которой более реактивный элемент заменяет менее реактивный элемент из своего солевого раствора.
Стр. № 88:
Вопрос 1:
Почему водопроводные трубы оцинкованы?
Ответ:
Водопроводные трубы сделаны из железа. Ржавление железа происходит при взаимодействии железа с воздухом и водой.Поэтому, чтобы предотвратить ржавление железа, водопроводные трубы оцинковываются, то есть железные трубы покрываются металлами, такими как цинк или хром, чтобы предотвратить взаимодействие железа с воздухом.
Стр. № 88:
Вопрос 2:
Когда вода замерзает, она образует лед с разными свойствами. Почему же тогда мы говорим, что замораживание — это физическое изменение?
Ответ:
При физическом изменении изменяются только физические свойства вещества, а новые вещества не образуются.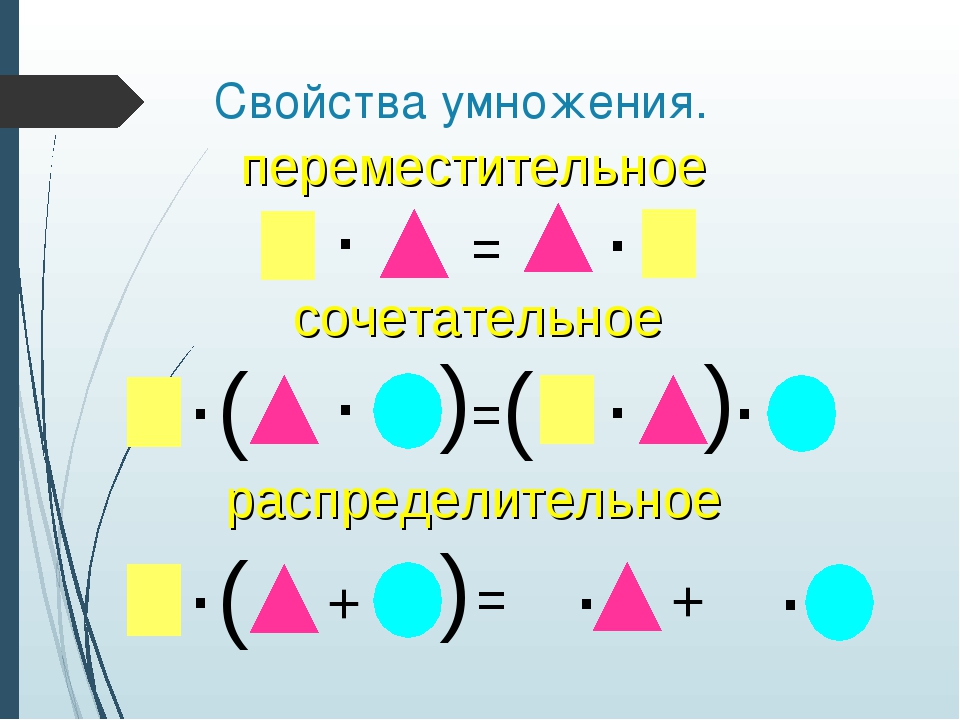
Замерзание воды — это физическое изменение, потому что изменяется только физическое состояние воды; т.е. вода превращается в лед. Следовательно, замораживание — это физическое изменение.
Стр. № 88:
Вопрос 3:
Приведите по одному примеру каждой химической реакции, демонстрирующей следующие характеристики.
(a) выделение газа
(b) изменение цвета
(c) образование осадка
(d) изменение состояния с жидкости на газ
(e) изменение состояния с газа на жидкость
Ответ:
(а) Zn + H 2 SO 4 → ZnSO 4 + H 2 ↑
Цинк Серно-цинковый водород
сульфат кислоты
(б) CuCO 3 → CuO + CO 2 ↑
Медь Медь Углерод
Оксид карбоната Диоксид
(зеленый) (черный)
(c) CuSO 4 + H 2 S → CuS ↓ + H 2 SO 4
Медь Водород Медь Серная
сульфат сульфид сульфидная кислота
(г) 2H 2 O (л) → 2H 2 (г) + O 2 (г)
Водородный кислород
(д) 2H 2 (г) + O 2 (г) → 2H 2 O (л)
Водород кислородная вода
Стр.
 № 88:
№ 88:Вопрос 4:
Различают эндотермические и экзотермические реакции.
Ответ:
| Эндотермическая реакция | Экзотермическая реакция |
| Эти реакции сопровождаются поглощением тепла. | Эти реакции сопровождаются выделением тепла. |
| Плавление твердых веществ, плавление, испарение и испарение являются примерами эндотермической реакции. | Сжигание бензина и окисление аммиака являются примерами экзотермической реакции. |
Стр. № 88:
Вопрос 5:
Что такое комбинированная реакция? Привести пример.
Ответ:
В реакции сочетания соединение образуется из его элементов или из более простых веществ. Например, магний реагирует с кислородом при нагревании с образованием оксида магния.
Например, магний реагирует с кислородом при нагревании с образованием оксида магния.
2Mg + O 2 → 2MgO
Стр. № 88:
Вопрос 6:
Когда говорят, что вещество восстанавливается в результате химических реакций?
Ответ:
В химической реакции вещество восстанавливается, если к нему добавляют водород или удаляют кислород.
Стр. № 88:
Вопрос 7:
Что такое кристаллизация?
Ответ:
Кристаллизация — это процесс, при котором чистое твердое вещество отделяется от раствора в виде кристаллов.
Например, поваренная соль, полученная из морской воды, содержит растворимые примеси, такие как хлорид магния. Для очистки поваренной соли применяется процесс кристаллизации.
Стр. № 88:
Вопрос 8:
Что такое перенасыщенный раствор?
Ответ:
Раствор, в котором растворяется больше растворенного вещества при повышении температуры насыщенного раствора, называется перенасыщенным раствором. Когда перенасыщенный раствор охлаждается до комнатной температуры, он легко кристаллизуется.
Стр. № 88:
Вопрос 1:
Обсудите методы предотвращения коррозии железа.
Ответ:
Ржавчину железа можно предотвратить следующими методами:
(a) Покраска: слой краски, нанесенный на поверхность железного предмета, предотвращает взаимодействие кислорода и влаги, присутствующих в атмосфере, с железным предметом.
(b) Масло или смазка: Нанесение масла или смазки на поверхность металлических инструментов помогает предотвратить попадание кислорода и влаги из атмосферы.
(c) Гальванизация: Гальванизация — это процесс покрытия железных предметов тонким слоем металла, такого как цинк или хром.Тонкое покрытие из цинка или хрома защищает утюг от ржавчины.
Стр. № 88:
Вопрос 2:
Какой газ выделяется при добавлении разбавленной соляной кислоты к карбонату кальция?
Как вы будете проверять газ? Напишите химические уравнения для обеих реакций.
Ответ:
Двуокись углерода выделяется при добавлении разбавленной соляной кислоты к карбонату кальция.Используемое уравнение:
CaCO 3 + HCl → CaCl 2 + H 2 O + CO 2 ↑
Углекислый газ можно проверить, пропустив его через известковую воду. Известковая вода становится молочной. Используемое уравнение:
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O
Известь углерода, кальция вода
диоксид карбонат
Карбонат кальция, образующийся в реакции, имеет белый цвет. цвет и мало растворим в воде.Он придает молочный вид и используется в качестве теста на наличие углекислого газа.
цвет и мало растворим в воде.Он придает молочный вид и используется в качестве теста на наличие углекислого газа.
Стр. № 88:
Вопрос 1:
При каких изменениях вещества подвергаются химическому превращению — физическому или химическому?
Ответ:
При химических изменениях вещества подвергаются химическому превращению с образованием новых веществ.
Стр. № 88:
Вопрос 2:
Rush — это смесь, не имеющая химической формулы.Правда или ложь?
Ответ:
Неверно.
Ржавчина — это соединение. Его химическая формула: Fe 2 O 3 .H 2 O.
Стр. № 88:
Вопрос 3:
Процесс нанесения цинка на железо для предотвращения ржавчины называется __________
Ответ:
Процесс нанесения цинка на железо для предотвращения ржавчины называется гальваника .
Стр. № 88:
Вопрос 4:
Какой газ выделяется при нагревании карбоната кальция?
Ответ:
При нагревании карбоната кальция образуется оксид кальция и выделяется диоксид углерода.
CaCO 3 → CaO + CO 2
Стр. № 88:
Вопрос 5:
Когда два растворимых вещества в растворе реагируют с образованием нерастворимого вещества, образуется _________.
Ответ:
Когда два растворимых вещества в растворе реагируют с образованием нерастворимого вещества, образуется осадок .
Стр. № 88:
Вопрос 6:
Тепло поглощается _________ реакцией.
Ответ:
Тепло поглощается эндотермической реакцией.
Стр. № 88:
Вопрос 7:
Если в правой части уравнения написано «+ тепло», то какой это тип реакции?
Ответ:
Знак «+ тепло» означает, что реакция сопровождается выделением тепла. Реакция экзотермическая.
Стр. № 88:
Вопрос 8:
Определите, какой тип реакции каждый из следующих:
(a) X + Y → XY
(b) XY → X + Y
(c) AB + XY → AY + XB
(d) AB + X → AX + B
(e) AB + CD → AD + BC
(f) Кислота + основание → соль + вода
Ответ:
(a) Реакция сочетания
(b) Реакция разложения
(c) Реакция двойного вытеснения
(d) Реакция одиночного вытеснения
(e) Реакция двойного вытеснения
(f) Реакция нейтрализации
Стр.
 № 88:
№ 88:Вопрос 9:
Окислитель обеспечивает ________ или удаляет _________ из вещества.
Ответ:
Окислитель обеспечивает кислородом или удаляет водород из вещества.
Стр. № 88:
Вопрос 10:
Какой метод вы будете использовать для получения чистой жидкости, если в ней есть растворенные примеси?
Ответ:
Мы будем использовать метод кристаллизации для получения чистой жидкости, если в ней есть растворенные примеси.
Стр. № 88:
Вопрос 11:
Соль получают из морской воды кристаллизацией. Правда или ложь?
Ответ:
Неверно.
Соль получают из морской воды испарением.
Стр. № 88:
Вопрос 12:
Перенасыщенный раствор твердого вещества в жидкости легко кристаллизуется.Правда или ложь?
Ответ:
Верно.
Перенасыщенный раствор содержит больше растворенного вещества, чем может оставаться растворенным в воде. Он очень нестабилен и легко кристаллизуется.
Стр. № 89:
Вопрос 3:
Объясните этапы получения основного гидроксида магния из металлического магния.
Ответ:
Для получения основного гидроксида магния из металлического магния используются следующие этапы:
(a) Возьмите небольшой кусок магниевой ленты.
(b) Очистите его кончик наждачной бумагой.
(c) Возьмите его щипцами и поднесите к пламени. Он горит ослепительным пламенем и образует порошкообразный пепел (оксид магния).
Он горит ослепительным пламенем и образует порошкообразный пепел (оксид магния).
(e) Соберите золу в пробирку, смешайте ее с небольшим количеством воды и перемешайте.
Когда оксид магния растворяется в воде, он образует гидроксид магния. Уравнение:
2MgO + 2H 2 O → 2Mg (OH) 2
Магний Вода Магний
гидроксид оксида
Стр. № 89:
Вопрос 4:
Реакция разложения противоположна реакции сочетания.Объясните на примере.
Ответ:
Реакция, в которой соединение распадается с образованием двух или более простых веществ, называется реакцией разложения.
Например, при пропускании электрического тока через воду, в которую было добавлено небольшое количество серной кислоты, вода разлагается с образованием газов водорода и кислорода.
2H 2 O → 2H 2 + O 2
Реакция, в которой два или более элемента объединяются с образованием единого соединения, называется реакцией сочетания.
Например, водород соединяется с кислородом с образованием воды.
2H 2 + O 2 → 2H 2 O
Из приведенных выше примеров ясно, что реакция разложения противоположна реакции сочетания.
Стр. № 89:
Вопрос 5:
При каких двух условиях обычно протекают реакции разложения? Приведите по одному примеру каждого из них.
Ответ:
Двумя условиями, при которых обычно происходит реакция разложения, являются следующие:
(a) Нагревание: при нагревании гидроксида кальция образуются оксид кальция и водяной пар.
Ca (OH) 2 → CaO + H 2 O
Кальций Кальций Вода
гидроксид оксида
(b) Электролиз: когда электрический ток проходит через расплавленный оксид алюминия, он подвергается разложению с образованием алюминия и кислорода газ.
2Al 2 O 3 → 4Al + 3O 2
Стр.
 № 89:
№ 89:Вопрос 6:
Что такое реакция вытеснения? Какое правило регулирует смещение одного элемента в соединении другим элементом? Объясните на примере.
Ответ:
В реакции замещения один элемент заменяет другой элемент соединения. Как правило, более реактивный элемент заменяет менее реактивный элемент из своего соединения. Например, железо является более активным элементом, чем медь. Если в раствор медного купороса добавить железку, образуется сульфат железа. Металлическая медь оседает на железной детали.
CuSO 4 + Fe → FeSO 4 + Cu
Медь Железо Железо Медь
сульфат сульфат
Стр. № 89:
Вопрос 7:
Что такое реакция двойного разложения? Сколько вам известно типов реакции двойного разложения? Приведите по одному примеру каждого из них.
Ответ:
Реакция, в которой два соединения реагируют с образованием двух других соединений путем взаимного обмена атомами или группой атомов, называется реакцией двойного замещения. Есть два типа реакции двойного вытеснения.
(a) Реакция осаждения: В этой реакции два соединения реагируют в их водном состоянии с образованием нерастворимого продукта, который появляется в виде осадка. Например, водный раствор хлорида натрия и нитрат серебра реагируют с образованием белого осадка хлорида серебра.
NaCl + AgNO 3 → AgCl ↓ + NaNO 3
Натрий Серебро Серебро Натрий
хлорид нитрат хлорид нитрат
(b) Реакция нейтрализации: при взаимодействии основания и кислоты они обмениваются ионами и образуют соединения называется солью, водой и иногда газом. Например, соляная кислота реагирует с гидроксидом калия с образованием хлорида калия (соли) и воды.
HCl + KOH → KCl + H 2 O
Соляной калий Калийная вода
Гидроксид хлорид кислоты
Стр.
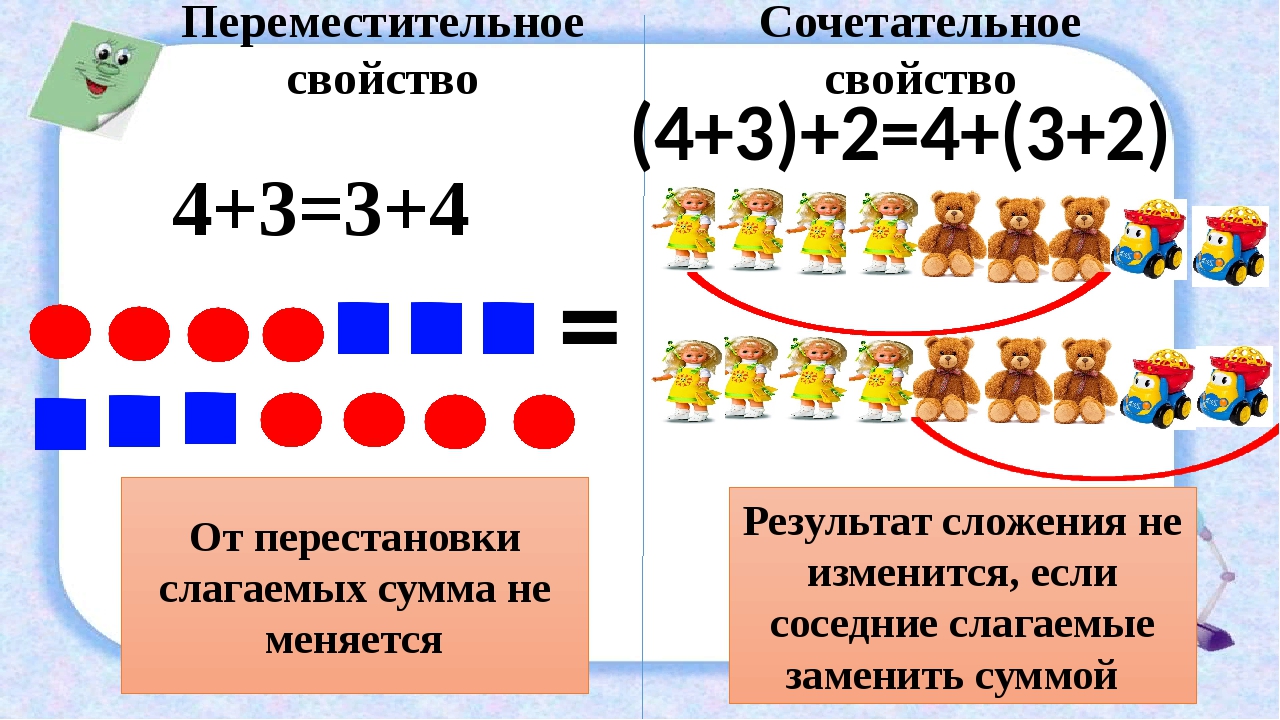 № 89:
№ 89:Вопрос 8:
Объясните термины «окислитель» и «окислитель».
Ответ:
Окисление — это химическая реакция, которая включает добавление кислорода или удаление водорода из вещества.Например, когда углерод реагирует с кислородом с образованием диоксида углерода, говорят, что он окисляется, получая кислород.
C + O 2 → CO 2
Углерод Кислород Углерод
диоксид
Аналогичным образом, когда сероводород реагирует с хлором, считается, что сероводород окисляется до серы за счет потери водорода.
H 2 S + Cl 2 → S + 2HCl
Водород Хлор Сера соляная
сульфидная кислота
Окислитель — это агент, который окисляет другие вещества, либо обеспечивая их кислородом, либо удаляя из них водород.
Стр. № 89:
Вопрос 1:
В каком городе, по вашему мнению, ржавчина будет более серьезной проблемой — в Дели или в Мумбаи? Почему?
Ответ:
Для образования ржавчины необходимы два условия: содержание кислорода и влаги в атмосфере.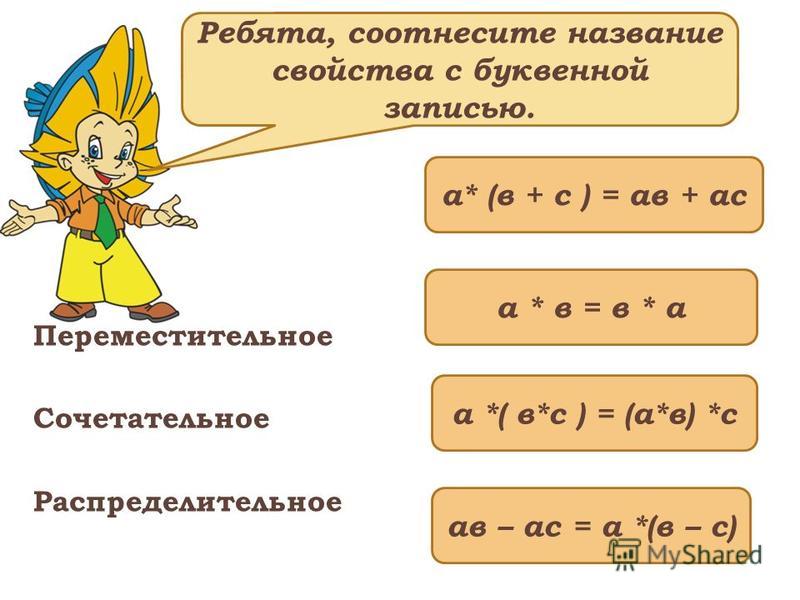 Климат Дели жаркий и сухой, тогда как климат Мумбаи влажный. Следовательно, ржавчина — большая проблема в Мумбаи, потому что в атмосфере больше влаги и кислорода.
Климат Дели жаркий и сухой, тогда как климат Мумбаи влажный. Следовательно, ржавчина — большая проблема в Мумбаи, потому что в атмосфере больше влаги и кислорода.
Стр. № 89:
Вопрос 2:
Когда горит свеча, происходят как физические, так и химические изменения. Что это за изменения?
Ответ:
Плавление воска — это физическое изменение, а образование углекислого газа и водяного пара — это химическое изменение. Следовательно, при горении свечи происходят как физические, так и химические изменения.
Стр. № 89:
Вопрос 3:
LPG (сжиженный углеводородный газ) в газовом баллоне находится в виде жидкости.Какие физические и химические изменения происходят, когда он выходит из цилиндра и горит?
Ответ:
СНГ в баллоне существует в виде жидкости. Когда он выходит из цилиндра, он превращается в газ, что является физическим изменением. Сжигание сжиженного нефтяного газа — это химическое изменение.
Когда он выходит из цилиндра, он превращается в газ, что является физическим изменением. Сжигание сжиженного нефтяного газа — это химическое изменение.
Стр. № 89:
Вопрос 4:
При открытии бутылки с газированной водой выделяется газ.Происходит химическая реакция? Объяснять.
Ответ:
Нет, химической реакции не происходит. Когда бутылка из-под газировки открыта, выделяется углекислый газ. Углекислый газ уже растворен внутри бутылки с газировкой. После снятия крышки давление внутри сбрасывается, и углекислый газ выходит.
Стр. № 89:
Вопрос 5:
Почему нельзя класть ложки из нержавеющей стали в банки для маринадов?
Ответ:
Сталь реагирует с кислотами, присутствующими в травильном растворе, и образует ржавчину.



 Как называются числа, которые умножаем?
Как называются числа, которые умножаем?

 ) («Золотая книга»). (1997).
) («Золотая книга»). (1997).  Это композиционная реакция.
Это композиционная реакция. [латекс] \ large \ text {N} \ text {H} _ {3} \ text {(} g \ text {)} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {N}} _ {2} \ text {(} g \ text {)} + {\ text {H}} _ {2} \ text {O (} g \ text {)} [/ латекс]
[латекс] \ large \ text {N} \ text {H} _ {3} \ text {(} g \ text {)} + {\ text {O}} _ 2 \ text {(} g \ text {)} \ rightarrow {\ text {N}} _ {2} \ text {(} g \ text {)} + {\ text {H}} _ {2} \ text {O (} g \ text {)} [/ латекс]
 Примечание 1)
Примечание 1) У некоторых учащихся с респираторными проблемами может проявляться аллергическая реакция на хлор, начало которой может быть отложено.
У некоторых учащихся с респираторными проблемами может проявляться аллергическая реакция на хлор, начало которой может быть отложено. Если реагенты слишком концентрированы, вместо коричневого раствора часто образуется черный осадок йода.
Если реагенты слишком концентрированы, вместо коричневого раствора часто образуется черный осадок йода. С помощью стеклянной палочки нанесите каплю хлорной воды на бумагу. Обратите внимание на цвет бумаги и запишите его.
С помощью стеклянной палочки нанесите каплю хлорной воды на бумагу. Обратите внимание на цвет бумаги и запишите его. Наблюдайте и записывайте любые происходящие изменения цвета.
Наблюдайте и записывайте любые происходящие изменения цвета.