Беременность и щитовидная железа — OXY-center
Во время беременности во всем организме женщины происходит множество изменений, а один из самых важных органов репродуктивной системы – щитовидная железа. От уровня функциональности которой зависит состояние здоровья беременной, ее гормональный статус и, конечно, правильное развитие малыша.Как работает щитовидная железа?
Основная задача щитовидной железы – выработка гормона тироксина, который выступает регулятором обменных процессов и воздействует на все клетки и ткани.Работу железы также регулирует гипофиз посредством тиреотропного гормона (ТТГ), который в свою очередь регулируется гипоталамусом, и на все эти взаимодействия оказывает непосредственное влияние центральная нервная система.
При нарушении этих процессов регуляции и взаимодействия и возникают патологические изменения.
Другими словами, в норме щитовидная железа выделяет достаточное количество гормонов, гипофиз определяя их концентрацию выделяет достаточное количество ТТГ, которое требуется для нормальной работы щитовидной железы и гормональный статус находится в равновесии.
При недостаточной функции щитовидной железы развивается гипотиреоз и наоборот при высокой концентрации гормонов – гипертиреоз.
Что происходит во время беременности?
Во время беременности уровень ТТГ снижается, в норме он составляет 0,4-4 мЕд, у беременных в 1 триместре – менее 2,5 мЕд, во 2 и 3 – менее 3 мЕд.Это происходит из-за повышения уровня ХГЧ (хорионический гормон человека), который кроме поддержания беременности оказывает стимулирующее воздействие на щитовидную железу схожее с ТТГ. Соответственно ЩЖ активнее работает, выпускает больше гормонов. В ответ гипофиз понимает, что гормонов щитовидной железы стало больше и выбрасывает в кровь меньше ТТГ. Так происходит при нормальном течение беременности.
Однако в некоторых случаях гормональный статус при беременности меняется не одинаково и ХГЧ воздействует на щитовидную железу так активно, что уровень ТТГ снижается до 0,1 мЕд. В этом случае, при отсутствии выраженных симптомов (тахикардии, токсикоза) может быть диагностирован гестационный гипертиреоз, которые не требует лечения, но предполагает регулярное наблюдение у врача-эндокринолога и контроль уровня гормонов.
Контроль и диагностика таких состояний осуществляет при помощи лабораторной диагностики врачом-эндокринологом.
Записаться в нашу клинику на прием врача можно по телефону или через форму записи на сайте.
Щитовидная железа и беременность / Эндокринология / Статьи о здоровье / Статьи и энциклопедия / madez.ru
Щитовидная железа оказывает огромное влияние на репродуктивную функцию женщины. Гормоны щитовидной железы:
— регулируют процессы развития, созревания, специализации и обновления всех тканей плода;
— имеют исключительное значение для закладки и развития головного мозга плода;
— формируют интеллект ребенка, обучаемость, IQ;
Гормоны щитовидной железы производятся из поступающего с пищевыми продуктами йода. Если до беременности производство тиреоидных гормонов относительно стабильно, то с первых недель беременности уже происходит изменение функционирования щитовидной железы.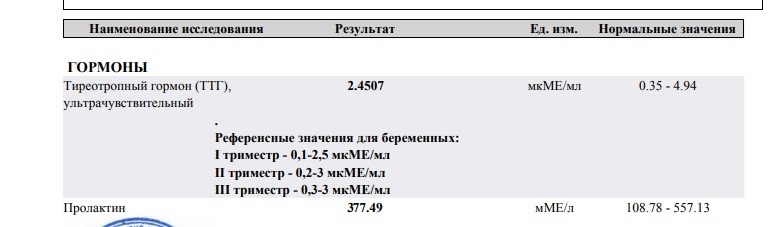 Изменения в гормональной системе, обмене веществ в первый триместр беременности прямо или косвенно стимулирует щитовидную железу женщины. В первый триместр беременности щитовидная железа плода ещё не функционирует (до 15 недели беременности) и высокая потребность в тиреоидных гормонах у плода, а именно правильное и качественное развитие плода, формирование его центральной нервной системы, щитовидной железы, других органов и систем, обеспечивается только за счет достаточного содержания гормонов матери, особенно в первый триместр беременности, когда происходит закладка органов плода. В целом продукция тиреоидных гормонов во время беременности в норме увеличивается до 50%.
Изменения в гормональной системе, обмене веществ в первый триместр беременности прямо или косвенно стимулирует щитовидную железу женщины. В первый триместр беременности щитовидная железа плода ещё не функционирует (до 15 недели беременности) и высокая потребность в тиреоидных гормонах у плода, а именно правильное и качественное развитие плода, формирование его центральной нервной системы, щитовидной железы, других органов и систем, обеспечивается только за счет достаточного содержания гормонов матери, особенно в первый триместр беременности, когда происходит закладка органов плода. В целом продукция тиреоидных гормонов во время беременности в норме увеличивается до 50%.
Даже после начала синтеза гормонов щитовидной железой плода во 2 половине беременности материнские гормоны своей роли не теряют.
Заболевания щитовидной железы матери могут оказывать существенное влияние на синтез тиреоидных гормонов железой матери и приводить к недостаточному или избыточному количеству их для плода.
Итак, согласно современным представлениям о влиянии патологии щитовидной железы на репродукцию, можно сформулировать несколько постулатов:
1.Во время беременности происходит изменение функционирования щитовидной железы матери.
2.Беременность является мощным фактором, стимулирующим щитовидную железу, что при определенных условиях может приобретать патологическое значение.
3.Для нормального развития плода, прежде всего на ранних этапах, необходим нормальный уровень гормонов щитовидной железы матери
4.Принципы диагностики и лечения заболеваний щитовидной железы у беременных существенно отличаются от стандартных лечебно-диагностических подходов
5.Как сниженная, так и повышенная функция щитовидной железы могут обусловить снижение репродуктивной способности у женщин и являются фактором риска нарушений развития плода.
6.Беременность может развиваться как на фоне гипотиреоза (сниженной функции ЩЖ), так и на фоне тиреотоксикоза (повышенной функции ЩЖ)
7. Показания для прерывания беременности у женщин с нарушениями функции щитовидной железы существенно ограничены.
Показания для прерывания беременности у женщин с нарушениями функции щитовидной железы существенно ограничены.
8.Показания для оперативного лечения патологии щитовидной железы во время беременности существенно ограничены.
9.Во время беременности проводится коррекция нарушенной функции щитовидной железы медикаментозными препаратами в соответствие с принятыми принципами лечения беременных.
Необходимые обследования.
В настоящее время обследование функции щитовидной железы у здоровых женщин не внесено в обязательные рекомендации для подготовки к беременности. Тем не менее существуют клинические рекомендации с хорошей степенью доказательности, принятые во всем мире, которые говорят о том, что лучшие условия для зачатия, вынашивания, развития плода существуют именно при определенных интервалах тиреоидных гормонов (ТТГ, Т4св) как до зачатия, так и во время беременности, особенно в 1 триместре.
Так, наилучший интервал ТТГ для зачатия находится в пределах 0,4-2,5 МЕД\л при нормальных значениях Т4св.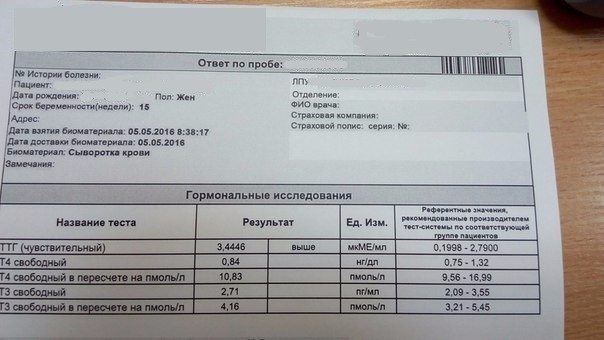 При выпадении ТТГ из необходимых интервалов, существует возможность подкорректировать содержание гормонов.
При выпадении ТТГ из необходимых интервалов, существует возможность подкорректировать содержание гормонов.
По законам физиологии ТТГ в 1 половине беременности должен снижаться, иногда достаточно сильно; уровень Т4 должен повышаться, иногда до верхней границы нормы. Во 2 половине беременности ТТГ выравнивается, повышается по сравнению с низким уровнем в 1 половине; Т4 может быть нормальным или низконормальным.
В последнее время изменились референсные интервалы (допустимое содержание) тиреоидных гормонов у беременных в 1, 2, 3 триместрах беременности, требуется консультация эндокринолога.
Иные подходы к женщинам, страдающих патологией щитовидной железы. Необходимо постоянное наблюдение и лечение у эндокринолога, контроль гормонов щитовидной железы с определенной регулярностью, которая зависит от вида заболевания.
Если вам назначили определение АТ/ТПО и выявлено их повышение, не следует бить тревогу. Так называемое «носительство АТ/ТПО» — распространенный феномен в популяции, определяется у здоровых женщин и далеко не всегда имеет прогностическое значение.
Тем не менее увеличение АТ/ТПО может быть диагностическим критерием хр. аутоиммунного тиреоидита, а также иметь прогностическое значение в развитие послеродового тиреоидита и гипотиреоза (сниженной функции щитовидной железы) в последующем, требуется консультация эндокринолога.
УЗИ щитовидной железы во время беременности не противопоказано.
Пункционная биопсия узлов щитовидной железы во время беременности не противопоказана в любом сроке беременности. Узлы с размером больше 1 см и с прогрессирующим ростом , особенно во время беременности, подлежат обязательной биопсии.
Фаустова Елена Вячеславовна,
врач эндокринолог высшей категории
Субклинический гипотиреоз и беременность | Шестакова Т.П.
Введение
Особое отношение к субклиническому гипотиреозу объясняется тем, что до настоящего времени не выработана однозначная тактика в отношении этого заболевания, особенно когда оно выявляется во время планирования или после наступления беременности. Многие вопросы или не изучены, или имеют противоречивые данные, так что врач принимает решение, основываясь на своих представлениях об этом заболевании. В последнее время опубликованы данные многочисленных исследований, метаанализов, посвященных этой теме. В связи с этим представляется актуальным рассмотреть некоторые вопросы, связанные с субклиническим гипотиреозом и беременностью, которые интересуют прежде всего практического врача.Ключевыми вопросами являются, во‑первых, критерии диагностики субклинического гипотиреоза во время беременности, которые неразрывно связаны с понятием нормы тиреотропного гормона (ТТГ) для беременных; во‑вторых, влияние субклинического гипотиреоза на фертильность женщины, течение и исходы беременности.

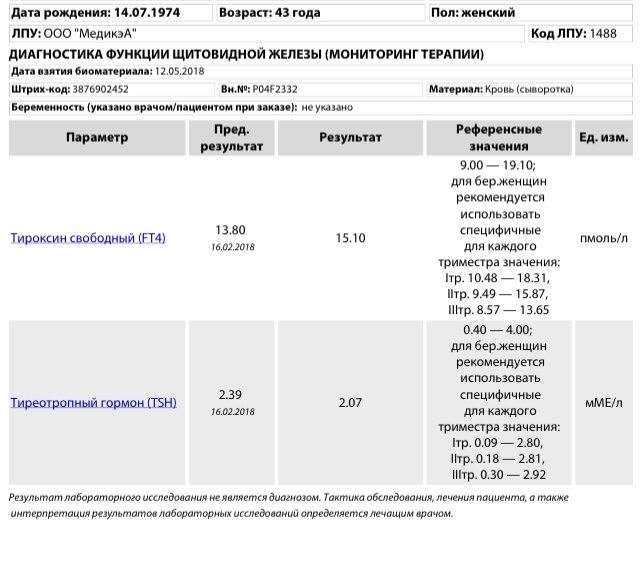
Нормы ТТГ при беременности
Прежде всего обсудим понятие нормы ТТГ для беременных женщин. Отличия от общей популяции обусловлены физиологическими изменениями тиреоидной функции во время беременности.Проникновение тиреоидных гормонов через плаценту к плоду, увеличение концентрации тиреоидсвязывающего
глобулина, сопровождающееся повышенным связыванием гормонов, и их повышенный распад в плаценте под воздействием дейодиназы 3-го типа диктуют увеличение синтеза тиреоидных гормонов в организме женщины. Для усиленного синтеза гормонов необходимо, чтобы щитовидная железа имела достаточно функциональных резервов и отсутствовал дефицит йода. Дополнительным стимулом для повышения функциональной активности щитовидной железы в I триместре беременности является плацентарный гормон — хорионический гонадотропин человека (ХГЧ), агонист ТТГ, способный взаимодействовать с его рецепторами. Около 8-й недели на пике секреции ХГЧ повышается синтез тиреоидных гормонов, которые по механизму отрицательной обратной связи подавляют выработку ТТГ, так что для I триместра типично снижение ТТГ, иногда ниже нормы.

В исследованиях показано, что уровень ТТГ и свободного Т4, но несвободного Т3, статистически значимо изменяется в разные сроки беременности, причем минимальный уровень ТТГ наблюдается в начале беременности, а минимальный уровень свободного Т4 — в конце беременности [2].
Нормальный уровень тиреоидных гормонов важен и для беременной женщины, и для плода, особенно в I триместре, когда собственная щитовидная железа плода еще не функционирует. Принимая во внимание физиологические изменения функции щитовидной железы во время беременности и важность сохранения нормального уровня тиреоидных гормонов для правильного формирования и роста плода, необходимо четко определить понятие нормы для беременной женщины, и эту норму сохранять на протяжении всей беременности. Кроме того, необходимо оценить оправданность медицинских вмешательств во время беременности, принимая во внимание не только здоровье женщины, но и здоровье ее будущего ребенка.

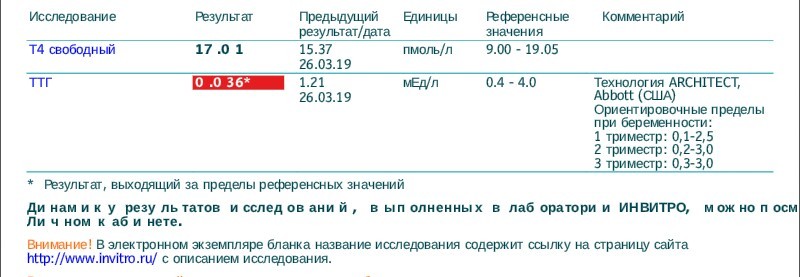
С 2011 г. в нашей стране, как и во многих других странах, использовались триместрспецифичные нормы ТТГ, рекомендуемые Американской тиреоидологической ассоциацией (АТА): для I триместра 0,1–2,5 мЕд/л, для II триместра — 0,2–3,0 мЕд/л и для III триместра — 0,3–3,0 мЕд/л. Необходимо заметить, что в рекомендациях АТА данные нормы предлагались только для лабораторий, которые по каким-либо причинам не имеют собственных установленных норм. Рекомендуемые референсные интервалы ТТГ основывались на результатах шести когортных исследований, проведенных в США и некоторых странах Европы, в которых было показано, что в I триместре уровень ТТГ у беременных значительно ниже, чем во II и III триместрах [3].
Однако использование такой нормы приводило во многих странах к очень высокой распространенности субклинического гипотиреоза. Так, при использовании в качестве верхней границы нормы ТТГ для I триместра 2,5 мЕд/л в одном исследовании, проведенном в Китае, субклинический гипотиреоз выявлялся у 27,8% беременных, в некоторых районах Испании у 37%, а в Чехии у 21% [4–6].

В связи с этим во многих странах Азии и Европы были проведены исследования по определению собственных норм ТТГ. При суммировании данных этих исследований было показано, что уровень ТТГ у беременных без патологии щитовидной железы, проживающих в различных регионах, значительно отличается. В I триместре верхняя граница нормальных показателей ТТГ находится в интервале от 2,15 до 4,68 мЕд/л. При использовании региональных норм ТТГ частота гипотиреоза значительно снижалась и составила в среднем около 4% [7, 8].
Надо заметить, что более высокая, чем 2,5–3,0 мЕд/л, верхняя граница нормы ТТГ была выявлена не только в странах Азии, таких как Индия, Южная Корея, Китай [4, 9], но и в некоторых странах Европы, например Нидерландах, Чехии, Испании [10–12]. Эти отличия могут объясняться этническими особенностями, а также обеспеченностью йодом региона, в котором проводится исследование, и распространенностью носительства антитиреоидных антител [13].
Учитывая накопленные данные, рекомендации АТА вышли в 2017 г.
 с некоторыми изменениями. По-прежнему предпочтительным является использование нормы ТТГ для беременных, определенной в данной популяции с учетом места проживания. Но если такие нормы не могут быть определены по каким-либо причинам, то рекомендуется использовать обычно применяемые в данной популяции референсные значения [14]. Однако в этом случае не учитываются физиологические изменения ТТГ, особенно в I триместре беременности. В исследовании, проведенном в Нидерландах, показано, что при использовании общепопуляционных норм ТТГ невозможно выявить вовремя всех беременных со сниженной функцией щитовидной железы, что сказывается на исходах беременности [15]. В связи с этим целесообразно снизить обычно используемую верхнюю границу нормы ТТГ на 0,5 мЕд/л, что также учтено в последних рекомендация АТА [14].
с некоторыми изменениями. По-прежнему предпочтительным является использование нормы ТТГ для беременных, определенной в данной популяции с учетом места проживания. Но если такие нормы не могут быть определены по каким-либо причинам, то рекомендуется использовать обычно применяемые в данной популяции референсные значения [14]. Однако в этом случае не учитываются физиологические изменения ТТГ, особенно в I триместре беременности. В исследовании, проведенном в Нидерландах, показано, что при использовании общепопуляционных норм ТТГ невозможно выявить вовремя всех беременных со сниженной функцией щитовидной железы, что сказывается на исходах беременности [15]. В связи с этим целесообразно снизить обычно используемую верхнюю границу нормы ТТГ на 0,5 мЕд/л, что также учтено в последних рекомендация АТА [14].Таким образом, учитывая накопленные данные и последние рекомендации АТА, в настоящее время рекомендуется использовать либо нормы для беременных, определенные в данной этнической группе с учетом региона проживания, либо обычно используемые популяционные нормы со сниженной верхней границей на 0,5 мЕд/л.
К сожалению, в России в настоящее время нет национальных клинических рекомендаций по диагностике и лечению заболеваний щитовидной железы во время беременности. В такой ситуации каждый врач основывается на доступных ему информационных ресурсах. На известном в России и пользующeмся большой популярностью у врачей интернет-ресурсе «Тиронет.ру» в клинических рекомендациях, основанных на предыдущей версии рекомендаций АТА, уровень ТТГ
Влияние субклинического гипотиреоза на фертильность, течение и исходы беременности
Чтобы определить показания для лечения субклинического гипотиреоза, необходимо учитывать влияние различного уровня ТТГ на течение беременности и ее исходы. К сожалению, не во всех исследованиях выделяют группы беременных с разной степенью повышения ТТГ и учитывают титр антитиреоидных антител, которые также влияют на течение беременности. В исследовании N. Benhadi [17] выявлена положительная корреляция между уровнем ТТГ, начиная с нормальных показателей, и самопроизвольным прерыванием беременности: при каждом удвоении ТТГ вероятность выкидыша увеличивалась на 80%.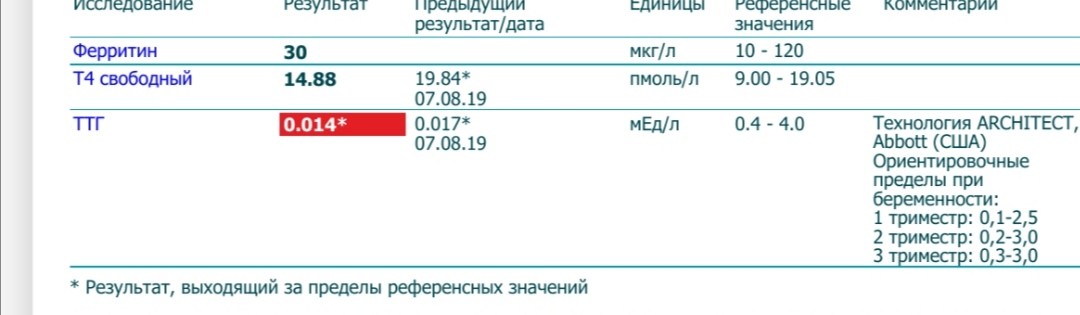 Повышение ТТГ в интервале 2,5–5,0 мЕд/л у женщин без антитиреоидных антител сопровождается повышением риска выкидыша примерно в 2 раза, причем как на ранних, так и на поздних сроках беременности [18, 19].
Повышение ТТГ в интервале 2,5–5,0 мЕд/л у женщин без антитиреоидных антител сопровождается повышением риска выкидыша примерно в 2 раза, причем как на ранних, так и на поздних сроках беременности [18, 19].Надо заметить, что влияние субклинического гипотиреоза на вынашивание беременности возрастает при использовании локальных норм ТТГ. Исследование, проведенное в Австралии, показало, что риск выкидыша увеличивается в 3,66 раза при ТТГ>95 персентиля на ранних сроках беременности, хотя ТТГ>95 персентиля объединяет субклинический и манифестный гипотиреоз, что может сказываться на результатах исследования [20].
Риски самопроизвольного прерывания беременности увеличиваются при сочетании повышенного ТТГ и высокого титра антител к тиреопероксидазе (ТПО). В исследовании C. Lopez-Tinoco et al. [21] было продемонстрировано, что наличие антител к ТПО у беременных с субклиническим гипотиреозом повышает риск прерывания беременности более чем в 10 раз. Похожие данные получили исследователи из Китая.
 Наибольший риск выкидыша был выявлен в группе беременных с субклиническим гипотиреозом (ТТГ 5–10 мЕд/л) и повышенным титром антител к ТПО (отношение шансов (ОШ) 9,56; p2,5 мЕд/л и высоком титре антитиреоидных антител.
Наибольший риск выкидыша был выявлен в группе беременных с субклиническим гипотиреозом (ТТГ 5–10 мЕд/л) и повышенным титром антител к ТПО (отношение шансов (ОШ) 9,56; p2,5 мЕд/л и высоком титре антитиреоидных антител.Однако не во всех исследованиях подтверждено негативное влияние ТТГ>2,5 мЕд/л на течение беременности. Так, в исследовании H. Liu [22] статистически значимых различий в частоте прерывания беременности в группах беременных с ТТГ
В Кокрановском обзоре проведено сравнение исходов беременности при тотальном скрининге на тиреоидную дисфункцию и скрининге на основании факторов риска. При ТТГ>2,5 мЕд/л беременным проводилась заместительная терапия левотироксином. В группе универсального скрининга гораздо чаще выявлялся гипотиреоз (ОШ 3,15) и чаще назначалась фармакотерапия, но, несмотря на лучшее выявление гипотиреоза в группе тотального скрининга, различий по осложнениям беременности и ее исходам не выявлено. Авторы сделали вывод, что тотальный скрининг не улучшает исходов беременности [23].
 Однако нельзя исключить в данном исследовании влияния массы, т. к. здоровые беременные значительно превосходили числом больных гипотиреозом в обеих группах.
Однако нельзя исключить в данном исследовании влияния массы, т. к. здоровые беременные значительно превосходили числом больных гипотиреозом в обеих группах.Противоречивые данные получены при исследовании ассоциации субклинического гипотиреоза и преждевременных родов. В исследовании Casey et al. [24] выявлена связь субклинического гипотиреоза и родов ранее 34 нед. гестации, но при этом такой связи не обнаружено для сроков менее 32 или менее 36 нед. В дальнейшем в подобных исследованиях получены противоречивые данные, обусловленные отчасти объединением в одну группу беременных с субклиническим и манифестным гипотиреозом, а также включением в исследование беременных с антитиреоидными антителами.
Как было показано T. Korevaar et al. [25], осложненное течение беременности зависит от степени повышения ТТГ. Беременные были разделены на группы в зависимости от уровня ТТГ: 2,5–4,0 мЕд/л или более 4,0 мЕ/л. При ТТГ ниже 4,0 мЕд/л не выявлено повышения частоты преждевременных родов, тогда как при ТТГ>4,0 мЕд/л риск родов ранее 37 нед.
 повышался в 1,9 раза, а ранее 34 нед. — в 2,5 раза. Но первичный анализ проводился без учета титра антител к ТПО. При исключении из анализа беременных с повышенными антителами к ТПО разница между группами исчезла, и даже изолированное повышение ТТГ>4 мЕд/л не влияло на частоту преждевременных родов. Данное исследование еще раз продемонстрировало важность разграничения беременных с нормальным и повышенным титром антител к ТПО, т. к. они являются самостоятельным фактором риска осложненного течения беременности.
повышался в 1,9 раза, а ранее 34 нед. — в 2,5 раза. Но первичный анализ проводился без учета титра антител к ТПО. При исключении из анализа беременных с повышенными антителами к ТПО разница между группами исчезла, и даже изолированное повышение ТТГ>4 мЕд/л не влияло на частоту преждевременных родов. Данное исследование еще раз продемонстрировало важность разграничения беременных с нормальным и повышенным титром антител к ТПО, т. к. они являются самостоятельным фактором риска осложненного течения беременности.Влияние субклинического гипотиреоза на развитие ассоциированной с беременностью гипертензии и преэклампсии представляется на данный момент сомнительным. Ранее в когортных исследованиях выявлялась ассоциация субклинического гипотиреоза и преэклампсии, но только если скрининг на гипотиреоз проводился на поздних сроках беременности. Если же функция щитовидной железы исследовалась до 20 нед. беременности, то никакой зависимости не выявлялось [26, 27]. Предполагается, что на начальных стадиях развития преэклампсии плацентой могут вырабатываться факторы, влияющие на функцию щитовидной железы [28].
 При повышенном ТТГ (>2,15 мЕд/л) в I триместре беременности не выявлено увеличения частоты осложнений беременности, в т. ч. преэклампсии, развивающихся после 20 нед. [29].
При повышенном ТТГ (>2,15 мЕд/л) в I триместре беременности не выявлено увеличения частоты осложнений беременности, в т. ч. преэклампсии, развивающихся после 20 нед. [29].При изучении умеренно повышенного ТТГ, от 2,5 мЕд/л до 97,5 персентиля, и популяционной нормы было выявлено повышение частоты преэклампсии только у беременных с высоконормальным свободным Т4, у остальных высоконормальный уровень ТТГ не влиял на частоту преэклампсии [11]. Однако в некоторых исследованиях все же выявлялась ассоциация между повышенным ТТГ и повышенным артериальным давлением во время беременности. Так, например, в исследовании L. M. Chen [30] выявлены повышенный риск гестационной гипертензии, а также маленькая масса тела плода у беременных с субклиническим гипотиреозом. То есть на первый взгляд были получены диаметрально противоположные результаты. Но в данном исследовании субклинический гипотиреоз диагностировался при ТТГ>3,47 мЕд/л, который был определен как верхняя граница нормы в данной лаборатории, что значительно выше, чем 2,5 мЕд/л.
 Вероятно, именно применяемый для диагностики субклинического гипотиреоза уровень ТТГ сказывается на результатах исследования его влияния на течение беременности.
Вероятно, именно применяемый для диагностики субклинического гипотиреоза уровень ТТГ сказывается на результатах исследования его влияния на течение беременности.Обычно при противоречивых данных применяется метод метаанализа для выявления истины. Недавно проведенный метаанализ 18 когортных исследований показал, что субклинический гипотиреоз ассоциируется с несколькими неблагоприятными исходами беременности, такими как выкидыш (ОШ 2,01; 95% доверительный интервал (ДИ) 1,6–2,44), плацентарная недостаточность (ОШ 2,14; 95% ДИ 1,23–3,7) и повышенная неонатальная смертность (ОШ 2,58; 95% ДИ 1,41–4,73). Ассоциации с другими неблагоприятными исходами, как, например, преэклампсия, не выявлено [31]. Надо заметить, что исследования, включенные в метаанализ, применяли различные пороговые значения ТТГ для диагностики субклинического гипотиреоза. Только в 6 из 18 исследований пороговым значением ТТГ являлся уровень 2,15–2,5 мЕд/л. Причем в три исследования включались беременные с ТТГ≥2,5 мЕд/л и нормальным уровнем свободного Т4.
 То есть степень повышения ТТГ могла быть различной, от 2,5 до 10 мЕд/л. А как мы видим по другим исследованиям, различная степень повышения ТТГ оказывает неодинаковое влияние на исходы беременности. В большинстве исследований метаанализа субклинический гипотиреоз диагностировался при ТТГ>3,5 мЕд/л. А это как раз рекомендуемая сегодня верхняя граница нормы ТТГ для беременных, если использовать модифицированные общепопуляционные нормы.
То есть степень повышения ТТГ могла быть различной, от 2,5 до 10 мЕд/л. А как мы видим по другим исследованиям, различная степень повышения ТТГ оказывает неодинаковое влияние на исходы беременности. В большинстве исследований метаанализа субклинический гипотиреоз диагностировался при ТТГ>3,5 мЕд/л. А это как раз рекомендуемая сегодня верхняя граница нормы ТТГ для беременных, если использовать модифицированные общепопуляционные нормы.Влияния ТТГ от 2,5 до 4 мЕд/л на психоневрологическое развитие плода и другие показатели здоровья плода не выявлено [31, 32].
Учитывая полученные в настоящее время данные, можно считать, что ТТГ>2,5 мЕд/л ассоциирован с самопроизвольным прерыванием беременности. Другие неблагоприятные исходы беременности связаны с более высоким пороговым значением ТТГ. Особого внимания заслуживают беременные с повышенным ТТГ и антитиреоидными антителами. В этом случае неблагоприятное влияние на течение беременности увеличивается.
Но необходимо понимать, изменится ли ситуация к лучшему, если компенсировать функцию щитовидной железы при субклиническом гипотиреозе у беременных.
 Многие исследователи поддерживают идею лечения, т. к. оно довольно безопасно и может оказать положительное воздействие на вынашивание беременности [32]. Исходы беременности у женщин, принимавших левотироксин натрия по поводу манифестного или субклинического (ТТГ>2,5 мЕд/л) гипотиреоза, и эутиреоидных женщин не различались. А это свидетельствует о безопасности лечения левотироксином натрия, во всяком случае относительно беременности [33].
Многие исследователи поддерживают идею лечения, т. к. оно довольно безопасно и может оказать положительное воздействие на вынашивание беременности [32]. Исходы беременности у женщин, принимавших левотироксин натрия по поводу манифестного или субклинического (ТТГ>2,5 мЕд/л) гипотиреоза, и эутиреоидных женщин не различались. А это свидетельствует о безопасности лечения левотироксином натрия, во всяком случае относительно беременности [33].Назначение левотироксина натрия беременным с ТТГ выше нормы, определенной в локальной лаборатории, приводил к суммарному снижению осложнений беременности. Причем эффект зависел от сроков начала лечения и времени, затраченного на достижение целевого уровня ТТГ.
Частота осложнений уменьшалась, если лечение начиналось до 12 нед. беременности и цель лечения достигалась менее чем за 4 нед. [34].
В исследовании S. Maraka et al. [35] показано, что назначение заместительной терапии при ТТГ 2,5–5 мЕд/л снижает риск внутриутробной задержки развития плода и низкой балльной оценки состояния плода при рождении по шкале Апгар.
 По другим исходам беременности, в т. ч. самопроизвольному прерыванию беременности, отличий не выявлено.
По другим исходам беременности, в т. ч. самопроизвольному прерыванию беременности, отличий не выявлено.В других исследованиях положительный эффект от лечения левотироксином выявлялся только в группах беременных с ТТГ>4,0–5,0 мЕд/л. При этом в одном исследовании показано значительное снижение частоты преждевременных родов (ОШ 0,38; 95% ДИ 0,15–0,98). У беременных с ТТГ 2,5–4,0 мЕд/л назначение заместительной терапии не улучшало исходов беременности [36–38].
Таким образом, в настоящее время положительное влияние заместительной терапии левотироксином натрия при уровне ТТГ 2,5–4,0 мЕд/л, особенно при нормальном уровне антитиреоидных антител, не доказано. Вместе с тем при более выраженном повышении ТТГ положительное влияние лечения не вызывает сомнения. Возможно, положительное влияние проявляется только при использовании локальных норм ТТГ, что увеличивает важность их определения.
Основываясь на последних данных, можно сделать вывод, что во время беременности для принятия решения о назначении лечения левотироксином натрия лучше использовать локальные нормы ТТГ.
 При отсутствии локальных норм, либо при ТТГ>2,5 мЕд/л у беременных с антитиреоидными антителами, либо ТТГ>3,5 мЕд/л у женщин без антител назначение заместительной терапии как минимум снижает вероятность самопроизвольного прерывания беременности, а возможно, имеет и другие положительные влияния, особенно если инициируется на ранних сроках беременности.
При отсутствии локальных норм, либо при ТТГ>2,5 мЕд/л у беременных с антитиреоидными антителами, либо ТТГ>3,5 мЕд/л у женщин без антител назначение заместительной терапии как минимум снижает вероятность самопроизвольного прерывания беременности, а возможно, имеет и другие положительные влияния, особенно если инициируется на ранних сроках беременности.Субклинический гипотиреоз и фертильность
Важный вопрос — каково влияние субклинического гипотиреоза на фертильность женщины. И этот вопрос порождает еще два: 1) при каком уровне ТТГ необходимо начинать лечение при планировании беременности
и 2) каков целевой уровень ТТГ на стадии планирования беременности.
При выявлении у женщины на стадии планирования беременности ТТГ более общепопуляционной нормы назначение лечения не вызывает сомнения. Сложнее решить вопрос о необходимости лечения при нормальновысоком уровне ТТГ. В последнее время появляется все больше данных о влиянии умеренно повышенного ТТГ на фертильность. Действительно, было установлено, что при бесплодии у женщины уровень ТТГ выше, чем в группе контроля, особенно если причиной бесплодия являлась дисфункция яичников либо причина была неизвестна. [39]. В одном из исследований назначение левотироксина натрия бесплодным женщинам с ТТГ>3 мЕд/л у 84,1% женщин сопровождалось наступлением беременности, причем у части женщин — самопроизвольной [40]. Но в более ранних исследованиях не выявлено ассоциации повышенного ТТГ и сниженной фертильности у женщин [41]. Выявленный однократно повышенный уровень ТТГ>2,5 мЕд/л на стадии планирования беременности может самостоятельно снизиться после наступления беременности. В одном малочисленном исследовании показано, что у 50% беременных с ТТГ>3 мЕд/л на стадии планирования после наступления беременности уровень ТТГ самостоятельно нормализовался и стал менее 2,5 мЕд/л. К сожалению, в данном исследовании не изучались различия между группами с повышенным и нормальным после наступления беременности уровнем ТТГ [42].
Действительно, было установлено, что при бесплодии у женщины уровень ТТГ выше, чем в группе контроля, особенно если причиной бесплодия являлась дисфункция яичников либо причина была неизвестна. [39]. В одном из исследований назначение левотироксина натрия бесплодным женщинам с ТТГ>3 мЕд/л у 84,1% женщин сопровождалось наступлением беременности, причем у части женщин — самопроизвольной [40]. Но в более ранних исследованиях не выявлено ассоциации повышенного ТТГ и сниженной фертильности у женщин [41]. Выявленный однократно повышенный уровень ТТГ>2,5 мЕд/л на стадии планирования беременности может самостоятельно снизиться после наступления беременности. В одном малочисленном исследовании показано, что у 50% беременных с ТТГ>3 мЕд/л на стадии планирования после наступления беременности уровень ТТГ самостоятельно нормализовался и стал менее 2,5 мЕд/л. К сожалению, в данном исследовании не изучались различия между группами с повышенным и нормальным после наступления беременности уровнем ТТГ [42].
В более крупном исследовании с участием 482 женщин, прошедших процедуру экстракорпорального оплодотворения (ЭКО), оценивалась вероятность наступления
и сохранения беременности в зависимости от исходного ТТГ. У 55% беременных после наступления беременности ТТГ снизился с исходного уровня 2,5–4,0 мЕд/л до 2,5 мЕд/л. Наступление беременности не зависело от исходного уровня ТТГ. Авторы сделали вывод, что лечение при повышении ТТГ от 2,5 до 4,0 мЕд/л может быть отложено до наступления беременности, когда данный уровень будет подтвержден [43].
С другой стороны, в популяционном исследовании, проведенном в Китае, выявлена зависимость исходов самопроизвольно наступившей беременности от уровня ТТГ, определенного в пределах 6 мес. до наступления беременности. У женщин с ТТГ 2,5–4,28 мЕд/л при сравнении с женщинами с ТТГ ниже 2,5 мЕд/л (0,48–2,49 мЕд/л) выявлено незначительное, но все же статистически значимое повышение частоты самопроизвольных выкидышей (ОШ 1,1) и преждевременных родов
(ОШ 1,09). Более тяжелые осложнения беременности, такие как перинатальная смертность, внутриутробная гибель плода, кесарево сечение, наблюдались лишь при уровне ТТГ>4,0 мЕд/л [44].
Более тяжелые осложнения беременности, такие как перинатальная смертность, внутриутробная гибель плода, кесарево сечение, наблюдались лишь при уровне ТТГ>4,0 мЕд/л [44].
Во многих исследованиях оценивается влияние субклинического гипотиреоза и его лечения на результативность различных вспомогательных репродуктивных технологий (ВРТ). Особое внимание к данной группе женщин объясняется использованием в процессе стимуляции высоких доз эстрогенов, которые могут проявить компенсированную тиреоидную недостаточность. Не выявлено негативного влияния уровня ТТГ от 2,5 до 4,9 мЕд/л на результаты инсеминации. В одном исследовании у эутиреоидных женщин выявлена обратная ассоциация между уровнем ТТГ на момент наступления беременности и частотой самопроизвольных выкидышей [45]. В другом подобном исследовании не обнаружено связи повышенного уровня антитиреоидных антител и/или ТТГ>2,5 мЕд/л на частоту родов у женщин после инсеминации [46], хотя в ретроспективном исследовании результативность инсеминации повышалась при назначении заместительной терапии женщинам с уровнем ТТГ>2,5 мЕд/л [47].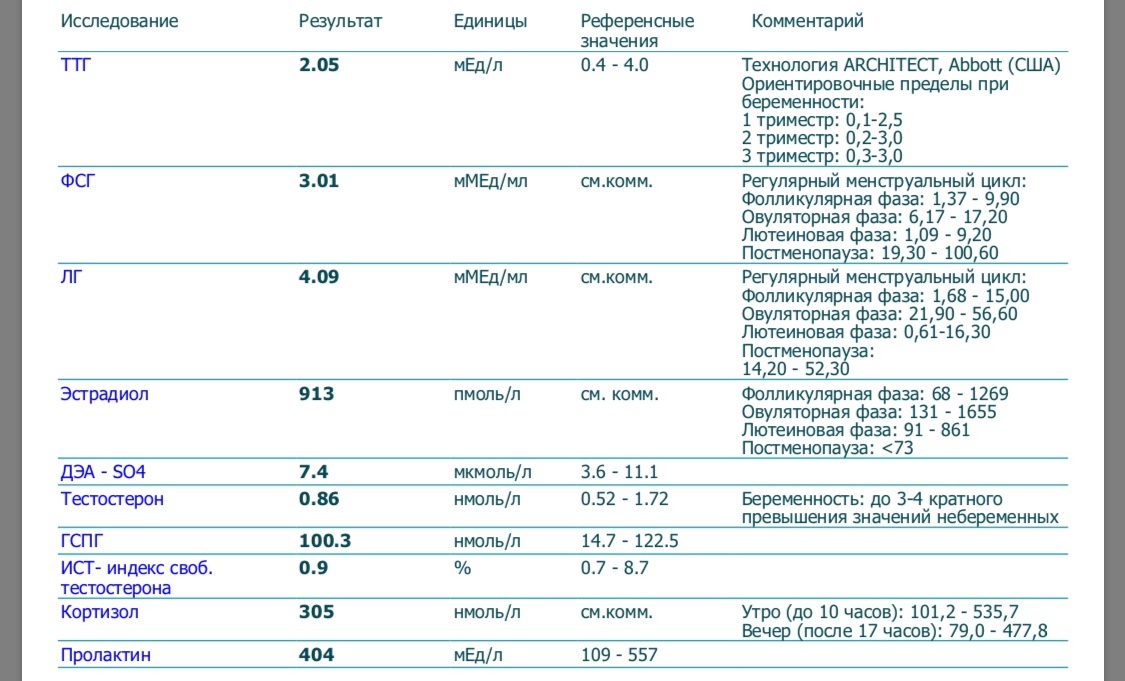 Результативность ЭКО при уровне ТТГ<2,5 мЕд/л была даже выше и качество эмбрионов было выше, чем у женщин с более высоким ТТГ [48–50].
Результативность ЭКО при уровне ТТГ<2,5 мЕд/л была даже выше и качество эмбрионов было выше, чем у женщин с более высоким ТТГ [48–50].
Но не во всех исследованиях получены одинаковые данные. Так, M. Aghahosseini et al. [51] не выявили статистически значимых различий в частоте наступления беременности в результате ВРТ в зависимости от уровня ТТГ. В проспективном исследовании показано, что назначение заместительной терапии женщинам с субклиническим гипотиреозом (ТТГ 4,2–20,0 мЕд/л и свободный Т4 в норме) перед проведением ЭКО улучшает его исходы и они сопоставимы с эутиреоидными женщинами. Но речь в данном исследовании идет об уровне ТТГ выше популяционной нормы, но не о высоконормальном ТТГ. После назначения заместительной терапии различий по исходам беременности в зависимости от целевого уровня ТТГ (0,5–2,5 или 2,5–4,0 мЕ/л) не получено, достаточно только его нормализации [52].
Таким образом, назначение заместительной терапии на стадии планирования беременности, в т.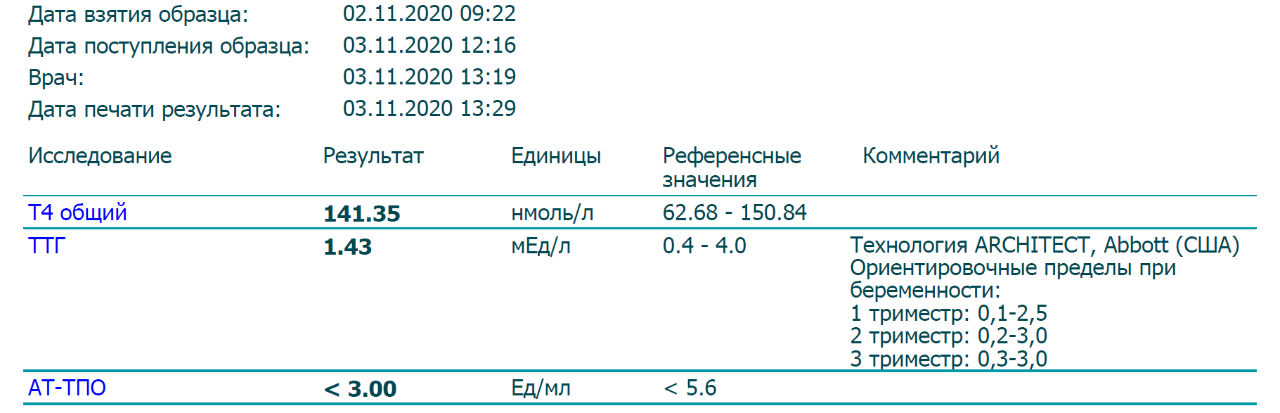 ч. женщинам, планирующим проведение ВРТ, показано только при повышении уровня ТТГ выше общепопуляционной нормы. Использование на этом этапе нормативов для беременных не оправданно.
ч. женщинам, планирующим проведение ВРТ, показано только при повышении уровня ТТГ выше общепопуляционной нормы. Использование на этом этапе нормативов для беременных не оправданно.
Интересен также вопрос об отдаленных рисках женщин с субклиническим гипотиреозом, выявленным во время беременности. В исследовании, проведенном в Индии, показано, что через 2 года после беременности у 17,8% женщин развился гипотиреоз субклинический или манифестный. Факторами риска заболевания был возраст (23,6–25,5 года), зоб, степень повышения ТТГ во время беременности (7,9–5,1 мЕд/л), повышенный титр антител к ТПО [53]. Такими образом, при наличии таких факторов риска следует проводить периодическое обследование на гипотиреоз, частота обследований, однако, не определена.
Заключение
Накопленные на сегодняшний день данные подтверждают необходимость определения локальной нормы ТТГ для беременных. При решении вопроса о назначении лечения во время беременности необходимо учитывать не только повышенный уровень ТТГ, но и уровень антител к ТПО, т. к. именно у этой группы беременных имеется наибольший риск осложненного течения беременности. На стадии планирования беременности лечение при превышении ТТГ общепопуляционных референсных значений обязательно. Но не доказано преимущество заместительной терапии у женщин, планирующих беременность, в т. ч. с помощью репродуктивных технологий, с высоконормальным уровнем ТТГ.
к. именно у этой группы беременных имеется наибольший риск осложненного течения беременности. На стадии планирования беременности лечение при превышении ТТГ общепопуляционных референсных значений обязательно. Но не доказано преимущество заместительной терапии у женщин, планирующих беременность, в т. ч. с помощью репродуктивных технологий, с высоконормальным уровнем ТТГ.
.
ТТГ (тиреотропный гормон) в медицинском центре «Мать и Дитя»
Тиреотропный гормон (ТТГ) – гликопротеин, вырабатываемый клетками передней доли гипофиза. Он является важным элементом системы обмена веществ и управляет функциями щитовидной железы, поэтому ТТГ называют регулирующим гормоном.
Роль и значение ТТГ в организмеТиреотропин регулирует активность тиреоидных гормонов – трийодтиронина (Т3) и тироксина (Т4). Все они тесно связаны по типу обратной связи. Недостаток Т3 и Т4 стимулирует выработку ТТГ, а их избыток угнетает синтез тиреотропина. Кроме регулирующей функции, тиреотропный гормон:
Кроме регулирующей функции, тиреотропный гормон:
- контролирует поступление йода в ткани щитовидной железы;
- стимулирует процесс расщепления жиров;
- ускоряет образование в организме белков, фосфолипидов, ДНК и РНК.
При нарушении выработки ТТГ ткани щитовидной железы разрастаются, железа увеличивается в размере, и эту патологию называют зобом. При этом функция гипертрофированной железы нарушается, что влияет на обменные процессы во всем организме.
Для определения уровня гормона ТТГ проводят анализ крови. Количество гормона измеряется в мЕд\л и варьирует в зависимости от возраста, времени суток, состояния, вида употребляемых лекарств.
Показания к назначению анализовОснованием для назначения анализа на ТТГ является:
- подозрение на дисфункцию щитовидной железы;
- бесплодие у мужчин или ослабление потенции;
- лечение с помощью гормонзаместительной терапии;
- заболевания сердца;
- облысение;
- нарушение менструального цикла у женщин;
- депрессивное состояние;
- миопатия – патология мышечной ткани;
- задержка физического и умственного развития у детей и др.

Анализ на ТТГ, как правило, проводят с одновременным исследованием содержания в крови гормонов щитовидной железы, для того чтобы получить полную картину функции и состояния «щитовидки». Когда сдавать анализ, определяет опытный эндокринолог, так как некоторые состояния, например, беременность, время суток, состояния после оперативного вмешательства могут влиять на уровень гормонов щитовидной железы и ТТГ.
Подготовка и проведение анализаАнализ на ТТГ можно сдавать в любой лаборатории, принимающей кровь на анализ – в поликлинике по месту жительства или в частной лаборатории медицинского центра, в ведомственном медучреждении. Перед тем, как отправиться на исследования уровня гормона ТТГ, необходимо предварительно подготовиться. Подготовка должна начаться заранее и состоять из следующих правил:
- за 2-3 дня до того, как сдавать кровь нужно исключить прием лекарственных препаратов (после согласования с врачом), высокие физические нагрузки, избегать стрессов;
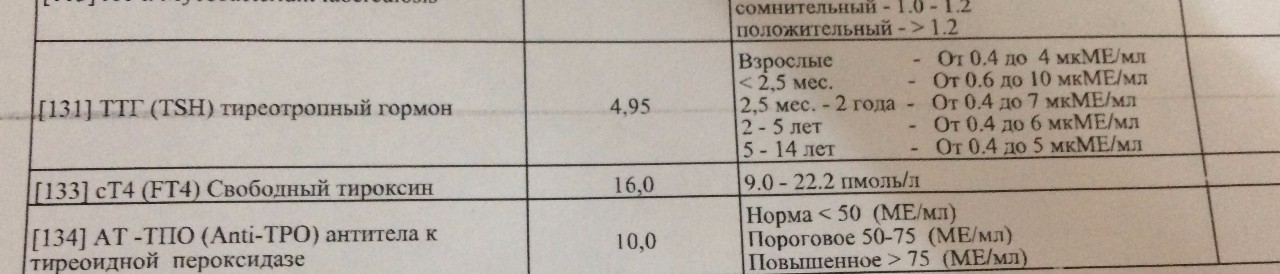
- исключить прием алкоголя, курение, воздействие низких или высоких температур на организм;
- анализ крови сдают натощак, поэтому за 12 часов до назначенного времени не стоит принимать пищу, ограничиться только водой;
- анализ сдают утром (8-11 часов) из-за наличия циркадных ритмов в синтезе гормона.

Несоблюдение перечисленных правил подготовки к сдаче анализа крови негативно отразится на его результате.
После подготовки сотрудник лаборатории берет кровь из вены для проведения анализа. Если у человека уже проводился подобный анализ, и результат исследований был выше нормы, то необходимо проводить контроль уровня ТТГ дважды в год.
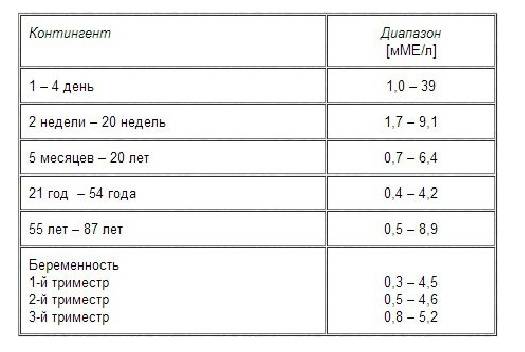
Норма ТТГ указана в бланке анализа и можно самостоятельно сравнить полученный результат с референсными значениями, но расшифровку должен провести специалист. Норма ТТГ зависит от возраста и состояния, поэтому референсные значения различаются:
| Референсные значения уровня ТТГ в разных возрастных группах (мЕд/л) | |
| У детей | |
| новорожденных | 1,1-17,0 |
| 1-2,5 мес | 0,6-10,0 |
| 2,5-14 мес | 0,4-7,0 |
| 14 мес. – 5 лет | 0,4-6,0 |
| 5-14 лет | 0,4-5,0 |
| старше 14 лет | 0,4-4,0 |
| У женщин | |
| Половозрелого возраста | 0,4-4,0 |
| При беременности: | |
| 1 триместр | 0,1-0,4 |
| 2 триместр | 0,3-2,8 |
| 3 триместр | 0,4-3,5 |
| У мужчин | |
| Половозрелого возраста | 0,29-4,9 |
На показатели ТТГ при беременности влияет даже количество плодов. Так при многоплодной беременности уровень гормона снижается обязательно, а при одноплодной – в ¼ случаев.
Так при многоплодной беременности уровень гормона снижается обязательно, а при одноплодной – в ¼ случаев.
Если уровень ТТГ повышен, то это может указывать на ряд патологий в организме, например:
- состояние после резекции желчного пузыря;
- беременность;
- нарушение функции надпочечников;
- резистентность (устойчивость) к гормонам щитовидной железы;
- новообразование в гипофизе;
- дисфункция ЦНС;
- тиреоидит Хашимото.
Высокий уровень ТТГ может свидетельствовать о нарушении правил подготовки к анализу. Низкий уровень гормона может быть вызван строгой диетой, голоданием, стрессом, воспалительным процессом.
Если уровень тиреотропина понижен, то это может свидетельствовать о:
- нарушении структуры щитовидки – новообразование, гиперплазия;
- психических заболеваниях;
- токсикоинфекции или травме железы;
- нарушении дозы гормональных препаратов;
- некрозе клеток после гестоза.

Расшифровка результата должна проводиться только специалистом, так как причины дисбаланса могут быть различны и должны рассматриваться в совокупности симптомов и признаков.
Стоимость анализаВ зависимости от региона, уровня медицинского учреждения и количества исследуемых гормонов формируется цена на услугу. Можно предварительно провести мониторинг цен на исследование ТТГ по опубликованным на сайтах лабораторий прейскурантам. Сколько стоит анализ, лучше узнавать непосредственно в лаборатории, так как многие частные учреждения применяют систему скидок, бонусов и программу кредитования.
Повышенный ТГГ во время беременности, каких последствий ожидать?
Актуальность
Известно, что нелеченый гипотиреоз отрицательно сказывается на беременности, однако как влияет слегка повышенный уровень тиреотропного гормона (ТТГ) на акушерские и перинатальные исходы не до конца ясно.
Американские коллеги изучили влияние повышенного уровня ТТГ на исходы беременности в ретроспективном анализе.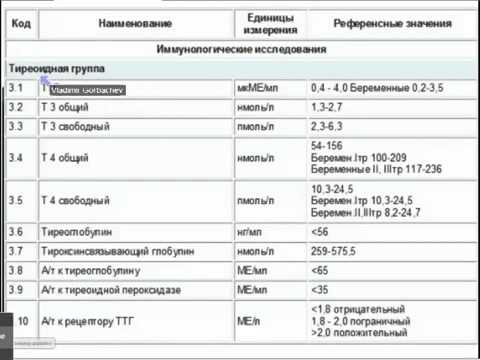
Дизайн исследования
В ретроспективный анализ вошли 8413 беременных женщин в возрасте 18 лет и старше, которые наблюдались в медицинском центре Бостона Речь шла о женщинах с одноплодной беременностью и отсутствием заболеваний щитовидной железы.
Результаты
- Средний возраст женщин составил 29 лет, средний гестационный возраст детей 38,5 недели, средний вес при рождении 3155 г.
- Уровень ТТГ рассматривался как повышенный при показателе >4 мЕд/л.
- Средний уровень ТТГ у беременных составил 1,06 мЕд/л, у 130 женщин (1,6%) уровень ТТГ был выше 4 мЕд/л.
- Показано, что у детей, матери которых имели повышенный уровень ТТГ, был выше в 2 раза риск родиться недоношенными (относительный риск, 2,17, [95% доверительный интервал (ДИ) 1.15-4.07, P=0,016) и выше практически в 3 раза риск развития неонатального респираторного дистресс-синдрома (относительный риск, 2.83, 95% ДИ 1,02-7,86, P=0.
 046).
046). - Отмечено повышение относительного риска потери плода, преэклампсии/эклампсии и низкого веса при рождении при уровне материнского ТТГ >4 мЕд/л, однако различие не достигло статистической значимости.
- Повышение уровня ТТГ выше 4 мЕд/л не было ассоциировано с отслойкой плаценты, кесаревым сечением, гестационной гипертензией или диабетом или необходимостью в госпитализации новорожденных в отделение интенсивной терапии.
Заключение
Материнский уровень ТТГ выше 4 мЕд/л ассоциирован с повышением в 2 раза риска недоношенности и неонатального респираторного дистресс-синдрома.
Источник: Lee SY et al. Associations between maternal thyroid function in pregnancy and obstetric and perinatal outcomes. The Journal of Clinical Endocrinology & Metabolism, dgz275,
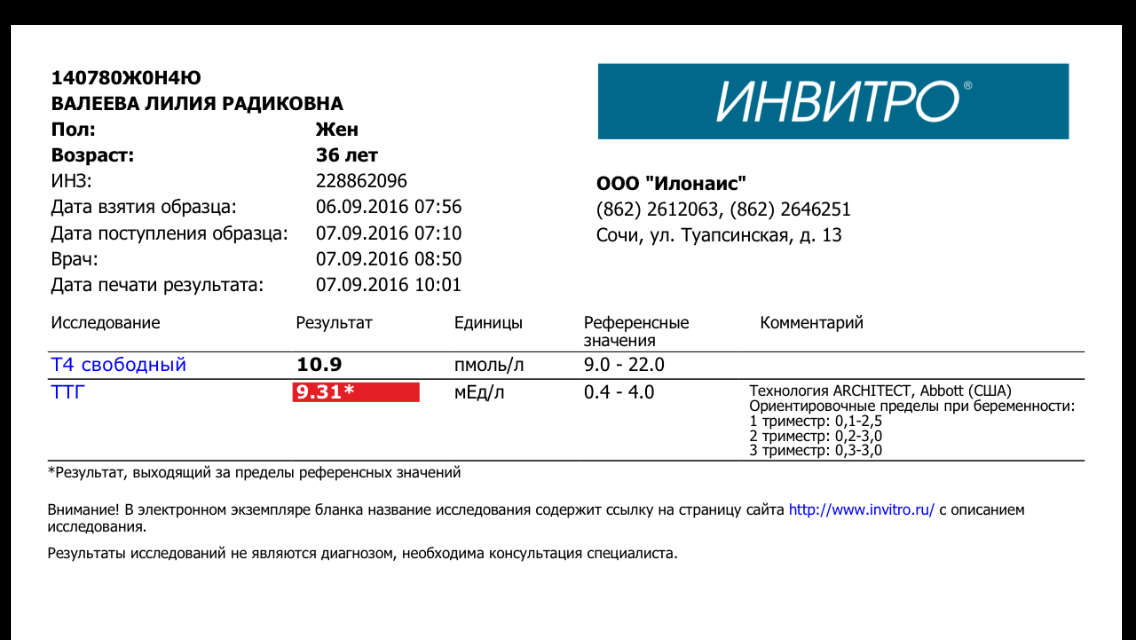
Какой гормональный статус беременных женщин? Каковы нормы уровня ТТГ по триместрам?
Для беременных это очень важно.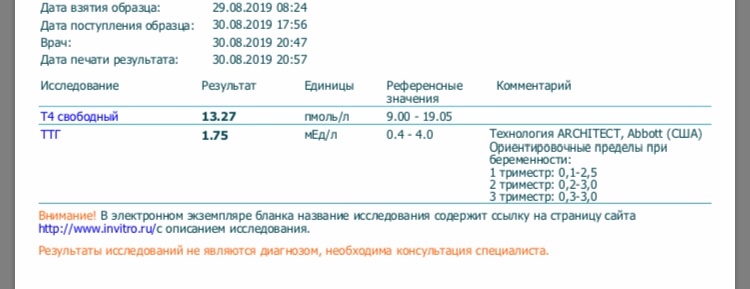 Потому что опять-таки сама беременная это не знает, гинеколог, который ее наблюдает, может тоже этого не знать, и тут вопрос, что действительно гинеколог с эндокринологом должны работать вместе.
Потому что опять-таки сама беременная это не знает, гинеколог, который ее наблюдает, может тоже этого не знать, и тут вопрос, что действительно гинеколог с эндокринологом должны работать вместе.
В паре, безусловно.
В паре, мы обязательно, сейчас вы видите на своих экранах этот слайд, мы озвучим данные циферки, и я хочу, чтобы все это запомнили. И если вдруг ваша жена или вы женщина, которая сейчас смотрите, да, собственно эфир, уже беременная, нужно обращать внимание, что уровень тиреотропного гормона принципиально разный во время различных триместров беременности.
Абсолютно. На, то есть несколько причин, одна из них – это потребность в гормонах у плода, который у нас развивается. Дело в том, что в первом триместре у него еще нет своей щитовидной железы, поэтому он пользуется гормонами мамы, соответственно нагрузка на щитовидную железу мамы тоже резко возрастает. Это первая причина.
Во-вторых, ну там есть гормональные нюансы, гормоны бета-ХГЧ которые родственник нашему ТТГ, это гормон, который увеличивается прогрессивно во время первого триместра беременности, который в свою очередь тоже может снижать показатель ТТГ.
Поэтому показатель в первом триместре, они несколько, ну во втором и третьем в общем то отличаются от наших референсных значений для здорового человека, я не говорю, что беременные, мы очень часто их по ошибке называем пациентами, беременные – это беременные. Они тоже здоровые чаще всего и дай бог, чтоб всегда так и было. Так вот показатели 0,4 – 4, не применимы к беременным пациенткам. Очень часто лаборатории не дифференцируют.
Не дифференцируют беременных и не беременных, абсолютно.
И соответственно вы должны тут, вооружившись нашими рекомендациями, сами оценить нормальный ли у вас показатель ТТГ. Для первого триместра нормальным показателем является 0,1-2,5. Для второго триместра 0,2-3, для третьего триместра показатель 0,3–3.
Если у вас показатель ниже 0,1, нужно и тут переживать? В панику впадать не надо. Во-первых, чем, ну скажем так, многоплодная беременность, то есть когда у нас двойня, тройня или более редкие случаи, когда у нас больше детей, да. Естественно еще больше увеличивает и нагрузку, и еще больше уровень бета-ХГЧ в первом триместре, соответственно ТТГ может быть несколько задавлен. Нас интересует показатель Т3 и Т4, в норме ли они, первое. И второе, мы должны исключить наличие все-таки каких-то сопутствующих патологий, что редко, редко бывает, но тем не менее возможно начало тиреотоксикоза и с какой-то из причин параллельно вместе с беременностью. В этом случае мы оцениваем еще уровень антител по рецептору ТТГ и при его повышении, мы будем думать о каких-то патологиях.
Естественно еще больше увеличивает и нагрузку, и еще больше уровень бета-ХГЧ в первом триместре, соответственно ТТГ может быть несколько задавлен. Нас интересует показатель Т3 и Т4, в норме ли они, первое. И второе, мы должны исключить наличие все-таки каких-то сопутствующих патологий, что редко, редко бывает, но тем не менее возможно начало тиреотоксикоза и с какой-то из причин параллельно вместе с беременностью. В этом случае мы оцениваем еще уровень антител по рецептору ТТГ и при его повышении, мы будем думать о каких-то патологиях.
Если у нас ТТГ снижен в первом триместре, Т4 и Т3 нормальны, у нас нету признаков тиреотоксикоза, в этом случае мы в принципе будем просто эту пациентку наблюдать по трёмстам.
Более важная ситуация – это гипотиреоз во время беременности, то есть недостаточность гормонов щитовидной железы, и мы не будем сейчас, вот это тоже важный момент, надо об этом сказать, есть доктора и даже эндокринологи, что очень грустно, а еще чаще это бывают гинекологи и акушеры, что просто ужасно, которые начинаю пугать пациентку. Вот у вас гипотиреоз, а не всегда назначается ТТГ в самом начале, он может назначить там на 10-й, 12-й недели беременности, да, пациентка приходит, повышенный уровень ТТГ, и они начинают пугать, что у вас будет ребенок с нарушениями развития, у вас будут проблемы с ребёнком, он будет такой-сякой, не факт. Нет таких исследований, которые показывали прямую взаимосвязь. Ни в коем случае это не будет являться показанием у прерыванию беременности. Никогда повышение уровня ТТГ не будет прямым показанием к прерыванию беременности.
Вот у вас гипотиреоз, а не всегда назначается ТТГ в самом начале, он может назначить там на 10-й, 12-й недели беременности, да, пациентка приходит, повышенный уровень ТТГ, и они начинают пугать, что у вас будет ребенок с нарушениями развития, у вас будут проблемы с ребёнком, он будет такой-сякой, не факт. Нет таких исследований, которые показывали прямую взаимосвязь. Ни в коем случае это не будет являться показанием у прерыванию беременности. Никогда повышение уровня ТТГ не будет прямым показанием к прерыванию беременности.
Было много, и на моем, в общем то веку все том же стаже, да, больше чем 10-ть лет уже скоро будет, когда у пациентки выявлялся гипотиреоз, иногда на поздних сроках, то есть она просто не обследовалась, приходила во втором триместре, в третьем, у нее высокий ТТГ, мы его компенсировали, высокий, реально высокий.
Все заканчивалось благополучно.
Показатель 20-30, эти дети уже в детский сад пошли, а некоторые уже в школу пошли, да? У них все хорошо, они абсолютно нормальны, они совершенно не отстают в развитии, поэтому, да это не очень хорошо, да, есть какой-то риск, он повышается при гипотиреозе, лучше поэтому обязательно сдавать ТТГ в первом триместре, вы узнали, что вы беременны, не назначил вам гинеколог, сами идите, сдайте показатель ТТГ, посмотрите, что они у вас нормальные, что они соответствуют тем референсным значениям, которые мы привели и успокойтесь на этом.
Особенности лечения заболеваний щитовидной железы у беременных | #10/08
При обследовании и лечении беременных с заболеваниями щитовидной железы врачу необходимо учитывать физиологические изменения тиреоидной функции. Можно выделить шесть основных физиологических механизмов или факторов, которые во время беременности влияют на концентрацию тиреоидных гормонов в крови, иногда имитируя то или иное заболевание щитовидной железы.
Прежде всего, с первых недель беременности под воздействием эстрогенов увеличивается концентрация тиреоид-связывающего глобулина. Это влечет за собой увеличение общего пула тиреоидных гормонов, что не позволяет ориентироваться на их уровень как на диагностический параметр при обследовании беременных женщин.
Свободные фракции тиреоидных гормонов в норме претерпевают незначительные изменения во время беременности, оставаясь в пределах нормальных величин. В первом триместре в период пика концентрации хорионического гонадотропина отмечается повышение их уровня с постепенным снижением во втором и третьем триместрах в результате увеличения объема циркулирующей плазмы.
В первом триместре в период пика концентрации хорионического гонадотропина отмечается повышение их уровня с постепенным снижением во втором и третьем триместрах в результате увеличения объема циркулирующей плазмы.
Во время беременности увеличивается скорость фильтрации в почках, что приводит к ускоренной экскреции йода. В результате увеличивается степень йодного дефицита. Отсутствие йодной профилактики во время беременности ведет к развитию гипотироксинемии, неблагоприятной для развития плода.
Необходимо учитывать влияние вырабатываемых в плаценте гормонов. Хорионический гонадотропин, вследствие своей структурной схожести с тиреотропным гормоном, оказывает стимулирующее влияние на щитовидную железу. Результатом этого влияния является снижение, а в ряде случаев подавление уровня тиреотропного гормона на фоне пика концентрации хорионического гонадотропина в первом триместре беременности. У 10% беременных одновременно с подавленным уровнем тиреотропного гормона выявляется повышенное количество свободного тироксина. Эти изменения не носят патологического характера, но требуют дифференциации с диффузным токсическим зобом (ДТЗ) и другими заболеваниями, сопровождающимися тиреотоксикозом.
Эти изменения не носят патологического характера, но требуют дифференциации с диффузным токсическим зобом (ДТЗ) и другими заболеваниями, сопровождающимися тиреотоксикозом.
В плаценте активно протекают процессы дейодинации, в результате которых Т3 и Т4 преобразуются в метаболически неактивные rТ3 и Т2. Образующиеся в процессе дейодинации свободные атомы йода проникают через плаценту и используются щитовидной железой плода для синтеза собственных тиреоидных гормонов. Через плаценту проникает и непосредственно тироксин, необходимый для правильного развития плода. Для восполнения потерь тиреоидных гормонов вследствие трансплацентарного переноса и активных процессов дейодинации необходимо увеличение их эндогенного синтеза или экзогенного введения в случае гипотиреоза.
Во время беременности изменяется активность иммунной системы. Точные механизмы этого процесса не установлены, но хорошо известно, что с развитием беременности происходит снижение уровня антитиреоидных антител, иногда до их полного исчезновения. Это необходимо учитывать при обследовании беременных с заболеваниями щитовидной железы. Особенно важно об этом помнить при проведении дифференциальной диагностики ДТЗ и транзиторного гестационного тиреотоксикоза (ТГТ): двух состояний, сопровождающихся тиреотоксикозом, но требующих принципиально различной тактики.
Это необходимо учитывать при обследовании беременных с заболеваниями щитовидной железы. Особенно важно об этом помнить при проведении дифференциальной диагностики ДТЗ и транзиторного гестационного тиреотоксикоза (ТГТ): двух состояний, сопровождающихся тиреотоксикозом, но требующих принципиально различной тактики.
Сохранение эутиреоза на протяжении всей беременности чрезвычайно важно для сохранения беременности и правильного развития плода. Изменения тиреоидной функции как в сторону тиреотоксикоза, так и гипотиреоза сопровождаются угрозой выкидыша и преждевременных родов, а также развитием других осложнений беременности. Развитие гипотироксинемии у беременной, особенно в первом триместре, ведет к нарушению правильного формирования центральной нервной системы и отдаленным психоневрологическим нарушениям у плода. Некомпенсированный тиреотоксикоз на протяжении всей беременности приводит к развитию различных пороков у плода. Все это диктует необходимость поддержания эутиреоидного состояния у женщины на протяжении всей беременности.
Особенности ведениябеременных с диффузнымнетоксическим зобом (ДНЗ)
Вступление в беременность женщины с ДНЗ принципиально изменяет тактику ведения больной. Если вне беременности это заболевание не требует частого контроля функции щитовидной железы и, зачастую, не требует и лечения, то во время беременности эти женщины относятся к группе риска развития гипотироксинемии, которая может неблагоприятно сказаться на здоровье плода.
Нами было детально обследовано 34 беременных с ДНЗ. Среди беременных с ДНЗ, как и в группе беременных без заболеваний щитовидной железы, не было выявлено гипотироксинемии в первом триместре, даже относительной. Вероятно, в регионе легкого йододефицита, к которому относится Московская область, количество поступающего в организм беременной йода все-таки достаточно, чтобы предотвратить гипотироксинемию на ранних сроках беременности.
Во втором и третьем триместрах, когда потребность беременной в йоде существенно возрастает, частота относительной гипотироксинемии у беременных с зобом зависела от наличия и сроков начала йод-профилактики. Среди беременных, начавших прием препаратов йода только со второго триместра, отмечалась тенденция к повышению частоты относительной гипотироксинемии во втором и третьем триместрах (рис.). Среди беременных, не получавших препараты йода, к концу беременности частота гипотироксинемии была достоверно выше, чем среди получавших йод-профилактику в течение всей беременности, и встречалась в 87,5% случаев (по сравнению с 25%, р=0,04, рис.).
Среди беременных, начавших прием препаратов йода только со второго триместра, отмечалась тенденция к повышению частоты относительной гипотироксинемии во втором и третьем триместрах (рис.). Среди беременных, не получавших препараты йода, к концу беременности частота гипотироксинемии была достоверно выше, чем среди получавших йод-профилактику в течение всей беременности, и встречалась в 87,5% случаев (по сравнению с 25%, р=0,04, рис.).
В нашем исследовании мы применяли 150 и 200 мкг йода. Развитие гипотироксинемии даже на фоне йодной профилактики у беременных с ДНЗ показало, что, вероятно, эта доза йода недостаточна или требуется комбинированное лечение препаратами йода и левотироксина. В 2007 г. ВОЗ рекомендовала увеличить дозу йода для беременных и женщин в период лактации до 250 мкг в сутки.
Результаты нашего исследования показали, что принципиально важна не только доза йода, но и сроки начала йодной профилактики, которая должна быть начата не позднее первого триместра беременности, а в идеальной ситуации на стадии планирования беременности.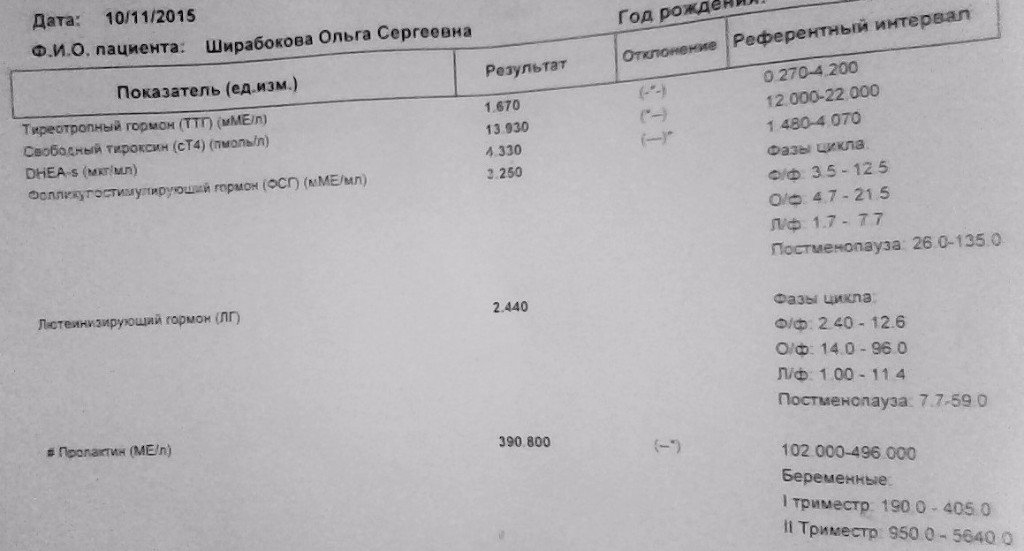
Так как беременные с ДНЗ относятся к группе риска развития гипотироксинемии, то необходимо контролировать функцию щитовидной железы каждые 2 месяца в течение первых II триместров. Патологическое значение гипотироксинемии снижается в третьем триместре, поэтому важность контроля функции щитовидной железы в этот период уменьшается.
В случае выявления гипотироксинемии, даже относительной (т.е. снижения уровня тироксина ниже 10 перцентиля) в первом триместре показано проведение комбинированного лечения препаратами йода (Йодомарин, Йодид) и левотироксина (L-Тироксин, Эутирокс) по правилам лечения гипотиреоза. Во втором триместре опасность повреждения центральной нервной системы плода меньше, поэтому назначение левотироксина показано при развитии только явной гипотироксинемии. После родов препараты левотироксина необходимо отменить с последующим контролем функции щитовидной железы через 4–8 недель для исключения персистирующего гипотиреоза. Препараты йода женщина должна продолжать принимать весь период лактации с целью обеспечения новорожденного йодом. В дальнейшем тактика ведения определяется по общим правилам.
Препараты йода женщина должна продолжать принимать весь период лактации с целью обеспечения новорожденного йодом. В дальнейшем тактика ведения определяется по общим правилам.
Особенности лечения гипотиреоза во время беременности
Гипотиреоз встречается у 2–4% беременных, при этом у части женщин заболевание не диагностировано. Так как состояние эутиреоза принципиально важно для правильного формирования плода и сохранения беременности, эндокринологическими сообществами различных стран активно обсуждается вопрос о целесообразности скрининга беременных на гипотиреоз.
Ориентироваться на клиническую картину для выделения группы риска наличия гипотиреоза чрезвычайно сложно, поскольку жалобы при гипотиреозе неспецифичны и многие из них, например слабость, сонливость, могут являться проявлениями самой беременности. Кроме этого доказано неблагоприятное влияние на течение беременности не только манифестного, но и субклинического гипотиреоза, при котором жалобы вообще отсутствуют.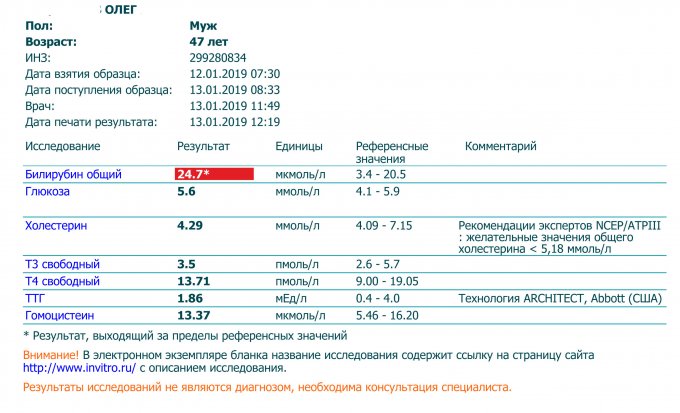 В связи с вышеперечисленным необходимо исследование тиреоидной функции хотя бы в группах риска, к которым относятся: 1)женщины, принимавшие левотироксин в анамнезе по любой причине; 2)женщины с аутоиммунными заболеваниями или семейным анамнезом аутоиммунных заболеваний; 3)женщины с зобом; 4)женщины, перенесшие операции на щитовидной железе или облучение шеи.
В связи с вышеперечисленным необходимо исследование тиреоидной функции хотя бы в группах риска, к которым относятся: 1)женщины, принимавшие левотироксин в анамнезе по любой причине; 2)женщины с аутоиммунными заболеваниями или семейным анамнезом аутоиммунных заболеваний; 3)женщины с зобом; 4)женщины, перенесшие операции на щитовидной железе или облучение шеи.
В случае выявления гипотиреоза, манифестного или субклинического, показано назначение сразу полной заместительной дозы левотироксина (L-Тироксин, Эутирокс, а не постепенное повышение дозы, как это часто принято в обычной практике. Это позволяет быстро нормализовать уровень тироксина, который, проникая через плаценту, обеспечивает нормальное развитие плода. Так как этот показатель важен для нормального развития беременности и правильного формирования плода, то и контроль компенсации гипотиреоза у беременных осуществляется не по уровню ТТГ, а по уровню свободного Т4. Уровень ТТГ является дополнительным к уровню свободного Т4 параметром, подтверждающим компенсацию гипотиреоза. Это объясняется тем, что ТТГ медленно реагирующий показатель, и для его нормализации после назначения лечения требуется 2–3 месяца в зависимости от исходных значений. Решение же о необходимости коррекции дозы левотироксина необходимо принимать гораздо быстрее, ориентируясь на уровень свободного Т4. Целевыми значениями при лечении гипотиреоза являются для ТТГ— 0,5–2,5 мЕд/л, а для свободного Т4— верхняя граница нормы.
Это объясняется тем, что ТТГ медленно реагирующий показатель, и для его нормализации после назначения лечения требуется 2–3 месяца в зависимости от исходных значений. Решение же о необходимости коррекции дозы левотироксина необходимо принимать гораздо быстрее, ориентируясь на уровень свободного Т4. Целевыми значениями при лечении гипотиреоза являются для ТТГ— 0,5–2,5 мЕд/л, а для свободного Т4— верхняя граница нормы.
Нами было проведено детальное обследование 13 беременных с впервые выявленным гипотиреозом. Из табл. 1 видно, что в группе беременных с гипотиреозом, выявленным в первом триместре беременности, ТТГ достиг целевых значений только в третьем триместре, что подтверждает его второстепенную роль при контроле компенсации гипотиреоза у беременных.
Контроль свободного Т4 необходимо проводить через 2 недели и повторно вместе с ТТГ через 4 недели после начала лечения. При нормальных показателях контроль в дальнейшем необходимо проводить каждые 2 месяца в течение первых двух триместров. В третьем триместре обычно достаточно однократного контроля уровня гормонов, так как в этот период уже не происходит резких изменений в уровне гормонов и патологическое значение гипотироксинемии не доказано. После родов женщинам, которым диагноз гипотиреоза был установлен во время беременности, требуется отмена лечения для того, чтобы выяснить характер нарушения функции щитовидной железы. В случае субклинического гипотиреоза вопрос о дальнейшем лечении решается индивидуально.
В третьем триместре обычно достаточно однократного контроля уровня гормонов, так как в этот период уже не происходит резких изменений в уровне гормонов и патологическое значение гипотироксинемии не доказано. После родов женщинам, которым диагноз гипотиреоза был установлен во время беременности, требуется отмена лечения для того, чтобы выяснить характер нарушения функции щитовидной железы. В случае субклинического гипотиреоза вопрос о дальнейшем лечении решается индивидуально.
Часть женщин на момент наступления беременности уже получает лечение по поводу гипотиреоза. В связи с физиологическими изменениями, происходящими в организме беременной, увеличивается потребность в экзогенном левотироксине. Нами было обследовано 43 беременных с гипотиреозом, диагностированным до беременности. Декомпенсация заболевания была выявлена у 50% женщин с послеоперационным гипотиреозом и почти у 40% женщин с гипотиреозом, развившимся в результате аутоиммунного тиреоидита. В нашем исследовании декомпенсация гипотиреоза у всех беременных, за исключением одной, произошла в первом триместре беременности, однако по данным литературы декомпенсация может развиться и во втором и даже третьем триместрах беременности.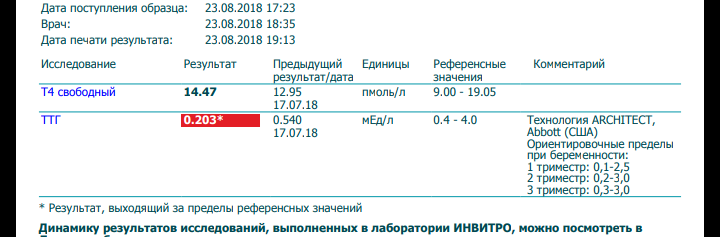 Это диктует необходимость частого контроля гормонального анализа крови у беременных с гипотиреозом. Раннее развитие декомпенсации начиная с первых недель беременности требует, во-первых, планирования беременности у женщин с известным диагнозом гипотиреоза, а во-вторых, контроля гормонального анализа сразу после наступления беременности.
Это диктует необходимость частого контроля гормонального анализа крови у беременных с гипотиреозом. Раннее развитие декомпенсации начиная с первых недель беременности требует, во-первых, планирования беременности у женщин с известным диагнозом гипотиреоза, а во-вторых, контроля гормонального анализа сразу после наступления беременности.
Так как потребность в тиреоидных гормонах увеличивается во время беременности, то требуется увеличение дозы левотироксина. В нашем исследовании было показано, что независимо от этиологии гипотиреоза увеличение дозы левотироксина на 50% предупреждало развитие гипотироксинемии у беременных на протяжении всей беременности. В случае меньшего увеличения дозы во втором и третьем триместрах возникала необходимость в дополнительной коррекции заместительной терапии.
Контроль тиреоидного статуса необходимо осуществлять 1 раз в 4 недели на протяжении первого триместра, когда особенно опасно развитие гипотироксинемии, далее 1 раз в 8 недель.
После родов в течение 4–6 недель потребность в левотироксине обычно возвращается к исходной. Но окончательное решение о дозе препарата необходимо принимать после получения результатов гормонального анализа.
Необходимо также отметить, что в регионе с дефицитом йода беременным с гипотиреозом показано проведение йодной профилактики с целью адекватного обеспечения этим микроэлементом плода. При сравнении тиреоидного статуса беременных с гипотиреозом, развившимся вследствие аутоиммунного тиреоидита, было показано, что компенсация гипотиреоза не зависела от приема препаратов йода, а применение препаратов йода сопровождалось некоторым увеличением массы тела и роста детей при рождении (3234,0±477,1 г, 50,4±2,4 см с йодопрофилактикой и 2931,1±590,2 г, 48,9±3,0 см без йодопрофилактики). В исследовании была показана прямая зависимость показателей интеллектуального развития от массы тела новорожденных, которая находилась в пределах нормальных значений. Таким образом, можно предположить благоприятное влияние йодной профилактики у беременных с гипотиреозом на развитие плода.
Таким образом, можно предположить благоприятное влияние йодной профилактики у беременных с гипотиреозом на развитие плода.
Особенности лечения беременных с тиреотоксикозом
Тиреотоксикоз встречается в 1–2 случаях на 1000 беременных. Хотя распространенность этого заболевания невелика, но лечение тиреотоксикоза у беременной является трудной и ответственной задачей для эндокринолога, ввиду потенциальных осложнений для беременной и плода как некомпенсированного тиреотоксикоза, так и назначаемого лечения.
В первом триместре беременности ДТЗ необходимо дифференцировать с ТГТ, так как лечебная тактика при этих состояниях различна.
ТГТ— доброкачественное состояние, не представляющее угрозы для беременной и плода, которое развивается вследствие стимулирующего влияния хорионического гонадотропина. Это состояние не требует лечения, разрешается обычно самостоятельно, но требует наблюдения и дифференциальной диагностики с ДТЗ.
Нами было проведено сравнение клинической картины у 8 беременных с впервые диагностированным тиреотоксикозом, причиной которого являлся ДТЗ, и 10 беременных с ТГТ. Из клинических проявлений достоверно чаще при диффузном токсическом зобе встречались дрожь в руках (62,5% при ДТЗ и 10% при ТГТ, р<0,05), повышенное систолическое давление (140,0±18,5 мм рт. ст. при ДТЗ и 115,6±7,3 мм рт. ст. при ТГТ, р=0,003), увеличение щитовидной железы (30,8±8,7 см3 при ДТЗ и 11,8±2,7 см3 при ТГТ, р=0,04). На основании однократного гормонального анализа невозможно определить причину тиреотоксикоза, поскольку нами не было получено достоверных различий в уровне ТТГ и свободного Т4 в группах с впервые развившимся ДТЗ и ТГТ (табл. 2). Однако повторные исследования тиреоидного статуса показали, что при ТГТ происходит самостоятельная нормализация показателей ТТГ и свободного Т4. При ДТЗ уровень свободного Т4 нормализуется только на фоне лечения, а ТТГ остается подавленным до конца беременности в большинстве случаев (табл. 2).
2).
В дифференциальной диагностике может помочь определение антител к рецепторам ТТГ, которые повышены только при ДТЗ. Однако необходимо учитывать, что определение антител малоинформативно после первого триместра, так как по мере прогрессирования беременности уровень их снижается в результате изменения активности иммунитета. Кроме того, необходимо учитывать метод их определения, который может быть недостаточно чувствительным.
Таким образом, при проведении дифференциальной диагностики причин тиреотоксикоза у беременных необходимо учитывать совокупность факторов: клиническую картину (дрожь в руках, повышение систолического артериального давления, увеличение щитовидной железы), уровень антител к рецепторам ТТГ в первом триместре беременности, изменение уровня тиреоидных гормонов в динамике. Наличие эндокринной офтальмопатии и/или претибиальной микседемы делает диагноз ДТЗ несомненным.
В настоящее время общепризнанным является консервативный метод лечения тиреотоксикоза во время беременности.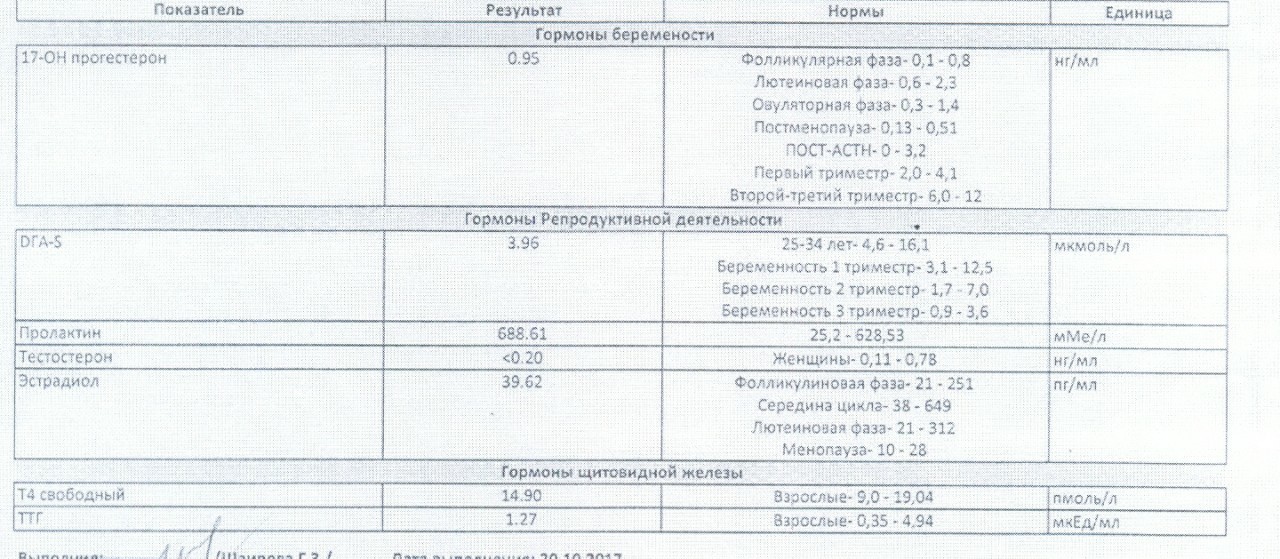 Крайне редко по показаниям во втором триместре беременности может быть проведено хирургическое лечение. Лечение радиоактивным йодом противопоказано.
Крайне редко по показаниям во втором триместре беременности может быть проведено хирургическое лечение. Лечение радиоактивным йодом противопоказано.
Препаратом выбора лечения тиреотоксикоза у беременных является пропилтиоурацил (Пропицил). Однако, в случае недоступности этого препарата, допустимо использование тиамазола (Мерказолил, Тирозол). Основная причина предпочтительного использования пропилтиоурацила— это отсутствие сообщений о его тератогенном действии. Кроме этого по некоторым данным он в меньшей степени проникает через плаценту и дополнительно к основному действию блокирует конверсию Т4 в Т3, что ускоряет достижение эутиреоза.
При лечении тиреотоксикоза у беременных необходимо соблюдать несколько правил. Во-первых, нельзя использовать высокие дозы препаратов: максимальной разрешенной дозой тиамазола (Мерказолил, Тирозол) является 20 мг в сутки, а пропилтиоурацила (Пропицил) 100 мг 3 раза в сутки. Необходимо назначать минимальные, но в то же время эффективные дозы для скорейшего достижения эутиреоза. Во-вторых, при снижении уровня свободного Т4 необходимо уменьшать дозу тиреостатиков под контролем уровня свободного Т4, иногда вплоть до полной отмены во избежание развития гипотироксинемии. В-третьих, у беременных с тиреотоксикозом никогда не применяется схема «блокируй и замещай», так как при этом используются большие дозы тиреостатиков и возрастает опасность блокирования щитовидной железы плода.
Необходимо назначать минимальные, но в то же время эффективные дозы для скорейшего достижения эутиреоза. Во-вторых, при снижении уровня свободного Т4 необходимо уменьшать дозу тиреостатиков под контролем уровня свободного Т4, иногда вплоть до полной отмены во избежание развития гипотироксинемии. В-третьих, у беременных с тиреотоксикозом никогда не применяется схема «блокируй и замещай», так как при этом используются большие дозы тиреостатиков и возрастает опасность блокирования щитовидной железы плода.
В нашем исследовании было проведено сравнение тиреоидного статуса и течения беременности у 17 женщин с декомпенсированным тиреотоксикозом, выявленным в первом триместре, и 16 беременных без патологии щитовидной железы.
Было показано, что в группе с тиреотоксикозом, несмотря на нормализацию уровня свободного Т4, ТТГ оставался подавленным на протяжении всей беременности, что не позволяет ориентироваться на него, как на показатель компенсации тиреотоксикоза. Показателем компенсации тиреотоксикоза у беременных служит свободный Т4, который должен оставаться у верхней границы нормы или немного выше нее, во избежание развития гипотироксинемии, неблагоприятной для плода.
Показателем компенсации тиреотоксикоза у беременных служит свободный Т4, который должен оставаться у верхней границы нормы или немного выше нее, во избежание развития гипотироксинемии, неблагоприятной для плода.
В нашем исследовании была доказана безопасность применения 300 мг пропилтиоурацила (Пропицил) в первом триместре беременности с постепенным снижением дозы до 25–50 мг в сутки. Такая схема лечения не оказывала влияния на объем щитовидной железы беременной, не приводила к развитию гипотироксинемии и не влияла на уровень ТТГ новорожденных. Применение же 100 и более мг пропилтиоурацила в третьем триместре беременности приводило к повышению уровня ТТГ новорожденных (в пределах нормальных величин) и в одном случае у новорожденного развился транзиторный гипотиреоз, обусловленный блокадой щитовидной железы плода применяемым тиреостатиком. Таким образом, быстрое достижение эутиреоза у беременной с тиреотоксикозом и снижение дозы тиреостатика до поддерживающей является важным фактором предупреждения блокирования щитовидной железы плода.
По вопросам литературы обращайтесь в редакцию.
Рисунок. Зависимость уровня свободного Т4 и частоты развития относительной гипотироксинемии от наличия и сроков начала йодной профилактики у беременных с ДНЗ
Гормональные показатели у беременных с впервые выявленным гипотиреозом с указанием частоты гипотироксинемии
Динамика тиреоидного статуса у беременных с ДТЗ (n = 6) и ТГТ (n = 9)
А. В. Древаль, доктор медицинских наук, профессор Т. П. Шестакова, кандидат медицинских наук О. А. Нечаева, кандидат медицинских наук МОНИКИ им. М. Ф. Владимирского, Москва
Пренатальный скрининг в первом триместре | Sonora Quest
Здоровье ее будущего ребенка часто является самой большой проблемой для беременных.
Пренатальный (до рождения) скрининг может помочь решить эту проблему. Пренатальный скрининг помогает выяснить, подвергается ли ваш ребенок большему риску определенных врожденных дефектов. Эта информация поможет вам понять, какой пренатальный скрининг-тест в первом триместре беременности и что делать дальше, если ваши результаты покажут, что ваш ребенок находится в группе повышенного риска.
Кому следует пройти пренатальный скрининг?
Американский колледж акушеров и гинекологов рекомендует предлагать пренатальный скрининг на синдром Дауна, трисомию 18 и дефекты нервной трубки всем беременным женщинам, независимо от их возраста.
Нужно ли мне проходить пренатальный скрининг?
Вам следует обсудить возможные варианты со своим врачом; однако решение о том, проходить ли пренатальный скрининг или нет, зависит от вас.Следующая информация поможет вам определиться.
Что такое синдром Дауна?
Синдром Дауна (трисомия 21) — это состояние, вызванное дополнительной копией хромосомы номер 21. Младенцы с синдромом Дауна имеют отличную внешность и некоторую степень умственной отсталости. У них часто бывают другие врожденные дефекты. Примерно 1 из 800 детей рождается с синдромом Дауна. Вероятность рождения ребенка с синдромом Дауна увеличивается с возрастом женщины; однако женщина любого возраста может родить ребенка с синдромом Дауна.
Младенцы с синдромом Дауна имеют отличную внешность и некоторую степень умственной отсталости. У них часто бывают другие врожденные дефекты. Примерно 1 из 800 детей рождается с синдромом Дауна. Вероятность рождения ребенка с синдромом Дауна увеличивается с возрастом женщины; однако женщина любого возраста может родить ребенка с синдромом Дауна.
Что такое трисомия 18?
Трисомия 18 — это состояние, вызванное дополнительной копией хромосомы номер 18. У детей с трисомией 18 наблюдается серьезная умственная отсталость и множественные врожденные дефекты. Девяносто процентов детей, рожденных с трисомией 18, умирают в течение первого года жизни. Трисомия 18 встречается только у 1 из 6000 родов.
Что такое скрининг в первом триместре?
Скрининг в первом триместре — это тест, который дает информацию на ранних сроках беременности о вероятности развития у вашего ребенка синдрома Дауна или трисомии 18.
Скрининг первого триместра включает анализ крови и обычно специальное ультразвуковое исследование. Один только анализ крови может выявить около 68% детей с синдромом Дауна и 60% детей с трисомией 18. Когда включено ультразвуковое исследование, скрининг первого триместра может выявить 84% детей с синдромом Дауна и 75% детей. с трисомией 18.
В дополнение к скринингу в первом триместре ваш врач может назначить отдельный скрининговый тест во втором триместре, чтобы получить информацию о нервной трубке ребенка.Нервная трубка развивается в позвоночник и мозг ребенка на очень ранних сроках беременности. Если нервная трубка не развивается должным образом, результатом может быть дефект позвоночника и / или мозга ребенка. Дефекты нервной трубки встречаются у 1-2 из 1000 родов и не связаны с возрастом матери.
Как проводится скрининг в первом триместре?
Когда-нибудь в первом триместре беременности вас попросят сдать небольшой образец крови из вашей руки.Используя этот образец, будет измерен уровень двух веществ. Уровень этих веществ может быть ненормальным, если у плода повышен риск синдрома Дауна или трисомии 18.
Кроме того, между 10-й и 13-й неделями беременности будет проведено УЗИ. Это ультразвуковое исследование проводится для измерения задней части шеи ребенка. Это измерение называется затылочной прозрачностью (NT).
Результаты анализа крови объединяются с измерением NT для определения риска синдрома Дауна и трисомии 18.Ваш возраст, вес, дата родов, этническое происхождение, а также медицинский и семейный анамнез будут использоваться, чтобы помочь вашему врачу интерпретировать результаты.
Что делать, если мой результат «экран отрицательный»?
«Отрицательный результат на экране» означает, что маловероятно, что у вашего ребенка синдром Дауна или трисомия 18. Однако отрицательный результат не гарантирует рождения здорового ребенка.
Что делать, если мой результат «экран положительный»?
Если ваш результат положительный, это означает, что у вашего ребенка повышенный риск развития синдрома Дауна или трисомии 18.Это не означает, что у вашего ребенка определенно одно из этих расстройств. На самом деле, в большинстве случаев у малыша этих состояний нет. Ваш врач может помочь вам понять риск и объяснить, какие дополнительные тесты могут быть рекомендованы.
Что это за дополнительные тесты?
Если результат вашего теста положительный, ваш врач может назначить дополнительную процедуру, например, забор проб ворсин хориона (CVS) или амниоцентез. Во время CVS из развивающейся плаценты удаляется небольшое количество клеток.Во время амниоцентеза в брюшную полость матери вводят иглу и удаляют часть жидкости, окружающей ребенка. Эта жидкость содержит клетки ребенка.
Используя клетки, собранные во время CVS или амниоцентеза, можно провести хромосомный анализ, чтобы определить, есть ли у ребенка синдром Дауна или трисомия 18.
Поскольку существует риск выкидыша, связанный с CVS и амниоцентезом, вам следует обсудить риски и преимущества каждой процедуры со своим врачом.
Что делать, если дополнительные тесты отрицательны?
Если дополнительные тесты отрицательны, ваш ребенок, скорее всего, здоров; однако отрицательные результаты анализов не гарантируют, что у вашего ребенка не будет какой-либо формы врожденного дефекта.
Что делать, если дополнительные тесты положительны?
Если дополнительный тест окажется положительным, генетическое консультирование поможет вам узнать больше о состоянии вашего ребенка. Это поможет вам принимать решения в интересах вас, вашей семьи и вашего ребенка.
Сводка
Скрининг в первом триместре:
- Помогает определить ваши шансы родить ребенка с синдромом Дауна или трисомией 18
- Включает анализ крови и, как правило, специальное УЗИ
- Обнаруживает до 84% детей с синдромом Дауна и около 75% детей с трисомией 18
- Не гарантирует здорового ребенка, если результат отрицательный.
- Не является диагностическим: «положительный результат на экране» не обязательно означает, что у вашего ребенка проблемы.Требуется дополнительное тестирование.
- Не предоставляет информацию о дефектах нервной трубки
← Назад
Кровотечение в первом триместре — Американский семейный врач
1. Паспулати Р.М., Бхатт С, Nour SG. Сонографическая оценка кровотечения в первом триместре [опубликованная поправка опубликована в Radiol Clin North Am. 2008; 46 (2): 437] Radiol Clin North Am . 2004; 42 (2): 297–314 http://www.sciencedirect.com/science/journal/00338389….
2. Creinin MD, Шварц JL, Гвидо Р.С., Pymar HC. Несостоятельность беременности на ранних сроках — современные концепции лечения. Obstet Gynecol Surv . 2001. 56 (2): 105–113.
3. Чен Б.А., Creinin MD. Современное ведение случаев несостоятельности беременности на ранних сроках. Clin Obstet Gynecol . 2007. 50 (1): 67–88.
4. Берг К.Дж., Чанг Дж, Каллаган ВМ, Уайтхед SJ. Смертность, связанная с беременностью, в США, 1991–1997 гг. Акушерский гинекол . 2003. 101 (2): 289–296.
5. Май З, Гюльмезоглу А.М., Ба-Тике К. Антибиотики при неполном аборте. Кокрановская база данных Syst Rev . 2007; (4): CD001779.
6. Комитет по гинекологической практике, Американский колледж акушеров и гинекологов. ACOG. Мнение комитета: номер 278, ноябрь 2002 г. Избегание неправомерных клинических решений, основанных на ложноположительных результатах теста на хорионический гонадотропин человека. Акушерский гинекол . 2002; 100 (5 пт 1): 1057–1059.
7. Тай Джи, Мур Дж., Уокер JJ. Внематочная беременность [опубликованная коррекция появляется в BMJ. 2000, 321 (7258): 424]. BMJ . 2000. 320 (7239): 916–919.
8. Догра В., Паспулати Р.М., Бхатт С. Оценка кровотечения в первом триместре. Ультразвук Q . 2005. 21 (2): 69–85.
9. Комитет по практическим бюллетеням — гинекология, Американский колледж акушеров и гинекологов.Бюллетень практики ACOG № 53. Диагностика и лечение трофобластической болезни беременных. Акушерский гинекол . 2004. 103 (6): 1365–1377.
10. Barnhart KT, Саммель MD, Ринаудо П.Ф., Чжоу Л, Hummel AC, Го В. Симптоматические пациенты с ранней жизнеспособной внутриутробной беременностью; Новое определение кривых ХГЧ. Акушерский гинекол . 2004. 104 (1): 50–55.
11. Смит К.Е., Buyalos RP. Глубокое влияние возраста пациентки на исход беременности после раннего выявления сердечной деятельности плода. Fertil Steril . 1996. 65 (1): 35–40.
12. Беннетт Г.Л., Бромли Б, Либерман Э, Benacerraf BR. Субхорионическое кровотечение при беременности в первом триместре: прогнозирование исхода беременности с помощью сонографии. Радиология . 1996. 200 (3): 803–806.
13. Bagratee JS, Хуллар В, Риган Л, Мудли Дж. Кагоро Х. Рандомизированное контролируемое исследование, сравнивающее медикаментозное и выжидательное ведение выкидыша в первом триместре. Репродукция Человека . 2004. 19 (2): 266–271.
14. Недели A, Алия Г, Блюм Дж. и другие. Рандомизированное исследование мизопростола по сравнению с ручной вакуум-аспирацией при неполном аборте. Акушерский гинекол . 2005. 106 (3): 540–547.
15. Чжан Дж., Джайлз Дж. М., Барнхарт К., Creinin MD, Вестхофф C, Фредерик ММ, для Национального института детского здоровья и развития человека (NICHD) по исследованию неудач при ранней беременности.Сравнение медикаментозного лечения с использованием мизопростола и хирургического лечения несостоятельности беременности на ранних сроках. N Engl J Med . 2005. 353 (8): 761–769.
16. Нанда К., Пелоджиа А, Граймс Д, Лопес Л, Нанда Г. Ожидаемая помощь в сравнении с хирургическим лечением выкидыша. Кокрановская база данных Syst Rev . 2006; (2): CD003518.
17. Виникофф Б. Несостоятельность беременности и мизопростол — время перемен. N Engl J Med .2005. 353 (8): 834–836.
18. Робледо С, Чжан Дж. Трэндл Дж, и другие. Клинические показатели успеха лечения мизопростолом после неудачной беременности на ранних сроках. Int J Gynaecol Obstet . 2007. 99 (1): 46–51.
19. Проект доступа к репродуктивному здоровью. Протокол лечения замершей или неполной беременности мизопростолом. http://www.reproductiveaccess.org/m_m/protocol.htm. По состоянию на 23 января 2009 г.
20.Секл MJ, Гиллмор Р, Фоскетт М, Себире, штат Нью-Джерси, Рис Х, Newlands ES. Регулярное прерывание беременности — следует ли проводить скрининг на гестационную трофобластическую неоплазию? Ланцет . 2004. 364 (9435): 705–707.
21. Прието JA, Эриксен Н.Л., Blanco JD. Рандомизированное исследование профилактического применения доксициклина для выскабливания при неполном аборте. Акушерский гинекол . 1995. 85 (5, п.1): 692–696.
22. Гайениус П.Дж., Мол F, Мол BW, Босуйт П.М., Анкум WM, ван дер Вин Ф.Вмешательства при трубной внематочной беременности. Кокрановская база данных Syst Rev . 2007; (1): CD000324.
23. Коэн М.А., Sauer MV. Ожидаемое ведение внематочной беременности. Clin Obstet Gynecol . 1999. 42 (1): 48–54.
24. Практический бюллетень ACOG. Ведение трубной беременности. Номер 3, декабрь 1998 г. Руководство по клиническому ведению акушеров-гинекологов. Американский колледж акушеров и гинекологов. Int J Gynaecol Obstet . 1999. 65 (1): 97–103.
25. Стовалл Т.Г., Ling FW. Однократная доза метотрексата: расширенное клиническое испытание. Am J Obstet Gynecol . 1993; 168 (6 пт 1): 1759–1762.
26. Lipscomb GH, МакКорд М.Л., Стовалл ТГ, Хафф G, Портера С.Г., Ling FW. Предикторы успеха лечения метотрексатом у женщин с трубной внематочной беременностью. N Engl J Med . 1999; 341 (26): 1974–1978.
27. Практический бюллетень ACOG. Профилактика аллоиммунизации Rh D. Номер 4, май 1999 г. (заменяет образовательный бюллетень № 147, октябрь 1990 г.). Руководство по клиническому ведению акушеров-гинекологов. Американский колледж акушеров и гинекологов. Int J Gynaecol Obstet . 1999. 66 (1): 63–70.
28. Vlaanderen W, Фабрик Л.М., ван Тайлл ван Серооскеркен К. Риск аборта и интервал между беременностями. Acta Obstet Gynecol Scand .1988. 67 (2): 139–140.
29. Ламли Дж., Уотсон Л, Уотсон М, Бауэр К. Добавки в период зачатия с фолиевой кислотой и / или поливитаминами для предотвращения дефектов нервной трубки. Кокрановская база данных Syst Rev . 2001; (3): CD001056.
30. Дойчман М., Эйзингер С., Кельбер М. Осложнения беременности в первом триместре. В: ТАКЖЕ: Программа курса расширенного жизнеобеспечения в акушерстве. 4-е изд. Ливуд, Кан .: Американская академия семейных врачей; 2000: 1-27.
31. DeFrain J, Милиспо Э, Се X. Психосоциальные последствия выкидыша: последствия для медицинских работников. Fam Syst Health . 1996. 14 (3): 331–347.
Скрининг и прогноз преэклампсии в первом триместре
Преэклампсия является основной причиной материнской и перинатальной заболеваемости и смертности. Заболевание с ранним началом, требующее преждевременных родов, связано с более высоким риском осложнений как у матери, так и у ребенка. Данные свидетельствуют о том, что введение низких доз аспирина, начатое до 16 недель беременности, значительно снижает частоту преэклампсии.Поэтому важно выявлять беременных женщин с риском развития преэклампсии в первом триместре беременности, что позволяет своевременно проводить терапевтическое вмешательство. Несколько профессиональных организаций, таких как Американский колледж акушеров и гинекологов (ACOG) и Национальный институт здравоохранения и повышения квалификации (NICE), предложили скрининг на преэклампсию на основе факторов материнского риска. Подход, рекомендованный ACOG и NICE, по существу рассматривает каждый фактор риска как отдельный скрининговый тест с дополнительным показателем выявления и положительным показателем скрининга.Фактические данные показали, что скрининг на преэклампсию, основанный на подходах NICE и ACOG, имеет неоптимальную эффективность, так как рекомендация NICE достигает показателей выявления только 41% и 34% с 10% ложноположительной частотой для преждевременной и доношенной преэклампсии соответственно. Скрининг, основанный на рекомендации ACOG 2013 г., может обеспечить только 5% и 2% выявления преждевременной и доношенной преэклампсии, соответственно, с частотой ложноположительных результатов 0,2%. Были разработаны различные модели прогнозирования первого триместра.Большинство из них не прошли или не прошли внешнюю проверку. Однако стоит отметить, что модель прогнозирования первого триместра (а именно тройной тест), разработанная Фондом медицины плода (FMF), которая состоит из комбинации материнских факторов и измерений среднего артериального давления, индекса пульсации маточной артерии и роста плаценты в сыворотке. фактор, прошел успешную внутреннюю и внешнюю проверку. Тройной тест FMF имеет уровни выявления 90% и 75% для прогнозирования ранней и преэклампсии, соответственно, с 10% ложноположительными результатами.Такой скрининг превосходит традиционный метод только по факторам материнского риска. Было показано, что использование модели прогнозирования FMF с последующим введением низких доз аспирина снижает частоту преэклампсии на 62%. Количество, необходимое для скрининга для предотвращения 1 случая преэклампсии с помощью тройного теста FMF, составляет 250. Ключом к поддержанию оптимальной эффективности скрининга является установление стандартизированных протоколов для измерения биомаркеров и регулярной оценки качества биомаркеров, поскольку неточные измерения могут повлиять на эффективность скрининга.Инструменты, часто используемые для оценки контроля качества, включают совокупную сумму и целевой график. Кумулятивная сумма — это чувствительный метод обнаружения небольших сдвигов во времени, и точка сдвига может быть легко идентифицирована. Целевой график — это инструмент для оценки отклонения от ожидаемого кратного медианы и ожидаемой медианы стандартного отклонения. Целевой сюжет легко интерпретировать и визуализировать. Однако он нечувствителен к обнаружению небольших отклонений. Требуется соблюдение четко определенных протоколов измерения среднего артериального давления, индекса пульсации маточной артерии и фактора роста плаценты.В этой статье обобщается существующая литература по различным методам, рекомендациям профессиональных организаций, оценке качества различных компонентов оценки риска и клинической реализации скрининга на преэклампсию в первом триместре.
Беременность и почки | Американское общество нефрологов
При распознавании почечной недостаточности измерение функции почек и протеинурии являются первыми стандартными носителями субклинической патологии. В связи с резкими гормональными и гемодинамическими изменениями во время беременности функция почек изменяется, и эти изменения необходимо учитывать при оценке функции почек во время беременности и при выборе лекарств, принимаемых во время родов.Почечная функция и фильтрация также страдают при преэклампсии, и недавние достижения значительно расширили наше понимание патофизиологических механизмов этого специфического для беременных почечного синдрома.
ОЦЕНКА СКФ И ПРОТЕИНУРИИ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Оценка СКФ при беременности
Физиологическое увеличение СКФ во время беременности обычно приводит к снижению концентрации креатинина в сыворотке, которая падает в среднем на 0,4 мг / дл до диапазона беременных 0.От 4 до 0,8 мг / дл. 1 Следовательно, сывороточный креатинин 1,0 мг / дл, хотя и является нормальным для небеременных людей, отражает почечную недостаточность у беременной женщины. Формула модификации диеты при почечной недостаточности (MDRD), которая оценивает СКФ с использованием комбинации сывороточных маркеров и клинических параметров, стала стандартным клиническим методом оценки функции почек у пациентов с хронической болезнью почек (ХБП). Использование этой формулы у беременных недостаточно изучено, и рекомендации по применению формулы MDRD специально исключают интерпретацию у беременных женщин.Формулы на основе креатинина, разработанные для небеременных женщин, скорее всего, будут неточными при применении к беременным женщинам. Например, падение креатинина сыворотки во время беременности отражает не только вызванное беременностью увеличение реальной СКФ, но также гемодилюцию в результате увеличения объема плазмы на 30–50% к родам. Возможно, более важно то, что формула MDRD систематически занижает СКФ, поскольку СКФ превышает 60 мл / мин на м 2 . Эта врожденная неточность, вероятно, будет более выражена при высокой СКФ при беременности.Формулы на основе веса, такие как Кокрофт-Голт, могут переоценивать СКФ, потому что увеличение массы тела во время беременности обычно не отражает увеличение мышечной массы или выработку креатинина.
В 2007 г. точность формулы MDRD у беременных впервые была официально оценена в двух проспективных исследованиях. 2,3 Smith et al. 2 сравнили эффективность модифицированной формулы MDRD (на основе возраста, креатинина сыворотки и пола) с клиренсом инулина в трех группах женщин: здоровых беременных добровольцах, женщинах с преэклампсией и беременных с ХБП до беременности.У здоровых беременных женщин клиренс креатинина при 24-часовом сборе мочи близко соответствовал СКФ по клиренсу инулина; однако MDRD занижает СКФ более чем на 40 мл / мин, степень систематической ошибки несколько выше, чем наблюдаемая у небеременных доноров трансплантата почки с нормальной функцией почек (29 мл / мин). 4 Среди беременных с преэклампсией или ХБП формула MDRD показала несколько лучшие результаты, занижая СКФ на 23,3 и 27,3 мл / мин соответственно; однако средняя СКФ во всех трех группах была> 60 мл / мин, диапазон СКФ, для которого формула MDRD также смещена в популяции небеременных.Следовательно, предвзятость, о которой сообщили авторы, вероятно, представляет собой неточность уравнения MDRD при применении к любой пациентке с почти нормальной функцией почек, независимо от того, беременна ли она.
Альпер и др. 3 изучали оценку СКФ в когорте из 209 женщин с преэклампсией. Они сравнили клиренс креатинина при 24-часовом сборе мочи, формуле Кокрофта-Голта и двух версиях формулы MDRD. Неудивительно, что они обнаружили, что формула Кокрофта-Голта завышает СКФ примерно на 40 мл / мин, тогда как формулы MDRD занижают СКФ (на 19.68 мл / мин для полного MDRD и 12,6 мл / мин для модифицированного MDRD). Как и в исследовании Smith et al. 2 , средняя СКФ у их участников исследования была значительно выше 60 мл / мин, диапазон СКФ, для которого формула MDRD, как известно, неточна. Нет опубликованных данных о точности формулы MDRD у беременных с СКФ <60 мл / мин. Учитывая эти проблемы, суточный сбор мочи для определения клиренса креатинина остается золотым стандартом для оценки СКФ во время беременности.
Оценка протеинурии во время беременности
Отношение белка к креатинину в моче (соотношение P: C) стало предпочтительным методом количественной оценки протеинурии у небеременных из-за высокой точности, воспроизводимости и удобства по сравнению с измерением по времени. сбор мочи. 5 Количественное определение протеинурии во время беременности показано как минимум в двух клинических ситуациях. Первый — это мониторинг протеинурии у беременных с уже существующей протеинурией почек. В этой ситуации предположения, лежащие в основе использования соотношения P: C у небеременных пациентов (фактически, устойчивое состояние в отношении продукции и экскреции креатинина), как ожидается, будут примерно соблюдаться, и это соотношение можно и нужно использовать для отслеживания изменений в протеинурия при беременности.
Вторым важным показанием для количественной оценки протеинурии во время беременности является диагностика преэклампсии. Преэклампсия определяется Американским колледжем акушерства и гинекологии 6 как новое начало гипертензии (АД> 140/90) и протеинурии (≥300 мг белка в 24-часовом сборе мочи) после 20 недель беременности. Рутинная акушерская помощь включает в себя тест-полосками на белок произвольно выделенной пробы мочи при каждом дородовом посещении, метод скрининга, который, как было показано, дает высокий уровень ложноположительных и ложноотрицательных результатов по сравнению с 24-часовым измерением белка в моче. 7 Круглосуточный сбор мочи, хотя и является золотым стандартом количественной оценки протеинурии, имеет несколько ограничений. Это обременительно для пациента, часто неточно из-за неполного сбора, а получение результатов откладывается как минимум на 24 часа, пока сбор завершается.
Использование соотношения P: C для оценки суточной экскреции белка для диагностики преэклампсии было спорным. В нескольких исследованиях сравнивали соотношение P: C с 24-часовым сбором мочи в этих условиях с противоречивыми выводами.Эти исследования различаются в зависимости от исследуемой популяции и порога, используемого для определения ненормального соотношения. Тем не менее, метаанализ с участием 974 беременных женщин из 10 исследований показал совокупную чувствительность 90% и специфичность 78% с использованием пороговых значений отношения P: C между 0,19 и 0,25 по сравнению с золотым стандартом 24-часовой экскреции белка с мочой ( > 300 мг / сут). 8 Большинство ошибок в классификации, как правило, происходит у женщин с пограничной протеинурией (от 250 до 400 мг / сут). 9 Таким образом, для диагностики преэклампсии целесообразно использовать соотношение P: C в моче, если результат неоднозначен.
БЕРЕМЕННОСТЬ ПРИ ХБП
В литературе о беременности у женщин с ХБП преобладают одноцентровые, ретроспективные и часто неконтролируемые исследования с разнородными определениями заболевания почек и неблагоприятных исходов почек и беременности. К счастью, есть убедительные доказательства того, что женщины с легкой почечной недостаточностью, нормальным АД и небольшой протеинурией или без нее имеют хорошие исходы для матери и плода с небольшим риском ускоренного прогрессирования в сторону ТПН или преждевременных родов. 10,11 Хотя имеется мало данных относительно исходов беременности при конкретных заболеваниях почек, текущий консенсус предполагает, что степень почечной недостаточности, а не основной почечный диагноз, является основным фактором, определяющим исход.
Умеренная и тяжелая ХБП приводит к повышенному риску осложнений беременности и неонатальной заболеваемости: более 70% женщин, забеременевших с уровнем креатинина сыворотки> 2,5 мг / дл, будут преждевременными, а у> 40% разовьется преэклампсия. 12,13 Беременность также может привести к ухудшению функции почек у некоторых женщин, хотя причинно-следственную связь установить трудно. В историческом исследовании 1996 года, проведенном Jones and Hayslett, 13 женщин, начавших беременность с уровнем креатинина сыворотки> 2,0 мг / дл, имели высокую (33%) вероятность ускоренного снижения функции почек во время или сразу после беременности. Недавнее исследование Imbasciati et al. 14 — единственное на данный момент исследование, в котором проспективно сравнивается скорость потери СКФ до и после беременности в когорте женщин с 3–5 стадиями ХБП.Они обнаружили, что скорость снижения СКФ после родов существенно не отличалась от показателей до зачатия во всей когорте женщин с креатинином сыворотки> 1,5 мг / дл; однако ускоренная скорость потери СКФ после родов наблюдалась в подгруппе женщин с расчетной СКФ <40 мл / мин на 1,73 м 2 и протеинурией> 1 г / день до беременности. Эту группу следует рассматривать с особенно высоким риском потери почек и осложнений беременности, и, вероятно, следует избегать беременности.
Беременность после трансплантации почки
Показатели фертильности резко возрастают после трансплантации у женщин с терминальной стадией заболевания почек; поэтому беременность — обычное явление среди молодых женщин-реципиентов трансплантата. Большинство данных свидетельствует о том, что беременность после трансплантации не увеличивает риск потери функции трансплантата, 15 , пока функция почек в порядке (креатинин <1,5 мг / дл) и пациентка находится на стабильном иммуносупрессивном режиме. В этой ситуации частота отторжения аналогична общей популяции трансплантатов, и, похоже, нет повышенного риска врожденных дефектов. 16
Неонатальные исходы беременностей у пациенток с трансплантацией почки в целом хорошие. Наиболее неблагоприятные неонатальные исходы связаны с более высокой частотой преждевременных родов (от 50 до 54%), низкой для гестационного возраста (от 33 до 45%) и неонатальной смертностью (от 1 до 3%) по сравнению с населением в целом (12,3, 5). , и 0,68% соответственно). 17,18 Самый высокий риск преждевременных родов и небольшой для гестационного возраста риск наблюдается при материнской гипертензии и нарушении исходной функции почечного трансплантата (креатинин> 1.5 мг / дл). 17 Долгосрочные результаты развития выживших младенцев кажутся хорошими. 19
ИСПОЛЬЗОВАНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРИ БЕРЕМЕННОСТИ
Ингибиторы системы ренин-ангиотензин-альдостерон
Широко известные тератогенные эффекты ингибиторов ангиотензин-превращающего фермента (ACEi) включают гипотензию плода, гипотензию плода, анурию-олигопорамниону тубулярная дисплазия, почечная недостаточность новорожденных и гипокальвария. Эти эффекты возникают при воздействии ИАПФ во втором и третьем триместре беременности и приводят к неонатальной смертности до 25%. 17 Выжившие младенцы имеют повышенный риск нарушения функции почек и гипертонии в детстве и в раннем взрослом возрасте. 20 Подобная картина аномалий плода была описана при воздействии антагонистов рецепторов ангиотензина II во втором и третьем триместре. 21,22 Воздействие ИАПФ в первом триместре ранее считалось безвредным, а продолжение приема ИАПФ в начале первого триместра считалось безопасным многими практикующими врачами; однако первое крупное эпидемиологическое исследование воздействия ИАПФ в первом триместре показало более высокую частоту серьезных врожденных аномалий (в первую очередь, пороков сердечно-сосудистой системы и центральной нервной системы) по сравнению с беременностями без воздействия (7.1 против на 2,6%). 23 Таким образом, в настоящее время рекомендуется прекратить прием блокаторов рецепторов ACEi и ангиотензина до зачатия и информировать пациентов о применении соответствующих средств контроля рождаемости при приеме этих препаратов. Кроме того, женщины с непреднамеренным воздействием ИАПФ или блокаторов рецепторов ангиотензина в первом триместре должны пройти подробное ультразвуковое исследование плода и эхокардиографию в середине беременности для выявления врожденных аномалий. Данные о безопасности антагонистов альдостерона или ингибиторов ренина при беременности немногочисленны или отсутствуют.Учитывая установленную тератогенность ИАПФ и ключевую роль ренин-ангиотензин-альдостероновой системы в развитии плода, применение этих препаратов при беременности, как правило, противопоказано.
Иммуносупрессивные препараты
Ингибиторы кальциневрина, стероиды и азатиоприн являются основой безопасной иммуносупрессивной терапии беременных-реципиентов трансплантата. Микофенолятмофетил (ММФ) долгое время избегали при беременности на основании исследований на животных, предполагающих токсичность для развития, пороки развития и внутриутробную гибель в терапевтических дозах.Продолжается накопление данных, подтверждающих потенциально тератогенные эффекты MMF при беременности человека, такие как подавление костного мозга плода и структурные аномалии, включая гипопластические ногти, укороченные пальцы, микротию (пороки развития ушей) и расщелину губы / неба. Текущие рекомендации предполагают, что женщинам, принимающим ММФ и планирующим беременность, следует прекратить прием лекарства по крайней мере за 6 недель до зачатия. Хотя данных о безопасности сиролимуса при беременности на людях мало, исследования на животных предполагают тератогенность, поэтому его тоже следует избегать. 24
ПОСЛЕДНИЕ ДОСТИЖЕНИЯ В ПРЕДЭКЛАМПСИИ
С 2003 года накопились данные, подтверждающие центральную роль плацентарных антиангиогенных факторов, включая растворимую fms-подобную тирозинкиназу-1 (sFlt1), в патогенезе преэклампсии (рис. 1). sFlt1 является циркулирующим антагонистом как фактора роста эндотелия сосудов (VEGF), так и фактора роста плаценты (PlGF) и сверхэкспрессируется в плаценте женщин с преэклампсией. Оригинальная крысиная модель преэклампсии, индуцированной sFlt1 25 , была воспроизведена другими. 26 Животные модели преэклампсии, основанные на индукции маточно-плацентарной ишемии как у крыс, так и у приматов, характеризуются повышенным циркулирующим и плацентарным sFlt1. 27,28 У женщин с преэклампсией концентрация sFlt1 в маточной вене превышает sFlt1 в антекубитальной вене, что подтверждает фетоплацентарный источник избыточного циркулирующего sFlt1. 29 В настоящее время существует более десятка исследований, подтверждающих, что циркулирующие уровни sFlt1 и одной из его мишеней, проангиогенного PlGF, изменяются за несколько недель до появления клинических признаков и симптомов преэклампсии — в случае PlGF — уже на ранней стадии. как первый триместр.На моделях мышей получены данные о том, что VEGF важен для поддержания здоровья и заживления эндотелиальных клеток клубочков, а его отсутствие вызывает протеинурию и тромботическую микроангиопатию, напоминающую патологические изменения клубочков при преэклампсии. 30 Эти разнообразные результаты подтверждают теорию о том, что измененная плацентарная экспрессия ангиогенных факторов, индуцированная или усугубляемая плацентарной ишемией, является основным фактором эндотелиальной дисфункции при преэклампсии.
Рисунок 1.Краткое изложение современного взгляда на патогенез преэклампсии.Дисфункция плаценты, вызванная плохо изученными механизмами, включая генетические, иммунологические и экологические, играет раннюю и основную роль в развитии преэклампсии. Поврежденная плацента, в свою очередь, выделяет антиангиогенные факторы sFlt1 и sEng в кровоток матери. Эти факторы приводят к нарушению передачи сигналов VEGF / PlGF и TGF-β, что приводит к системной дисфункции эндотелиальных клеток, опосредованной множеством факторов, как показано. Эндотелиальная дисфункция, в свою очередь, приводит к системным проявлениям преэклампсии.HO, гемоксигеназа; AT 1 AA, агонистические аутоантитела к ангиотензину 1 типа; COMT / 2ME, катехол-O -метилтрансфераза и 2-метоксиэстрадиол; sFlt1, растворимая fms-подобная тирозинкиназа-1; sEng, растворимый эндоглин; ЕТ-1, эндотелин 1; АФК, активные формы кислорода; NO, оксид азота; ЗВУР — задержка внутриутробного развития плода; АД, гемолиз, повышенные ферменты печени, низкие тромбоциты.
sFlt1, вероятно, только один из нескольких циркулирующих факторов, которые способствуют эндотелиальной дисфункции.Растворимый эндоглин (sEng), продукт протеолитического расщепления эндоглина рецептора TGF-β, по-видимому, действует синергетически с sFlt1; при совместном введении беременным крысам sFlt1 и sEng вызывают синдром, напоминающий HELLP (гемолиз, повышенные ферменты печени и низкие тромбоциты), тяжелый вариант преэклампсии. 31,32 Последующие исследования на людях подтверждают, что sEng увеличивается в кровообращении до начала преэклампсии по гестационному типу, аналогичному sFlt1, с резким повышением уровней непосредственно перед началом клинических симптомов. 33–35
Ангиогенные факторы в группах высокого риска
Ангиогенные факторы дают представление о патофизиологии нескольких установленных факторов риска преэклампсии. Например, преэклампсия тесно связана как с первой беременностью, так и с беременностью при многоплодной беременности. Более высокие уровни sFlt1 в сыворотке наблюдаются в обеих этих группах по сравнению со второй беременностью и одноплодной беременностью, соответственно. 36,37 Точно так же беременные женщины, чьи плоды поражены трисомией 13 (состояние, связанное с повышенным риском преэклампсии), имеют более высокие уровни циркулирующего sFlt1 по сравнению с контрольными субъектами, 38 , возможно, в результате дополнительной копии sFlt1 ген, который находится на хромосоме 13.Курение связано как со снижением риска преэклампсии 39,40 , так и с более низкими уровнями циркулирующего sFlt1 как у беременных 33,41 , так и у небеременных 42 по сравнению с некурящими. Экстракт сигаретного дыма снижает продукцию sFlt1 плацентарными клетками in vitro . 43 Молекулярный механизм, с помощью которого курение подавляет sFlt1 (тем самым снижая риск преэклампсии), неизвестен, но такая реакция неудивительна, учитывая известные проангиогенные эффекты никотина. 44 Тем не менее, никто не рекомендует курить во время беременности.
Несколько факторов риска преэклампсии, включая хроническую гипертензию, диабет и ожирение, связаны с основной материнской эндотелиальной дисфункцией. Эти женщины могут быть более восприимчивы к неблагоприятным эндотелиальным эффектам антиангиогенных факторов. Если это так, то можно ожидать, что преэклампсия будет развиваться при более низком пороге циркулирующего sFlt1 у женщин с этими материнскими эндотелиальными факторами риска по сравнению с ранее здоровыми женщинами.Действительно, уровни sFlt1 ниже у полных женщин с установленной преэклампсией по сравнению с женщинами с нормальным весом с преэклампсией. 45 Аналогичным образом, у женщин с преэклампсией в сочетании с относительно низким уровнем циркулирующего sFlt1 было обнаружено более высокое АД при бронировании (от 13 до 20 недель беременности) по сравнению с женщинами с преэклампсией с высоким sFlt1, 46 предполагая субклиническую эндотелиальную дисфункцию. при более низком пороге sFlt1 для развития преэклампсии. Еще предстоит выяснить, имеют ли другие сосудистые факторы риска, такие как хроническая гипертензия и диабет, аналогичную картину.
Молекулярные пути, влияющие на экспрессию sFlt1 и sEng, и то, как они могут быть связаны с другими теориями патогенеза преэклампсии, только появляются. Гемоксигеназа (HO), противовоспалительный фермент с антиоксидантными свойствами, ослабляет экспрессию sFlt1, вызванную VEGF. 47 Снижение активности HO наблюдается у женщин с преэклампсией 48,49 и опосредует повышенную экспрессию sFlt1 и sEng в плаценте. Это наблюдение предполагает потенциальное терапевтическое использование статинов при преэклампсии, потому что эти агенты активируют HO-1 и снижают VEGF-индуцированное высвобождение sFlt1 из эксплантатов ворсинок плаценты 47 ; однако в клинических испытаниях сначала необходимо исключить нежелательные эффекты для плода, что является критическим стандартом для любой новой терапии преэклампсии.
В последние годы возросла потенциальная роль агонистических аутоантител к рецептору ангиотензина AT1 (AT1-AA) в патогенезе преэклампсии. Повышение циркулирующих уровней AT1-AA у женщин с преэклампсией было впервые описано в 1999 50 и предположено, что оно опосредует повышенную реактивность сосудов к ангиотензину II и, возможно, эндотелиальную дисфункцию, которые характерны для преэклампсии. Хотя последующая работа показала, что эти аутоантитела неспецифичны для преэклампсии, остаются значительные экспериментальные данные, позволяющие предположить, что они могут играть важную патогенную роль.AT1-AA связаны с окислительным стрессом и снижением инвазии трофобластов, 51 и повышением циркулирующих уровней в модели преэклампсии у трансгенных мышей. 52 Аутоантитела к рецептору AT1 стимулируют продукцию sFlt1 трофобластами in vitro и, следовательно, могут опосредовать избыточную продукцию sFlt1 плацентой при преэклампсии 53 ; однако, AT1-AA не были временно коррелированы с клиническим фенотипом преэклампсии в крупных клинических исследованиях.
В последнее время дефицит плацентарного фермента катехол-O-метил-трансферазы (COMT) и 2-метоксиэстрадиола (2-ME) также был связан с преэклампсией. 54 У мышей с дефицитом COMT развиваются признаки и симптомы, подобные преэклампсии, которые устраняются экзогенной терапией 2-ME, возможно, посредством ингибирования индуцируемого гипоксией фактора 1-α и нижестоящих мишеней, таких как sFlt1. Исследователи также продемонстрировали, что плацента человека, полученная от пациентов с преэклампсией, не имеет СОМТ, что сопровождается низким уровнем циркулирующего 2-МЕ. Необходима дополнительная работа, чтобы понять точную роль СОМТ при нормальной и патологической беременности.
Скрининг преэклампсии
Способность выявлять преэклампсию до начала гипертонии, протеинурии и других явных проявлений болезни, вероятно, станет первым применением ангиогенных факторов в клиническом ведении преэклампсии. На сегодняшний день более десятка независимых исследований подтвердили значительные изменения в PlGF, sFlt1 или sEng до начала преэклампсии. 33,35,55–69 Изменения PlGF наблюдаются в первом триместре, 67–69 , тогда как воспроизводимые изменения sFlt1 и sEng наблюдаются в середине и конце второго триместра и далее.PlGF выводится с мочой на более низких уровнях при преэклампсии, и измерение PlGF в моче может иметь значение для скрининга преэклампсии 70 или диагностики. 71–73 Объединение этих трех биомаркеров в единый ангиогенный индекс 33,55,65 или допплерографию маточной артерии 74–77 может быть более предсказуемым, чем любой отдельный маркер.
Еще неизвестно, будут ли ангиогенные биомаркеры достаточно чувствительными и специфичными для широкого клинического использования.Например, изменения ангиогенных факторов связаны с беременностями с нормальным давлением, осложненными задержкой внутриутробного развития (ЗВУР). 58,78–81 Изменения ангиогенного фактора в IUGR менее выражены, чем при преэклампсии, и (за исключением sEng 33 ) не наблюдались в образцах второго и начала третьего триместра, 33,58, 63,82 , поэтому это совпадение может не иметь отношения к раннему скрининговому тесту на преэклампсию. Продолжается международное проспективное когортное исследование ангиогенных биомаркеров для скрининга преэклампсии, спонсируемое Всемирной организацией здравоохранения и с целью набора 10 000 женщин (http: // www.crep.com.ar/plgf/) и поможет прояснить многие из этих противоречий. В дополнение к скринингу и диагностике до появления клинических симптомов, ангиогенные факторы могут оказаться полезными для дифференциации преэклампсии от других гипертензивных расстройств беременности, таких как гестационная гипертензия и хроническая гипертензия. 83,84
Плацентарный протеин-13 (PP-13) также появился в качестве раннего биомаркера преэклампсии и других заболеваний, связанных с неадекватной плацентацией. PP-13 — это специфический для плаценты белок, который участвует в нормальной имплантации и развитии сосудов плаценты.Уровни PP-13 в материнской сыворотке крови в первом триместре значительно ниже у женщин, у которых развивается преэклампсия, ЗВУР и преждевременные роды. Некоторые ранние исследования предполагали превосходное предсказание преэклампсии по сыворотке PP-13 в первом триместре, 85 , хотя в других исследованиях предполагалось, что PP-13 является надежным биомаркером только для раннего начала заболевания и менее полезен для преэклампсии, возникающей ближе к сроку. 86 Сочетание скрининга сыворотки PP-13 в первом триместре с допплерографией маточной артерии может дополнительно улучшить прогноз. 87 Мутации в LGALS13 , гене, кодирующем PP-13, были обнаружены в случаях преэклампсии. 88 Этот полиморфизм может привести к продукции более короткого варианта сплайсинга PP-13, который не обнаруживается с помощью обычных анализов, что способствует низкому уровню циркуляции и снижению локальной активности PP-13 в некоторых случаях преэклампсии.
Инструмент для скрининга преэклампсии окажет наибольшее влияние на клинические исходы, когда станут доступны эффективная профилактика или лечение.На сегодняшний день не существует эффективной профилактики преэклампсии, и лечение является поддерживающим, и единственным окончательным лечением является доставка новорожденного. Тем не менее, ранняя диагностика преэклампсии с помощью ангиогенных биомаркеров, вероятно, улучшит клинические исходы с помощью вмешательств, доступных в настоящее время. Например, интенсивный мониторинг пациентов с положительным результатом скрининга позволит своевременно назначить антигипертензивные препараты, постельный режим, магний для профилактики судорог, стероиды для созревания легких плода и своевременные роды (при необходимости).Необходимо будет доказать влияние скрининга на клинические исходы с использованием этих методов. Наибольшее потенциальное влияние скрининга и ранней диагностики будет зависеть от новых стратегий лечения или профилактики преэклампсии, основанных на изменении продукции плаценты или эндотелиальных эффектов ангиогенных факторов. Вмешательства, позволяющие безопасно отложить роды всего на 1 неделю, могут значительно улучшить неонатальные исходы при преэклампсии. 89 Такие методы лечения еще не за горами, но они возлагают большие надежды на преобразование нашей помощи женщинам с преэклампсией.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ПРЕЭКЛАМПСИИ
Некоторые лекарства и новые методы лечения могут играть роль в лечении преэклампсии.
Аспирин
Теоретические преимущества аспирина основаны на заметных изменениях баланса простациклин-тромбоксан при преэклампсии. Аспирин для профилактики преэклампсии широко изучался. Десятки испытаний дали смешанные результаты, завершившиеся тремя крупными рандомизированными контролируемыми испытаниями, в которых в середине 1990-х годов приняли участие 12 000 женщин из группы высокого риска. 90–92 Все три исследования выявили небольшую, несущественную тенденцию к снижению частоты преэклампсии в группах, получавших аспирин. Подробный метаанализ, опубликованный в 2004 году, впоследствии подкрепленный вторым метаанализом в 2007 году, объединил данные рандомизированных контролируемых исследований с участием более 32 000 женщин с различным статусом риска из 31 исследования. Оба метаанализа показали небольшую, но значительную общую пользу с относительным риском преэклампсии от 0,81 до 0,90 для пациентов, принимавших аспирин. 93,94 В обоих анализах также наблюдалось небольшое снижение риска преждевременных родов. Аспирин в низких дозах кажется безопасным: ранние опасения по поводу повышенного риска послеродового кровотечения явно развеялись. Учитывая небольшой, но значительный защитный эффект, профилактику аспирином следует рассматривать как первичную профилактику преэклампсии, особенно для женщин с высоким исходным риском и для которых абсолютное снижение риска будет наибольшим.
Антиоксиданты
Пищевые добавки, включая антиоксиданты, кальций и фолиевую кислоту, были предложены для защиты от преэклампсии.К сожалению, ни один из них не оказался эффективным в рандомизированных контролируемых исследованиях. Использование антиоксидантов вызвало особый энтузиазм в последние несколько лет, отчасти благодаря исследованиям, предполагающим важную роль оксидантного стресса в патогенезе преэклампсии; однако три крупных рандомизированных контролируемых испытания добавок витаминов C и E с размерами выборки от 700 до 2400 женщин не показали положительных результатов у женщин с высоким риском 95,96 или у здоровых первородящих женщин. 97 Продолжается более крупное испытание, спонсируемое Сетью отделений материнско-фетальной медицины Национальных институтов здравоохранения, в котором предполагается принять участие 10 000 женщин из группы низкого риска; однако текущие данные не поддерживают рутинное использование антиоксидантов для профилактики преэклампсии.
Кальций и фолиевая кислота
Добавки кальция неэффективны для женщин с нормальным или высоким исходным уровнем потребления кальция, но могут быть полезны для групп населения с низким (<600 мг / день) потреблением кальция с пищей. 98,99 Фолиевая кислота считается защитной по данным наблюдений, 100 , но пока нет рандомизированных контролируемых испытаний, подтверждающих это утверждение.
Ангиогенная терапия
Повреждение эндотелия при преэклампсии опосредуется, по крайней мере частично, нарушением баланса между проангиогенными (VEGF, PlGF и TGF-β) и антиангиогенными (sFlt1 и sEng) факторами циркуляции.Учитывая это, вмешательства, направленные на восстановление ангиогенного баланса, являются многообещающими для профилактики или лечения преэклампсии. На крысиной модели преэклампсии, вызванной sFlt1, рекомбинантный VEGF-121 уменьшал гипертензию и повреждение почек. 101 Другие стратегии, которые можно изучить, включают использование фактора роста плаценты; mAbs к sFlt1 или sEng; низкомолекулярные ингибиторы sFlt1 или sEng действия; или агенты, которые усиливают продукцию эндогенного VEGF, PlGF или TGF-β.
l-аргинин
Другая потенциальная стратегия лечения преэклампсии основана на роли оксида азота (NO) в патогенезе заболевания.Эндотелиальный защитный эффект VEGF и PlGF при нормальной беременности опосредуется NO, а нарушение синтеза NO может способствовать эндотелиальной дисфункции при преэклампсии. У женщин с преэклампсией высокий уровень циркулирующего асимметричного диметиларгинина, эндогенного ингибитора NO-синтазы, наблюдается еще до клинического начала заболевания. 102,103 Следовательно, доноры или предшественники NO, такие как l-аргинин, могут быть эффективными для профилактики или лечения преэклампсии. Хотя клинические исследования до сих пор были слишком малы, чтобы продемонстрировать убедительную пользу, 104 пилотные данные предполагали, что l-аргинин может продлить беременность и снизить АД у женщин с гестационной гипертензией. 105 Необходимы более масштабные исследования, чтобы определить, являются ли L-аргинин или другие вмешательства, направленные на восстановление эндотелиальной активности NO, безопасными и эффективными при преэклампсии.
По-прежнему существуют серьезные проблемы с разработкой новых методов лечения преэклампсии, и неясно, окажутся ли эти новые методы лечения безопасными и эффективными. Тем не менее, приятно наблюдать за достижениями в нашем понимании патофизиологии преэклампсии, которые могут в конечном итоге привести к вариантам лечения этого сложного заболевания.
Том 2, Глава 4. Диагностическое УЗИ в первом триместре беременности
Частота внематочной беременности в настоящее время достигла почти 2%. Любой пациент с историей внематочной беременности, перевязки маточных труб или хирургии маточных труб, или воспалительные заболевания органов малого таза должны пройти TVS к 6 неделям после последний менструальный цикл (LMP). Для пациентов, не относящихся к группе высокого риска при внематочной беременности двумя наиболее частыми симптомами являются кровотечение. и тазовая боль.Боль обычно распространяется на придатки.
В исследовании 1981 года Кадар и соавторы 12 обнаружили, что «дискриминационное» значение β-ХГЧ составляет 6000 мМЕ / мл. может использоваться в качестве отсечки, когда внутриутробный гестационный мешок должен быть виден через ТАС. При TVS ранний гестационный мешок должен наблюдаться при уровне β-ХГЧ от 1500 до 2000 мМЕ / мл (Третий международный Стандарт). У пациентов с более низкими титрами β-ХГЧ должен удвоиться. в течение 48 часов. При медленном повышении или стабилизации уровня β-ХГЧ титры и невизуализация внутриутробного гестационного мешок, у пациентки может быть диагностирована ранняя внутриутробная беременность потеря или внематочная беременность.У клинически стабильных пациентов дилатация и выскабливание могут помочь отличить неудачный ранний внутриутробный беременность и внематочная (рис. 6).
Рис. 6. Алгоритм диагностики неразорвавшейся беременности без лапароскопии. Прогестерон измерения повышают чувствительность алгоритма недорогим скринингом большого количества пациентов во время первого триместр беременности. Окончательный диагноз ставится трансвагинально. УЗИ или выскабливание матки и не зависит от сывороточного прогестерона концентрации, полученные во время скрининга.Для преобразования значений для прогестерона в наномоль на литр умножить на 3,18. D&C обозначает дилатация и выскабливание (Carson SA, Buster JE: Ectopic Pregnancy. N Engl J Med 329: 1174, 1993) |
Чувствительность TVS при обнаружении фактических внематочных образований в придатках, вероятно, составляет зависит как от уровня β-ХГЧ, так и от навыков сонографистов. Стика и соавторы 13 выявляли эктопическое образование придатков только в 13% случаев у пациентов с средний уровень β-ХГЧ до лечения 1900 мМЕ / мл.Это сравнивается с результаты Stovall и соавторов, 14 , которые визуализировали 94% эктопических образований придатков у пациентов со средним до лечения уровень β-ХГЧ 3950 мМЕ / мл.
Стовалл и соавторы 14 отметили сердцебиение плода в 12% внематочных беременностей по сравнению с 23% в случае внематочной беременности. исследование Тимора-Трича и его коллег. 15 (Рис.7) В большом проценте случаев выявление эктопического придатка масса основана на обнаружении трубного кольца или сложной придаточной массы (рис.8 и 9). Само желтое тело и вторичный гемоперитонеум могут приводить к к ложноположительному диагнозу внематочной беременности. В дополнение Врач должен знать, что выявляются очень небольшие внематочные беременности. на УЗИ бывает сложно определить лапароскопически.
Рис. 7. Трубная беременность с плодом и желточным мешком. |
Рис. 8. Внематочная беременность, определяемая по маленькому трубному кольцу ( стрелка ).Фаллопиевы трубы очерчены скоплением жидкости, которое было обнаружено изобразить гемоперитонеум при лапароскопии. |
Рис. 9. 7-миллиметровое эктопическое трубное кольцо ( стрелка ), идентифицированное рядом с большим кистозным телом желтого тела. |
Хотя плюсы и минусы медикаментозного ведения внематочной беременности с метотрексатом выходят за рамки данной главы, два момента стоит сделать. Во-первых, свидания LMP отключаются как минимум на 1 неделю 15% время.Отсутствие проверки серийных титров может привести к неправильному введению. метотрексата пациенткам со здоровой беременностью. Судебный процесс произошло в случаях, когда метотрексат был случайно дан у пациенток впоследствии обнаружилась ранняя внутриутробная беременность. Во-вторых, метотрексат терапия доказанной внематочной беременности, по-видимому, работают лучше всего, если внематочная масса придатков меньше 4 см и β-ХГЧ титр менее 5000 мМЕ / мл. Беременности, не соответствующие этим критерии с большей вероятностью требуют нескольких доз метотрексата или быть невосприимчивым к лечению.
Неинвазивное эпигенетическое обнаружение трисомии плода 21 в материнской плазме первого триместра Академический исследовательский доклад по «Клинической медицине»
OPEN 3 ACCESS онлайн бесплатно
пункт один
Неинвазивное эпигенетическое обнаружение трисомии плода 21 в материнской плазме первого триместра
Джи Хяэ Лим1, Шин Ён Ким1, Со Ён Пак1, Шин Ён Ли1, Ми Джин Ким1, Ю Чжон Хан2, Си Вон Ли2, Джин Хун Чунг2, Мун Ён Ким2, Джэ Хьюг Ян2, Хён Ми Рю1,2 *
1 Лаборатория медицинской генетики, Медицинский научно-исследовательский институт, Общая больница Чейл и Центр женского здоровья, Сеул, Корея, 2 Отделение акушерства и гинекологии, Общая больница Чейл и Центр женского здоровья, Медицинский колледж Университета Квандон, Сеул, Корея
Аннотация
Предпосылки: Синдром Дауна (СД) — наиболее распространенная из известных анеуплоидий, вызываемая дополнительной копией всей или части хромосомы 21.Специфические для плода эпигенетические маркеры были исследованы для неинвазивного пренатального обнаружения СД плода. Ген фосфодиэстеразы, PDE9A, расположенный на хромосоме 21q22.3, полностью метилирован в крови (M-PDE9A) и неметилирован в плаценте (U-PDE9A). Поэтому мы оценили точность неинвазивного обнаружения DS плода в первом триместре беременности, используя эту тканеспецифическую эпигенетическую характеристику PDE9A.
Методология / основные результаты. Было проведено вложенное исследование случай-контроль с использованием образцов материнской плазмы, собранных у 108 беременных женщин с 18 DS и 90 нормальными плодами (каждый случай был сопоставлен с 5 контролями в соответствии с неделями беременности при заборе крови).Все беременности были одиночными на сроке 12 недель беременности или раньше в период с октября 2008 г. по май 2009 г. Уровни M-PDE9A и U-PDE9A в плазме крови матери измеряли с помощью количественной полимеразной цепной реакции, специфичной для метилирования. Уровни M-PDE9A и U-PDE9A были получены во всех образцах и не различались у плодов мужского и женского пола. Уровни M-PDE9A не различались между случаями DS и контролем (1854,3 против 2004,5 копий / мл; P = 0,928). Уровни U-PDE9A были значительно повышены у женщин с DS-плодами по сравнению с контрольной группой (356.8 против 194,7 копий / мл, PC0,001). Чувствительность уровня U-PDE9A и индекса неметилирования PDE9A для неинвазивного обнаружения DS плода составила 77,8% и 83,3%, соответственно, с 5% ложноположительными результатами. При оценке риска СД плода скорректированные отношения шансов уровня U-PDE9A и UI составили 46,2 [95% доверительный интервал: 7,8–151,6] и 63,7 [95% доверительный интервал: 23,2–206,7], соответственно.
Выводы. Наши результаты показывают, что уровень U-PDE9A и индекс неметилирования PDE9A могут быть полезными биомаркерами для неинвазивного выявления DS плода в течение первого триместра беременности, независимо от пола плода.
Образец цитирования: Lim JH, Kim SY, Park SY, Lee SY, Kim MJ, et al. (2011) Неинвазивное эпигенетическое обнаружение трисомии плода 21 в материнской плазме первого триместра. PLoS ONE 6 (11): e27709. DOI: 10.1371 / journal.pone.0027709
Редактор: Камаруддин Низами, Университет Ага Хана, Пакистан
Поступило 24.07.2011; Принята в печать 23 октября 2011 г .; Опубликовано 23 ноября 2011 г.
Авторские права: © 2011 Lim et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: это исследование было поддержано исследовательским грантом Фонда благотворительности по страхованию жизни. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
* Электронная почта: [email protected]
Введение
Пренатальное тестирование — неотъемлемая часть акушерской практики.Обнаружение хромосомной анеуплоидии считается наиболее частым и важным аспектом пренатального тестирования. Аневроплоидия относится к изменениям количества хромосом, присутствующих внутри клетки, а фенотипические эффекты вызваны увеличением или уменьшением дозировки гена в результате приобретения или потери определенной хромосомы. Наиболее распространенной анеуплоидией является трисомия 21, называемая синдромом Дауна (DS), которая встречается у 1 из 800 живорождений во всем мире и вызывается дополнительной копией всей или части хромосомы 21 [1].DS ассоциируется с интеллектуальными нарушениями, серьезными трудностями в обучении и смертностью, вызванной долгосрочными проблемами со здоровьем, такими как болезни сердца [1]. Заболеваемость ДС плода увеличивается в зависимости от возраста матери [1,2].
Во всем мире миллионы беременных женщин ежегодно проходят пренатальное тестирование, включая скрининговые тесты и инвазивные диагностические процедуры для выявления DS плода. Действующий протокол скрининга
для DS плода включает анализ крови на биомаркеры материнского белка, связанные с DS (альфа-фетопротеин материнской сыворотки, неконъюгированный эстриол, хорионический гонадотропин человека и ингибин-A), а также ультразвуковое исследование плода на прозрачность шеи.Однако уровень обнаружения для каждого фактора колеблется от 25% до 68% с уровнем ложноположительных результатов 5% [3,4]. Поэтому для увеличения частоты выявления СД плода на 11-12 неделе и 16-18 неделе беременности обычно проводят множественные скрининговые тесты. Однако такие интегрированные тесты имеют недостатки, такие как повышенная стоимость из-за использования нескольких биомаркеров и психологическая нагрузка на пациента, ожидающего получения результатов во втором триместре (16-18 недель беременности). Более того, 5% нормальных беременных с ложноположительными результатами подвергаются ненужным инвазивным диагностическим процессам, таким как амниоцентез или взятие проб ворсинок хориона (CVS) для выявления DS плода.Такие инвазивные диагностические тесты дороги, требуют квалифицированного технического персонала и несут риск выкидыша примерно в 1% [5,6]. Таким образом, неинвазивный пренатальный тест, позволяющий проводить прямое исследование
Анализгенетического материала плода в материнской крови был исследован как альтернативный метод, позволяющий снизить потребность в инвазивных процедурах и повысить эффективность текущих скрининговых тестов на СД плода.
Циклические нуклеотидфосфодиэстеразы (PDE) катализируют гидролиз циклического аденозин-30,50-монофосфата (cAMP) и / или циклического 30,50-монофосфата гуанозина (cGMP) [7].Ген PDE9A человека, расположенный на хромосоме 21q22.3, кодирует cGMP-специфический PDE, который экспрессируется в большинстве тканей, но не в крови [8,9]. Благодаря своему расположению и вкладу в регуляцию устойчивых клеточных концентраций циклических нуклеотидов, PDE9A является возможным геном-кандидатом для таких заболеваний, как биполярное аффективное расстройство [9], и Guipponi et al. предположили, что его сверхэкспрессия может быть вовлечена в DS [9]. Недавно Chim et al. провели систематический поиск специфичных для плода эпигенетических маркеров на 21 хромосоме [10], в ходе которого обнаружили, что область PED9A полностью метилирована в материнской крови (M-PED9A) и неметилирована в тканях плода (плаценты) (U-PED9A). .Таким образом, они сообщили, что этот маркер не зависит от пола и генотипа плода и, следовательно, может быть применен ко всем парам плод-мать для неинвазивного обнаружения последовательностей плода на хромосоме 21. Однако полезность PED9A в неинвазивном пренатальном периоде обнаружение DS плода еще не было подтверждено клинически.
Целью этого исследования было оценить точность неинвазивного обнаружения DS плода с использованием тканеспецифического метилирования PDE9A и оценить потенциал PDE9A в качестве нового биомаркера для обнаружения DS плода в первом триместре.
Материалы и методы
Заявление об этике
Это исследование было проведено в соответствии с принципами, изложенными в Хельсинкской декларации. Соответствующее одобрение институционального наблюдательного совета для этого исследования было получено от этического комитета больницы общего профиля Cheil (# CGH-IRB-2008-43). Письменное информированное согласие было получено от каждого участника перед забором крови для взятия образцов и последующего анализа.
Участники исследования и образцы
Мы провели вложенное исследование «случай-контроль» с участием женщин, участвовавших в исследовании неинвазивной пренатальной диагностики (CNPD) больницы общего профиля Cheil. Участники CNPD были набраны с 2008 года для неинвазивной пренатальной диагностики редких и неизлечимых заболеваний плода. Участниками были женщины, которые получали дородовую помощь в больнице общего профиля Cheil. Для текущего исследования 108 женщин были отобраны из более широкой выборки из 793 женщин, включенных в CNPD, в соответствии с критериями, описанными ниже.Все беременности были одиночными на сроке 12 недель или ранее в период с октября 2008 года по май 2009 года.
Группа пациентов состояла из 18 женщин, у которых впоследствии было установлено, что вынашивание DS-плода с помощью амниоцентеза или CVS для кариотипирования плода. Каждый случай был объединен с пятью контролями, которые были сопоставлены в соответствии с неделей беременности при заборе крови (Таблица S1). В контрольную группу (n = 90) вошли женщины, родившие здоровых нормальных новорожденных в срок (37 недель беременности и более) без медицинских или акушерских осложнений, таких как гипертония, диабет, почечная недостаточность, врожденные аномалии или гибель плода.Перед забором крови матери было рекомендовано ультразвуковое исследование для определения жизнеспособности каждой одноплодной беременности и подтверждения гестационного возраста, рассчитанного с момента последней менструации. Записи о матери, плодах и младенцах собирались проспективно и сохранялись в электронной базе данных. Ни у одного из участников не было ранее существовавших
человек.гипертония, сахарный диабет, заболевание печени или хроническое заболевание почек.
Изоляция плазмы и ДНК
Десять миллилитров периферической крови каждого участника собирали в пробирки с этилендиаминтетрауксусной кислотой (ЭДТА).Сразу после отбора пробы материнской периферической крови центрифугировали при 1600 g в течение 10 минут при 4 ° C, а часть плазмы повторно центрифугировали при 16000 g в течение 10 минут, чтобы минимизировать любое дополнительное высвобождение материнской ДНК. Циркулирующую ДНК плода экстрагировали из 1,5 мл материнской плазмы с помощью набора QIAamp DSP Virus Kit (Qiagen, Hilden, Германия) в соответствии с рекомендациями производителя. Каждый образец ДНК элюировали 50 мл стерильной воды, свободной от ДНКазы. Образцы были закодированы для последующего слепого анализа.
Количественная полимеразная цепная реакция, специфичная для метилирования (qMSP)
Различия в метилировании PDE9A в клетках материнской крови и плаценте были подтверждены бисульфитным геномным секвенированием (рис. 1, методы S1). Уровни M-PDE9A и U-PDE9A в материнской плазме измеряли с помощью количественных тестов MSP, как описано ранее [10,11].
ДНК, выделенная из плазмы, была превращена в бисульфит с использованием набора для метилирования ДНК EZ (Zymo Research, Orange, CA, USA), а затем элюирована в 30 мл.Для подтверждения превращения бисульфита в качестве положительного и отрицательного контролей использовали синтетический ДНК-олигонуклеотид для области U-PDE9A и геномную ДНК, выделенную из клеток периферической крови, соответственно. Раствор для реакции ПЦР содержал 12,5 мл iQSupermix (Bio-Rad, Геркулес, Калифорния, США), 200 нМ гидролизный зонд (Applied Biosystems, Фостер-Сити, Калифорния, США), праймеры 400 нМ (Applied Biosystems, Фостер-Сити, Калифорния, США) и 5 мл преобразованной ДНК на 25 мл общего реакционного объема. Праймеры и зонды гидролиза, используемые для анализа qMSP, были следующими; для M-PDE9A, прямой праймер: 5′-CGG TGA GTG CGC GTC GC-3 ‘, обратный праймер: 5′-CCA ACC ATC CCG AAA AAG CG-3′ и зонд: 5’-TTC GGT GAC GTT ACG CGG T-3 ‘, для U-PDE9A, прямой праймер: 5′- GGT TTG TTT TGG TGA GTG TGT GTC GT-3′, обратный праймер: 5’- CCC AAC CAT CCC AAA AAA GCA-3 ‘и зонд: 5 ‘-TTT GTT TGG TGA TGT TAT GTG GTT T-3’.Зонды для M-PDE9A и U-PDE9A были дважды помечены 6-карбоксифлуоресцеином (FAM) и нефлуоресцентным гасителем, связывающимся с малой бороздкой (MGBNFQ). Температурный профиль состоял из начальной стадии денатурации 95 ° C в течение 10 минут с последующими 50 циклами 95 ° C в течение 15 секунд, 60 ° C в течение 30 секунд и 72 ° C в течение 30 секунд. Калибровочные кривые готовили для каждого анализа путем серийных разведений одноцепочечных синтетических ДНК-олигонуклеотидов, специфичных для ампликонов M-PDE9A и U-PDE9A. Последовательности синтетической ДНК были следующими; для M-PDE9A: 5′-CGG TGA GTG CGC GTT GCG GGT TTT GTT CGG TGA CGT TAC GCG GTT TTT TCG Ttt TTT CGG GAT GGT TGG-3 ‘, для U-PDE9A: 5’-GGT TTG TTT TGG TGA GTG TGT GTT GTG GGT TTT GTT TGG TGA TGT TAT GTG GTT TTT TTG TTT TTT TGG GAT GGT TGG G-3 ‘.
Уровни были рассчитаны как копии / мл, как описано ранее [12]. Были приняты строгие меры предосторожности для предотвращения загрязнения, и в каждый анализ были включены несколько проб воды с отрицательным контролем. Чтобы уменьшить межэкспериментальные вариации, каждую экстракцию повторяли в трех экземплярах. Окончательные данные отражают средние значения результатов (таблицы S2 и S3). Все образцы были проанализированы вслепую.
Рисунок 1. Бисульфитное геномное секвенирование PDE9A. Красные символы в последовательностях указывают на сайты метилирования CpG гена PDE9A.Метилированные сайты CpG PDE9A были обнаружены в клетках материнской крови и тканях плаценты. Неметилированные сайты CpG PDE9A обнаружены только в тканях плаценты. Желтые прямоугольники указывают области, которые были амплифицированы с помощью полимеразной цепной реакции, специфичной для метилирования. DOI: 10.1371 / journal.pone.0027709.g001
Статистический анализ
Клинические характеристики исследуемой популяции сравнивали между случаями и контрольной группой, используя U-критерий Манна-Уитни и X-критерий.Точность определения DS плода анализировалась с помощью таких факторов, как уровень U-PDE9A и индекс неметилирования (UI). UI рассчитывается как {уровень U-PDE9A / (уровень M-PDE9A + уровень U-PDE9A)} X100. Точность определения СД плода определялась по результатам кариотипирования плода. Анализ кривой рабочих характеристик приемника (ROC) был проведен для оценки оптимального значения отсечки, как описано в нашем предыдущем исследовании [13]. Оптимальный предел был установлен на уровне 5% ложноположительных результатов для сравнения с точностью текущего скринингового теста на DS плода.Чувствительность, положительная прогностическая ценность (PPV), отрицательная прогностическая ценность (NPV) и отношение шансов (OR) были рассчитаны с 95% доверительными интервалами (CI) с использованием Табличного калькулятора EpiMax (http://www.healthstrategy.com/epiperl /epiperl.htm). Общая точность оценивалась по площади под кривой ROC (AUC). Множественный логистический регрессионный анализ использовался для оценки значений уровней U-PDE9A и UI как факторов риска развития СД плода с учетом возможных смешивающих факторов. Возможные смешивающие факторы включали возраст матери, индекс массы тела и
недоношенность на момент забора крови.Были рассчитаны скорректированные OR (adjOR) и их 95% доверительный интервал. Во всех тестах для статистической значимости были установлены пороги P <0,05. Статистический анализ выполняли с использованием статистического пакета для социальных наук 12.0 (SPSS Inc., Чикаго, Иллинойс, США).
Результаты
Клинические характеристики приведены в таблице 1. При заборе крови возраст матери, беременность и индекс массы тела существенно не различались между случаями и контрольной группой (P> 0.05 для всех). Средний срок беременности составлял 7,5 недель как в клинической, так и в контрольной группах. Сорок четыре процента участников экспериментальной группы и 41% участников контрольной группы были нерожавшими; эта разница между случаями и контролем не была значимой (P = 0,799). Соотношение полов плода и употребление табака также не различались между двумя группами (P> 0,05 для обеих).
При анализе уровней M-PDE9A и U-PDE9A в зависимости от пола плода медианные уровни M-PDE9A составили 1956.0 (межквартильный диапазон: 1592,5-2411,2) и 2023,1 (межквартильный диапазон: 1650,0–2310,3) копий / мл у участников мужского и женского пола, вынашивающих плод,
Таблица 1. Клинические характеристики в случаях и в контрольной группе.
Характеристика Случай (N = 18) Контроль (N = 90) Значение P
Употребление табака 1 (5,6) 6 (6,7) 0,999b
Значения являются медианными (межквартильный размах) или числом (%). a: U-критерий Манна-Уитни, b: критерий x2. DOI: 10.1371 / journal.pone.0027709.t001
соответственно. Уровни U-PDE9A составляли 213,6 (межквартильный диапазон: 155,1–308,4) и 209,6 (межквартильный диапазон: 156,3–283,5) копий / мл у мужчин и женщин, вынашивающих плод, соответственно. Уровни M-PDE9A и U-PDE9A достоверно не различались между полами плода (P> 0,05 для всех, рис. 2). При анализе уровней M-PDE9A и U-PDE9A в соответствии с кариотипом плода, уровни M-PDE9A не различались между случаями DS и контролем [1854.3 (межквартильный размах: 1653,3–2446,3) по сравнению с 2004,5 (межквартильный размах: 1605,2–2316,9) копий / мл, P = 0,928, рис. 3]. Однако уровни U-PDE9A были значительно выше в случаях по сравнению с контролем [356,8 (межквартильный размах: 314,8–437,4) против 194,7 (межквартильный размах: 143,0–263,6) копий / мл, P <0,001, рис. 3].
Точности уровня U-PDE9A и UI для обнаружения DS плода показаны в таблице 2. Пороговое значение для каждого фактора было установлено на уровне 5% ложноположительных результатов с помощью ROC-анализа.Чувствительность, PPV и NPV сравнивались с одинаковой частотой ложноположительных результатов.
КривыеROC уровня U-PDE9A и UI представлены на рис. 4. Уровень отсечения U-PDE9A 320 копий / мл имел чувствительность 77,8%, PPV 73,7% и NPV 95,5% при дифференциации женщин с DS. плода от женщины, носящей нормальный плод, и AUC составила 0,907 (95% ДИ: 0,833–0,981) со стандартной ошибкой (SE) 0,038 (P <0,001). Значение отсечки UI, равное 14, имело чувствительность 83,3%, PPV - 75.0%, NPV 96,6% и AUC была 0,927 (95% ДИ: 0,851–1,003) с SE 0,039 (P <0,001). Эти данные были подтверждены с использованием образцов кариотипов (Таблица S1).
Мы проанализировали точность уровней U-PDE9A и UI для выявления DS плода на основании гестационных недель при заборе крови (таблица 3). Чувствительность уровня U-PDE9A была выше на 9-12 неделе беременности, чем на 5-8 неделе беременности, тогда как чувствительность UI была выше на 5-8 неделе беременности, чем на 9-12 неделе беременности.Специфичность обоих тестов была выше на 912 неделе беременности, чем на 5-8 неделе беременности. Все случаи, показывающие ложноположительные и ложноотрицательные результаты, наблюдались при сроке беременности 10 недель или ранее (таблица 4).
Мы проанализировали связи между каждым фактором и риском СД. Как указано в таблице 5, риск DS был значительно увеличен у женщин со значениями, превышающими пороговые значения, по сравнению с женщинами, значения которых были меньше пороговых значений для уровня U-PDE9A или UI (OR [95% CI]: 59.5 [12.1-340.7] для уровня U-PDE9A, 85.0 [15.5-564.2] для UI). После внесения поправки на возможные мешающие факторы, такие как возраст матери, индекс массы тела и недоношенность при заборе крови, дополнительные значения уровня U-PDE9A и UI составили 46,2 (95% ДИ: 7,8-151,6) и 63,7 (95% ДИ: 23,2- 206.7) соответственно. Женщины с уровнями U-PDE9A и UI, превышающими пороговые значения, имели значительно более высокий риск развития СД плода как в нескорректированном, так и в скорректированном анализе, по сравнению с женщинами со значениями ниже пороговых значений.
Обсуждение
Наши результаты демонстрируют, что U-PDE9A и UI являются эффективными биомаркерами для неинвазивного выявления DS плода во время
.Рисунок 2. Уровни M-PDE9A и U-PDE9A в материнской плазме в зависимости от пола плода. Верхний и нижний пределы прямоугольников и линии поперек прямоугольников указывают 75/25 процентили и медианы, соответственно. Верхняя и нижняя планки ошибок указывают на 90-й и 10-й процентили соответственно.Кружками обозначены выбросы. Уровни анализировали с помощью U-критерия Манна-Уитни. DOI: 10.1371 / journal.pone.0027709.g002
Рисунок 3. Уровни M-PDE9A и U-PDE9A в материнской плазме в соответствии с кариотипом плода. Верхний и нижний пределы прямоугольников и линии поперек прямоугольников указывают 75/25 процентили и медианы, соответственно. Верхняя и нижняя планки ошибок указывают на 90-й и 10-й процентили соответственно. Уровни анализировали с помощью U-критерия Манна-Уитни.DOI: 10.1371 / journal.pone.0027709.g003
первый триместр беременности. Мы определили, что уровни U-PDE9A и UI были значительно повышены у беременных женщин, вынашивающих DS-плоды, по сравнению с женщинами, вынашивающими нормальные плоды в первом триместре, независимо от пола плода. Более того, беременные женщины с высокими значениями U-PDE9A и UI подвергались повышенному риску вынашивания плода DS. Таким образом, мы предполагаем, что U-PDE9A и UI могут быть полезными биомаркерами для неинвазивного обнаружения DS плода с использованием циркулирующей ДНК плода из материнской плазмы, независимо от пола плода.
Текущие скрининговые тесты для обнаружения DS плода увеличивают частоту выявления за счет интеграции нескольких методов, таких как измерение затылочной прозрачности и анализы крови на многочисленные маркеры материнской сыворотки, включая альфа-фетопротеин, неконъюгированный эстриол, хорионический гонадотропин человека и ингибин-А, но более высокий процент положительных результатов на экране (примерно 16–22%) [3,4]. Более того, диагностический тест в настоящее время требует получения образцов эмбриональных клеток непосредственно из матки для генетического анализа либо с помощью CVS между 11 и 14 неделями беременности, либо через амниоцентез через 15 недель.Однако эти инвазивные процедуры представляют небольшой, но значительный риск выкидыша при нормальной беременности [5,6]. Следовательно, разработка —
Таблица 2. Полезность измерений для выявления синдрома Дауна у плода.
Чувствительность отсечки PPV NPV
Уровень U-PDE9A (копий / мл) 320 0,778 (0,557-0,891) 0,737 (0,537-0,863) 0,955 (0,912-0,982)
Индекс неметилирования 14 0,833 (0,635-0,940) 0,750 (0.563-0,855) 0,966 (0,923-0,990)
Граница была установлена на уровне 5% ложных срабатываний по анализу кривой ROC. Для сравнения точности обнаружения факторов была рассчитана чувствительность, положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) с эквивалентной частотой ложноположительных результатов. Число в скобках указывает 95% доверительный интервал. DOI: 10.1371 / journal.pone.0027709.t002
неинвазивных пренатальных тестов для обнаружения СД с использованием циркулирующей фетальной ДНК в плазме матери рассматривается как потенциальная альтернатива для улучшения существующих скрининговых тестов и уменьшения необходимости в инвазивных процедурах, таких как амниоцентез или сердечно-сосудистые заболевания.
Эпигенетика — это изучение молекулярных явлений, которые влияют на экспрессию генов, но не связаны с изменениями в последовательностях ДНК. Наиболее изученным эпигенетическим явлением является процесс метилирования ДНК, который подавляет экспрессию генов и
Рис. 4. ROC-кривые уровня U-PDE9A и индекса неметилирования. Кривые ROC индекса неметилирования и уровня U-PDE9A представлены синими и красными линиями соответственно. DOI: 10.1371 / journal.pone.0027709.g004
Таблица 3. Точность обнаружения по неделям беременности.
Гестационные недели Случай (правильный N / общий N) Контроль (правильный N / общий N) Чувствительность Специфичность PPV NPV
U-PDE9A Уровень 5-8 10/13 61/65 0,769 (0,509-0,925) 0,938 (0,886-0,970) 0,714 (0,472-0,859) 0,953 (0,900-0,985)
9-12 4/5 24/25 0,800 (0,347-0,982) 0,960 (0,869-0,996) 0,800 (0,347-0,982) 0,960 (0,869-0,996)
Индекс неметилирования 5-8 11/13 61/65 0.846 (0,588-0,970) 0,938 (0,887-0,963) 0,733 (0,510-0,841) 0,968 (0,915-0,994)
9-12 4/5 24/25 0,800 0,960 0,800 0,960
(0,347-0,982) (0,869-0,996) (0,347-0,982) (0,869-0,996)
PPV, положительная прогностическая ценность; NPV, отрицательная прогностическая ценность. Число в скобках указывает 95% доверительный интервал. DOI: 10.1371 / journal.pone.0027709.t003
демонстрирует тканеспецифические паттерны [14]. В предыдущем исследовании Poon et al.продемонстрировали возможность разработки маркеров ДНК плода на основе различных паттернов метилирования ДНК между тканями матери и плода [15]. Эта стратегия привела к признанию того, что ген SERPINB5 на хромосоме 18, который кодирует маспин, гипометилирован в плаценте, но гиперметилирован в клетках материнской крови [15]. Таким образом, было высказано предположение, что измерение соотношения однонуклеотидных полиморфизмов (SNP) в гипометилированной версии гена SERPINB5 может позволить выявить трисомию 18 плода [16].
Подобные исследования были выполнены для неинвазивного пренатального обнаружения СД плода с использованием циркулирующей ДНК плода. Недавно Papageorgiou et al. сообщили, что применение коэффициента метилирования плода привело к правильному диагнозу DS плода [17], а Tong et al. сообщили, что доза эпигенетико-генетической хромосомы
с использованием гиперметилированного HLCS и унаследованного от отца аллеля SNP плода может быть применен для пренатальной диагностики трисомии 21 как для плодов мужского, так и женского пола [18].Однако эти исследования проводились с образцами материнской крови, взятыми в конце первого или второго триместра (11,1–14,4 недели беременности у Папагеоргиу и др. [17]; 12–21 неделя беременности у Тонга и др. [18] ]), а образцы были небольшими (14 случаев и 26 контролей в слепом анализе Папагеоргиу и др. [17]; 14 случаев и 33 контроля в Тонге и др. [18]). Более того, в этих исследованиях не учитывались сроки гестационных недель при заборе крови, что может повлиять на концентрацию циркулирующей ДНК плода [17,18].Несмотря на эти ограничения, предыдущие исследования показывают, что диагностические стратегии с использованием специфичных для плода эпигенетических маркеров могут быть более эффективными по сравнению с современными методами биохимического скрининга СД плода. Таким образом, поиск специфичных для плода эпигенетических маркеров на хромосоме 21
Таблица 4. Случаи получения ложноположительных и ложноотрицательных результатов.
Факторы Состояние Значение Недели беременности Кариотип
Уровень U-PDE9A (отсечка: 320 копий / мл) Ложноотрицательный (N = 4) 228.4 6 47, XX, + 21
280,6 6 47, XX, + 21
186,6 7 47, XY, + 21
255,9 9 47, XX, + 21
Ложноположительные (N = 5) 361,6 6 46, XX
381,1 7 46, XY
345,9 7 46, XX
351,8 8 46, XX
366,5 10 46, XY
Индекс неметилирования (отсечка: 14) Ложноотрицательный (N = 3) 9,5 6 47, XX, + 21
8.7 7 47, XY, + 21
12,9 9 47, XX, + 21
Ложноположительные (N = 5) 16,5 6 46, XY
15,8 7 46, XX
14,9 8 46, XY
14,4 8 46, XX
15,3 10 46, XY
doi: 10.1371 / journal.pone.0027709.t004
Таблица 5. Коэффициенты вероятности синдрома Дауна у плода.
Управление делом скорректировано ИЛИ
(N = 18) (N = 90) Не скорректированное ОШ (95% ДИ) (95% ДИ) *
14 и выше 15 5 85.Скорректировано с учетом возраста матери, индекса массы тела и первородящих при заборе крови. DOI: 10.1371 / journal.pone.0027709.t005
важны для неинвазивного пренатального обнаружения СД плода. Недавно Chim et al. провели систематический поиск таких маркеров на 21 хромосоме [10] и сообщили, что 22 из 114 изученных геномных областей были по-разному метилированы между тканями матери и плода (плаценты). На основе этого тканеспецифического метилирования они предложили использовать маркеры ДНК плода, такие как U-PDE9A, которые полностью метилированы в клетках материнской крови, но неметилированы в плаценте, для неинвазивного пренатального обнаружения фетальных последовательностей на хромосомах. 21.Однако полезность таких маркеров в неинвазивном пренатальном тесте на DS плода еще не подтверждена.
В настоящем исследовании мы исследовали полезность и точность уровней U-PDE9A и UI для использования в неинвазивном пренатальном обнаружении СД с использованием циркулирующей ДНК плода из первого триместра. Мы провели вложенное исследование случай-контроль, контролирующее гестационные недели при заборе крови; каждый случай был тщательно сопоставлен с 5 контролями в соответствии с неделями беременности при заборе крови (Таблица S1).Кроме того, все образцы были получены в течение первого триместра (12 недель беременности или меньше), и их количество было больше, чем в предыдущих исследованиях [17,18]. В этом исследовании уровни U-PDE9A и UI были значительно повышены в течение первого триместра у беременных женщин, вынашивающих DS-плоды, независимо от пола плода. Частота выявления СД плода с помощью этих двух факторов была выше, чем у сывороточных маркеров скрининга и измерений затылочной прозрачности, которые обычно выполняются в первом триместре [3,4].Более того, частота обнаружения U-PDE9A и UI для DS плода была намного выше, чем у маркеров, специфичных для Y-хромосомы, таких как DYS14 или SRY, в материнской сыворотке [19]. Кроме того, маркеры, специфичные для Y-хромосомы, можно использовать только для плодов мужского пола. Таким образом, мы предполагаем, что уровни U-PDE9A и UI являются эффективными маркерами для использования в неинвазивном пренатальном выявлении СД в течение первого триместра независимо от пола плода, и на самом деле эти маркеры могут обнаруживать СД плода более эффективно, чем существующие скрининговые тесты для выявления СД. DS плода.Однако чувствительность уровня U-PDE9A и UI была ниже или схожей (77,8% для уровней U-PDE9A и 83,3% для UI), чем у четырехкратных скрининговых тестов во втором триместре (81%). Более того, ложноположительные и ложноотрицательные результаты наблюдались в сроке гестации или раньше. Соответственно, неинвазивное обнаружение DS плода с использованием этих маркеров может иметь ограниченное клиническое применение до 10 недель беременности. Следовательно, повышение скорости обнаружения за счет применения других методов обнаружения, таких как цифровая ПЦР или прямое сравнение с ДНК-маркерами плода на эталонных хромосомах, может облегчить клиническое использование этих маркеров.
При неинвазивном пренатальном тестировании анализ генетических локусов плода в материнской плазме по-прежнему проблематичен, поскольку циркулирующий внутриутробный
ДНК присутствует в небольших количествах. Для решения этой проблемы многие исследователи предложили такие методы, как фракционирование по размеру [20,21]. Предыдущие исследования показали, что более 99% циркулирующей ДНК плода имеет длину менее 313 п.н., тогда как циркулирующая материнская ДНК значительно длиннее [20,21]. Это открытие делает возможным обогащение циркулирующей ДНК плода путем фракционирования по размеру с использованием ряда методов.Проще говоря, гель-электрофорез ДНК, экстрагированной из материнской плазмы, был использован для отбора низкомолекулярной ДНК. Другие методы включают использование наборов и колонок, которые полагаются либо на неспособность ДНК с большой молекулярной массой проходить, либо на удержание ДНК с низкой молекулярной массой [22,23]. В недавних исследованиях Clausen et al. сообщили, что использование DSP Virus Kit привело к более высокому выходу циркулирующей ДНК плода по сравнению с общей циркулирующей ДНК из материнской плазмы [22]. Legler et al.предположил, что DSP Virus Kit является оптимальным методом для извлечения высоких выходов циркулирующей ДНК плода из общей плазмы [23]. В этом исследовании мы использовали набор DSP Virus Kit для извлечения циркулирующей ДНК плода из материнской плазмы. Таким образом, мы смогли обнаружить идентификаторы ДНК плода, такие как U-PDE9A, уже на пяти неделе беременности.
Насколько нам известно, это первое исследование, в котором оценивалась точность неинвазивного определения СД плода с использованием анализа U-PDE9A в циркулирующей ДНК плода из материнской плазмы в первом триместре.Наши данные показывают, что U-PDE9A и UI могут быть полезными маркерами для неинвазивного пренатального обнаружения СД плода во всех парах плод-мать, независимо от пола плода. Кроме того, высокие уровни U-PDE9A и UI могут быть подходящими биомаркерами для выявления беременных женщин, вынашивающих плод с DS. Соответственно, эти маркеры могут быть полезны при разработке эффективных и надежных тестов для неинвазивного обнаружения СД плода. Однако использование этого метода может создать этические и социальные проблемы, поскольку результаты могут повлиять на решения о прерывании или продолжении беременности.Следовательно, использование этого метода следует тщательно продумать в клинической ситуации и не следует использовать в настоящих клинических условиях, если не будут проведены дополнительные исследования. Кроме того, этот метод требует дальнейшего совершенствования для достижения более высокой чувствительности и специфичности. Кроме того, это исследование ограничено небольшим размером выборки и включением только корейских пациентов. Следовательно, необходимо будет провести более крупномасштабное исследование среди различных этнических групп, чтобы помочь внедрить диагностическую стратегию, используемую в этом исследовании.
Дополнительная информация
Методы S1 Включены обработка образцов и экстракция ДНК для бисульфитного геномного секвенирования PDE9A, бисульфитного геномного секвенирования PDE9A и
предел обнаружения для количественной полимеразной цепной реакции, специфичной для метилирования.
Образцы ДНК таблицы S1 от участников этого исследования.
Таблица S2 Уровни неметилированного PDE9A, полученные из 108 образцов.
Таблица S3 Уровни метилированного PDE9A, полученные из 108 образцов.
Благодарности
Мы благодарим следующих врачей и их сотрудников, которые потратили время и усилия на участие в этом исследовании: Чон Ёль Хан, доктор медицинских наук, Чон Сик Чой, доктор медицинских наук, Хён Кён Ан, доктор медицины, доктор философии, Джин Хун Чунг, MD, PhD, Мин Хён Ким, MD, PhD, Ю Чон Хан, MD, Да Ын Ли, PhD, Джин У Ким, MS, Бом И Ли, MS, До Джин Ким, MS, Джу Ён Пак, BS, Ын Ён Чхве, BS, Ён У Ли, BS, А Рам О, BS, и Со Мин Со, BS.Мы благодарим Daehun Peah, MD, PhD и In Soo Kang, MD, PhD за статистический анализ данных.
Авторские взносы
Задумал и спроектировал эксперименты: JHL HMR. Проведены эксперименты: SYK SYL MJK. Проанализированы данные: JHL SYP SWL. Предоставленные реагенты / материалы / инструменты для анализа: YJH SWL JHC MYK JHY. Написал статью: JHL SWL HMR.
Список литературы
1. Дрисколл Д.А., Гросс С. (2009) Клиническая практика.Пренатальный скрининг на анеуплоидию. N Engl J Med 360: 2556-2562.
2. Hook EB, Cross PK, Schreinemachers DM (1983) Частота хромосомных аномалий при амниоцентезе и у новорожденных живорожденных. JAMA 249: 2034-2038.
3. Мэлоун Ф. Д., Каник Дж. А., Болл Р. Х., Ниберг Д. А., Комсток С. К. и др. (2005) Скрининг на синдром Дауна в первом или втором триместре или в обоих случаях. N Engl J Med 353: 2001-2011.
4. Wapner R, Thom E, Simpson JL, Pergament E, Silver R, et al.(2003) Скрининг первого триместра на трисомии 21 и 18. N Engl J Med 349: 1405-1413.
5. Mujezinovic F, Alfirevic Z (2007) Связанные с процедурой осложнения амниоцентеза и взятия проб ворсинок хориона: систематический обзор. Obstet Gynecol 110: 687-694.
6. Редди У. М., Меннути М. Т. (2006) Включение исследований синдрома Дауна в первом триместре беременности в пренатальный скрининг: краткое содержание семинара Национального института здоровья детей и человеческого развития.Obstet Gynecol 107: 167-173.
7. Soderling SH, Beavo JA (2000) Регулирование передачи сигналов цАМФ и цГМФ: новые фосфодиэстеразы и новые функции. Curr Opin Cell Biol 12: 174-179.
8. Фишер Д.А., Смит Дж. Ф., Пиллар Дж. С., Сен-Дени С.Х., Ченг Дж. Б. (1998) Выделение и характеристика PDE9A, новой цГМФ-специфической фосфодиэстеразы человека. J Biol Chem 273: 15559-15564.
9. Гиппони М., Скотт Х.С., Кудо Дж., Кавасаки К., Сибуя К. и др.(1998) Идентификация и характеристика нового гена циклической нуклеотидной фосфодиэстеразы (PDE9A), который отображается на 21q22.3: альтернативный сплайсинг транскриптов мРНК, геномная структура и последовательность. Hum Genet 103: 386-392.
10. Чим С.С., Джин С., Ли Т.Й., Лун Ф.М., Ли В.С. и др. (2008) Систематический поиск маркеров метилирования плацентарной ДНК на хромосоме 21: к основанному на материнской плазме эпигенетическому тесту на трисомию плода 21. Clin Chem 54: 500-511.
11.Лим Дж. Х., Пак С. И., Ким С. И., Ким Д. Д., Чой Дж. (2011) Эффективное определение пола плода с помощью циркулирующей ДНК плода в плазме матери в первом триместре. FASEB J doi: 10.1096 / fj.11-191429.
12. Lo YM, Tein MS, Lau TK, Haines CJ, Leung TN, et al. (1998) Количественный анализ ДНК плода в плазме и сыворотке матери: значение для неинвазивной пренатальной диагностики. Am J Hum Genet 62: 768-775.
13. LimJH, Kim SY, Park SY, YangJH, Kim MY, et al.(2008) Эффективное прогнозирование преэклампсии по комбинированному соотношению факторов, связанных с ангиогенезом. Obstet Gynecol 111: 1403-1409.
14. Ракян В.К., Даун Т.А., Торн Н.П., Фличек П., Кулеша Э. и др. (2008) Интегрированный ресурс для полногеномной идентификации и анализа тканеспецифичных дифференциально метилированных областей (tDMR) человека. Genome Res 18: 1518-1529.
15. Poon LL, Leung TN, Lau TK, Chow KC, Lo YM (2002) Дифференциальное метилирование ДНК между плодом и матерью как стратегия обнаружения ДНК плода в материнской плазме.Clin Chem 48: 35-41.
16. Чим С.С., Тонг Ю.К., Чиу Р.В., Лау Т.К., Леунг Т.Н. и др. (2005) Обнаружение плацентарной эпигенетической сигнатуры гена маспина в материнской плазме. Proc Natl Acad Sci U S A 102: 14753-14758.
17. Папагеоргиу Э.А., Карагригориу А., Цалики Э., Велиссариу В., Картер Н.П. и др. (2011) Коэффициент метилирования ДНК плода позволяет неинвазивно пренатально диагностировать трисомию 21. Nat Med 17: 510-513.
18.Тонг Ю.К., Чиу Р.В., Аколекар Р., Леунг Т.Ю., Лау Т.К. и др. (2010) Эпигенетико-генетический подход к дозировке хромосом для обнаружения трисомии 21 плода с использованием аутосомного генетического эталонного маркера. PLoS One 5: e15244.
19. Farina A, LeShane ES, Lambert-Messerlian GM, CanickJA, Lee T, et al. (2003) Оценка внеклеточной ДНК плода как маркера материнской сыворотки во втором триместре беременности с синдромом Дауна. Clin Chem 49: 239-242.
20. Чан К.С., Чжан Дж., Хуэй А.Б., Вонг Н., Лау Т.К. и др.(2004) Распределение ДНК матери и плода в плазме крови матери. Clin Chem 50: 88-92.
21. Ли Y, Циммерманн Б., Рустерхольц С., Канг А., Хольцгрев В. и др. (2004) Разделение по размерам циркуляторной ДНК в материнской плазме позволяет легко обнаруживать полиморфизмы ДНК плода. Clin Chem 50: 1002-1011.
22. Clausen FB, Krog GR, Rieneck K, Dziegiel MH (2007) Улучшение экстракции ДНК плода из материнской плазмы. Оценка системы магнитной экстракции NucliSens и набора QIAamp DSP Virus Kit по сравнению с мини-набором QIAamp DNA Blood.Пренат Диаг 27: 6-10.
23. Леглер Т.Дж., Лю З., Мавру А., Финнинг К., Громадникова И. и др. (2007) Отчет о семинаре по выделению ДНК из материнской плазмы. Пренат Диаг 27: 824-829.
общих тестов во время беременности | Johns Hopkins Medicine
Ваш лечащий врач может порекомендовать вам различные обследования, тесты и методы визуализации во время вашей беременности. Эти тесты предназначены для получения информации о здоровье вашего ребенка и могут помочь вам оптимизировать дородовой уход и развитие вашего ребенка.
Генетический скрининг
Многие генетические аномалии можно диагностировать еще до рождения. Ваш врач или акушерка могут порекомендовать генетическое тестирование во время беременности, если у вас или вашего партнера есть семейная история генетических нарушений. Вы также можете пройти генетический скрининг, если у вас был плод или ребенок с генетической аномалией.
Примеры генетических заболеваний, которые можно диагностировать до рождения:
Во время беременности доступны следующие методы обследования:
Тест на альфа-фетопротеин (AFP) или множественный маркер
Амниоцентез
Взятие проб ворсинок хориона
Внеклеточная ДНК плода
Чрескожный забор пуповинной крови (забор небольшой пробы крови плода из пуповины)
УЗИ
Пренатальные скрининговые тесты в первом триместре
Скрининг в первом триместре — это комбинация ультразвукового исследования плода и анализа крови матери.Этот процесс скрининга может помочь определить риск наличия у плода определенных врожденных дефектов. Скрининговые тесты можно использовать отдельно или с другими тестами.
Скрининг в первом триместре включает:
Ультразвук для определения прозрачности затылочной кости плода . При скрининге на прозрачность затылочной кости используется ультразвук для исследования области задней части шеи плода на предмет увеличения жидкости или утолщения.
Ультразвук для определения носовой кости плода .Носовая кость может не визуализироваться у некоторых детей с определенными хромосомными аномалиями, такими как синдром Дауна. Этот экран выполняется с помощью ультразвука на сроке от 11 до 13 недель беременности.
Анализы сыворотки (крови) матери . Эти анализы крови измеряют два вещества, обнаруженные в крови всех беременных женщин:
Белок плазмы, связанный с беременностью А . Белок, вырабатываемый плацентой на ранних сроках беременности.Аномальные уровни связаны с повышенным риском хромосомной аномалии.
Хорионический гонадотропин человека . Гормон, вырабатываемый плацентой на ранних сроках беременности. Аномальные уровни связаны с повышенным риском хромосомной аномалии.
При совместном использовании в качестве скрининговых тестов в первом триместре скрининг на затылочную прозрачность и анализы крови матери позволяют лучше определить, есть ли у плода врожденный дефект, например синдром Дауна (трисомия 21) и трисомия 18.
Если результаты этих скрининговых тестов в первом триместре отклоняются от нормы, рекомендуется генетическое консультирование. Для постановки точного диагноза могут потребоваться дополнительные исследования, такие как забор проб ворсинок хориона, амниоцентез, внеклеточная ДНК плода или другое ультразвуковое исследование.
Пренатальные скрининговые тесты во втором триместре
Пренатальный скрининг во втором триместре может включать несколько анализов крови, называемых множественными маркерами. Эти маркеры предоставляют информацию о вашем потенциальном риске рождения ребенка с определенными генетическими заболеваниями или врожденными дефектами.Скрининг обычно проводится путем взятия пробы крови между 15 и 20 неделями беременности (в идеале — от 16 до 18 недель). Несколько маркеров включают:
Скрининг AFP . Этот анализ крови, также называемый АФП материнской сыворотки, измеряет уровень АФП в крови во время беременности. АФП — это белок, обычно вырабатываемый печенью плода, который присутствует в жидкости, окружающей плод (амниотическая жидкость). Он проникает через плаценту и попадает в вашу кровь. Аномальный уровень AFP может указывать на:
Неправильный расчет срока родов, так как уровни меняются на протяжении всей беременности
Дефекты брюшной стенки плода
Синдром Дауна или другие хромосомные аномалии
Открытые дефекты нервной трубки, такие как расщелина позвоночника
Близнецы (белок вырабатывают более одного плода)
Эстриол .Это гормон, вырабатываемый плацентой. Его можно измерить в материнской крови или моче, чтобы определить состояние здоровья плода.
Ингибин . Это гормон, вырабатываемый плацентой.
Хорионический гонадотропин человека . Это также гормон, вырабатываемый плацентой.
Ненормальные результаты теста на AFP и другие маркеры могут означать, что необходимо дополнительное тестирование. Ультразвук используется для подтверждения основных этапов беременности и проверки позвоночника плода и других частей тела на наличие дефектов.Для постановки точного диагноза может потребоваться амниоцентез.
Поскольку скрининг множественных маркеров не является диагностическим, он не является 100-процентным. Это помогает определить, кому из населения следует предложить дополнительное тестирование во время беременности. Ложноположительные результаты могут указывать на проблему, когда плод действительно здоров. С другой стороны, ложноотрицательные результаты указывают на нормальный результат, когда у плода действительно есть проблемы со здоровьем.
Когда вы выполняете скрининговые тесты как в первом, так и во втором триместре, способность тестов выявлять отклонения выше, чем при использовании только одного независимого скрининга.Большинство случаев синдрома Дауна можно выявить при проведении обследований как в первом, так и во втором триместре.
УЗИ
Ультразвуковое сканирование — это диагностический метод, который использует высокочастотные звуковые волны для создания изображения внутренних органов. Во время беременности иногда проводят скрининговое ультразвуковое исследование, чтобы проверить нормальный рост плода и установить дату родов.
Когда проводят УЗИ при беременности?
УЗИ можно проводить в разное время на протяжении беременности по нескольким причинам:
Первый триместр
Для установления срока платежа (это наиболее точный способ определения срока платежа)
Для определения количества плодов и выявления структур плаценты
Для диагностики внематочной беременности или выкидыша
Для исследования анатомии матки и других органов малого таза
Для выявления аномалий плода (в некоторых случаях)
Промежуточное триместр (также называемое сканированием от 18 до 20 недель)
Для подтверждения срока родов (срок родов, установленный в первом триместре, редко меняется)
Для определения количества плодов и исследования структур плаценты
Для помощи в пренатальных исследованиях, таких как амниоцентез
Для исследования анатомии плода на предмет аномалий
Проверить количество околоплодных вод
Для исследования картины кровотока
Для наблюдения за поведением и активностью плода
Для измерения длины шейки матки
Для наблюдения за ростом плода
Третий триместр
Для наблюдения за ростом плода
Проверить количество околоплодных вод
Для проведения теста биофизического профиля
Для определения положения плода
Для оценки плаценты
Как проводится УЗИ?
Во время беременности можно проводить два вида УЗИ:
УЗИ брюшной полости .При УЗИ брюшной полости гель наносится на живот. Ультразвуковой датчик скользит по гелю на животе, создавая изображение.
Трансвагинальное УЗИ . При трансвагинальном УЗИ ультразвуковой преобразователь меньшего размера вводится во влагалище и опирается на заднюю часть влагалища для создания изображения. Трансвагинальное УЗИ дает более четкое изображение, чем УЗИ брюшной полости, и часто используется на ранних сроках беременности.
Какие методы ультразвуковой визуализации доступны?
Существует несколько типов методов ультразвуковой визуализации.Как наиболее распространенный вид, двухмерное ультразвуковое исследование дает плоское изображение одного аспекта ребенка.
Если требуется дополнительная информация, можно провести трехмерное ультразвуковое исследование. Этот метод, позволяющий получить трехмерное изображение, требует специальной машины и специальной подготовки. Трехмерное изображение позволяет врачу видеть ширину, высоту и глубину изображений, что может быть полезно во время диагностики. Трехмерные изображения также можно снимать и сохранять для последующего просмотра.
Новейшая технология — это четырехмерное ультразвуковое исследование, которое позволяет врачу визуализировать движение будущего ребенка в реальном времени.С помощью 4-D изображения трехмерное изображение постоянно обновляется, обеспечивая просмотр «живого действия». Эти изображения часто имеют золотой цвет, который помогает показать тени и блики.
Ультразвуковые изображения могут быть записаны на фото или видео для документирования результатов.
Каковы риски и преимущества ультразвуковой визуализации?
Ультразвук плода не имеет известных рисков, кроме легкого дискомфорта из-за давления датчика на живот или во влагалище.Во время процедуры не используется излучение.
Для трансвагинального ультразвукового исследования ультразвуковой датчик необходимо накрыть пластиковой или латексной оболочкой, что может вызвать реакцию у женщин с аллергией на латекс.
Ультразвуковая визуализация постоянно совершенствуется и совершенствуется. Как и в случае с любым другим тестом, результаты могут быть не совсем точными. Однако УЗИ может предоставить ценную информацию родителям и поставщикам медицинских услуг, помогая им вести беременность и ребенка и заботиться о них.Кроме того, ультразвуковое исследование дает родителям уникальную возможность увидеть своего ребенка до рождения, помогая им сблизиться и установить отношения на ранних этапах.
УЗИ плода иногда предлагается в немедицинских учреждениях, чтобы предоставить родителям изображения или видео на память. Хотя сама процедура УЗИ считается безопасной, необученный персонал может пропустить отклонение от нормы или дать родителям ложные заверения в благополучии их ребенка. Лучше всего, чтобы УЗИ проводил обученный медицинский персонал, который сможет правильно интерпретировать результаты.Если у вас есть вопросы, поговорите со своим врачом или акушеркой.
Амниоцентез
Амниоцентез включает взятие небольшого образца околоплодных вод, окружающих плод. Он используется для диагностики хромосомных нарушений и открытых дефектов нервной трубки, таких как расщелина позвоночника. Доступно тестирование на другие генетические дефекты и расстройства в зависимости от вашего семейного анамнеза и наличия лабораторных анализов во время процедуры.
Кто является идеальным кандидатом на амниоцентез?
Амниоцентез обычно предлагается женщинам между 15 и 20 неделями беременности, у которых есть повышенный риск хромосомных аномалий.К кандидатам относятся женщины, которым на момент родов будет старше 35 лет, или те, у кого были отклонения скринингового анализа материнской сыворотки.
Как проводится амниоцентез?
Амниоцентез включает в себя введение длинной тонкой иглы через брюшную полость в амниотический мешок для забора небольшой пробы околоплодных вод. В околоплодных водах содержатся клетки, выделенные плодом и содержащие генетическую информацию. Хотя конкретные детали каждой процедуры могут отличаться, типичный амниоцентез следует за этим процессом:
Ваш живот обработают антисептиком.
Ваш врач может назначить или не назначить местный анестетик для обезболивания кожи.
Ваш врач будет использовать ультразвуковую технологию, чтобы ввести полую иглу в амниотический мешок. Он или она возьмет небольшой образец жидкости для лабораторного анализа.
Во время или после амниоцентеза вы можете почувствовать спазмы. Следует избегать физических нагрузок в течение 24 часов после процедуры.
Женщины, беременные двойней или другими близнецами, нуждаются в заборе проб из каждого амниотического мешка для изучения каждого ребенка.В зависимости от положения ребенка и плаценты, количества жидкости и анатомии женщины иногда амниоцентез не может быть проведен. Затем жидкость отправляется в генетическую лабораторию, чтобы клетки могли расти и анализироваться. АФП также измеряется, чтобы исключить открытый дефект нервной трубки. Результаты обычно доступны от 10 дней до двух недель, в зависимости от лаборатории.
Взятие пробы ворсинок хориона (CVS)?
CVS — это пренатальный тест, который включает взятие образца некоторой части плацентарной ткани.Эта ткань содержит тот же генетический материал, что и плод, и ее можно проверить на хромосомные аномалии и некоторые другие генетические проблемы. Тестирование доступно для других генетических дефектов и нарушений, в зависимости от вашего семейного анамнеза и наличия лабораторных тестов во время процедуры. В отличие от амниоцентеза, CVS не дает информации об открытых дефектах нервной трубки. Таким образом, женщинам, перенесшим сердечно-сосудистые заболевания, также требуется повторный анализ крови между 16 и 18 неделями беременности для выявления этих дефектов.
Как выполняется CVS?
CVS может быть предложен женщинам с повышенным риском хромосомных аномалий или имеющим в семейном анамнезе генетический дефект, который можно проверить с помощью плацентарной ткани. CVS обычно выполняется между 10 и 13 неделями беременности. Хотя точные методы могут отличаться, процедура включает следующие шаги:
Ваш врач вставит небольшую трубку (катетер) через влагалище в шейку матки.
Используя ультразвуковую технологию, ваш врач направит катетер на место рядом с плацентой.
Ваш врач удалит часть ткани с помощью шприца на другом конце катетера.
Ваш врач может также выбрать выполнение трансабдоминальной CVS, которая включает введение иглы через брюшную полость в матку для отбора пробы плацентарных клеток. Вы можете почувствовать спазмы во время и после любого типа процедуры CVS. Образцы тканей отправляются в генетическую лабораторию для роста и анализа. Результаты обычно доступны от 10 дней до двух недель, в зависимости от лаборатории.
Что делать, если CVS невозможно?
Женщинам, имеющим близнецов или других близнецов, обычно требуется отбор проб из каждой плаценты. Однако из-за сложности процедуры и расположения плаценты CVS не всегда возможна или успешна при использовании множественных.
Женщинам, не являющимся кандидатами на CVS или не получившим точных результатов процедуры, может потребоваться последующий амниоцентез. Активная вагинальная инфекция, такая как герпес или гонорея, запретит процедуру.В других случаях врач может взять образец, в котором недостаточно ткани для роста в лаборатории, что приведет к неполным или неубедительным результатам.
Мониторинг плода
На поздних сроках беременности и родов ваш врач может захотеть контролировать частоту сердечных сокращений плода и другие функции. Мониторинг сердечного ритма плода — это метод проверки частоты и ритма сердцебиения плода. Средняя частота сердечных сокращений плода составляет от 120 до 160 ударов в минуту. Этот показатель может измениться по мере того, как плод реагирует на состояния матки.Аномальная частота сердечных сокращений плода может означать, что плод не получает достаточно кислорода, или указывать на другие проблемы. Аномальный рисунок также может означать, что необходимо экстренное кесарево сечение.
Как осуществляется мониторинг плода?
Использование фетоскопа (разновидность стетоскопа) для прослушивания сердцебиения плода является самым основным типом мониторинга сердечного ритма плода. Другой тип мониторинга выполняется с помощью портативного доплеровского прибора. Это часто используется во время дородовых посещений для подсчета частоты сердечных сокращений плода.Во время родов часто используется постоянный электронный мониторинг плода. Хотя конкретные детали каждой процедуры могут отличаться, стандартный электронный мониторинг плода следует за этим процессом:
- Гель
наносится на брюшную полость, чтобы действовать как среда для ультразвукового преобразователя.
Ультразвуковой датчик прикреплен к брюшной полости ремнями, чтобы он мог передавать сердцебиение плода на регистратор. Частота сердечных сокращений плода отображается на экране и печатается на специальной бумаге.
Во время сокращений внешний токодинамометр (устройство для наблюдения, которое помещается поверх матки с помощью ремня) может регистрировать характер сокращений.
Когда необходим внутренний мониторинг плода?
Иногда требуется внутренний мониторинг плода, чтобы обеспечить более точное определение частоты сердечных сокращений плода. Ваш мешок с водой (околоплодные воды) должен быть разбит, а шейка матки должна быть частично расширена, чтобы использовать внутренний мониторинг.Внутренний мониторинг плода включает введение электрода через расширенную шейку матки и прикрепление электрода к коже черепа плода.
Определение уровня глюкозы
Тест на глюкозу используется для измерения уровня сахара в крови.
Тест с провокацией глюкозы обычно проводится между 24 и 28 неделями беременности. Аномальный уровень глюкозы может указывать на гестационный диабет.
Что входит в тест на провокацию глюкозы?
Первоначальный одночасовой тест — это тест с провокацией глюкозы.Если результаты отклоняются от нормы, необходим тест на толерантность к глюкозе.
Как проводится тест на толерантность к глюкозе?
Вас могут попросить пить только воду в день проведения теста на толерантность к глюкозе. Хотя конкретные детали каждой процедуры могут отличаться, типичный тест на толерантность к глюкозе включает следующие шаги:
Первичный образец крови натощак будет взят из вашей вены.
Вам дадут выпить специальный раствор глюкозы.
Кровь будет браться в разное время в течение нескольких часов для измерения уровня глюкозы в организме.
Культура стрептококка группы B
Стрептококк группы B (GBS) — это тип бактерий, обнаруженный в нижних отделах половых путей примерно у 20 процентов всех женщин. Хотя СГБ-инфекция обычно не вызывает проблем у женщин до беременности, она может вызвать серьезные заболевания у матерей во время беременности. СГБ может вызвать хориоамнионит (тяжелую инфекцию плацентарных тканей) и послеродовую инфекцию.Инфекции мочевыводящих путей, вызванные СГБ, могут привести к преждевременным родам и родам или к пиелонефриту и сепсису.
GBS является наиболее частой причиной опасных для жизни инфекций у новорожденных, включая пневмонию и менингит. Новорожденные дети заражаются инфекцией во время беременности или через половые пути матери во время схваток и родов.
Центры по контролю и профилактике заболеваний рекомендуют обследовать всех беременных женщин на предмет вагинальной и ректальной колонизации GBS между 35 и 37 неделями беременности.Лечение матерей с определенными факторами риска или положительными культурами важно для снижения риска передачи СГБ ребенку. Младенцы, матери которых получают лечение антибиотиками в связи с положительным результатом теста на GBS, имеют в 20 раз меньшую вероятность развития болезни, чем дети, не получающие лечения.
.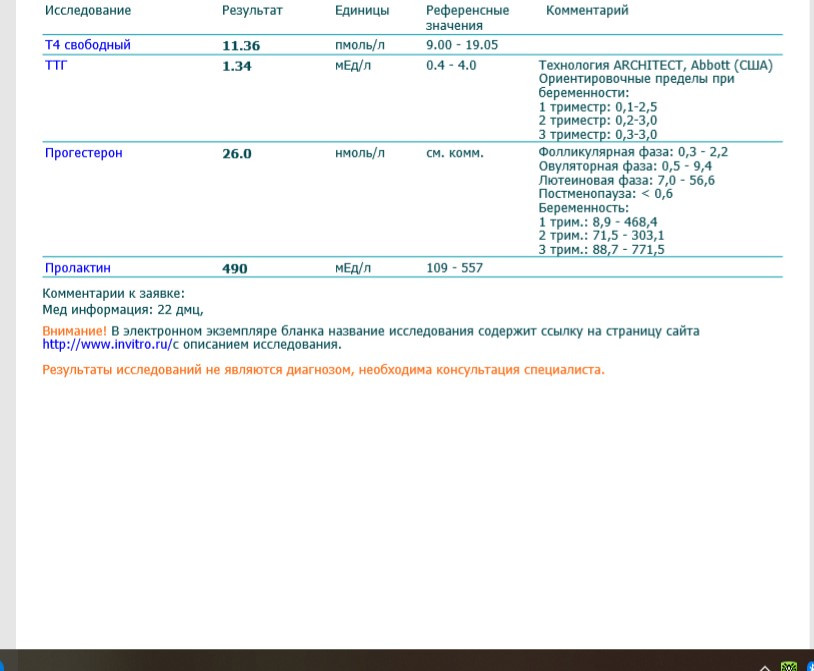
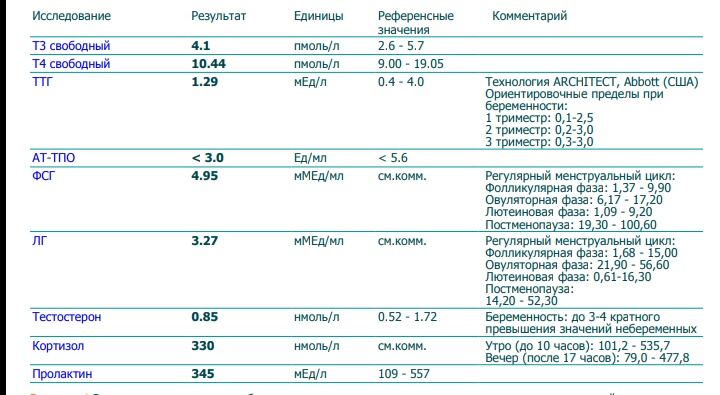

 046).
046).