методика раннего музыкального развития «Музыка с мамой»
Современные родители предъявляют множество требований к еще совсем маленьким деткам. Порой дитятко еще только появилось на свет, а мамы и папы стараются опробовать на малыше все новые и модные развивающие методики.
Многие из них порой дают неоднозначный результат, другие оказываются вовсе бесполезными или даже вредными. Но существует одно направление, которое в любом случае будет полезно для любого малыша. Это методика Железновых «Музыка с мамой».
Об авторах
Авторы уникальных занятий – папа и дочь. Выпускаемые диски с их развивающими музыкальными занятиями пользуются громадным успехом не только в России, но и за рубежом.
Папа – Сергей Станиславович. Имеет высшее музыкальное образование и, как никто, знает все тонкости музыкального ритма и воздействие музыки на маленького человечка. Имеет за плечами большой опыт работы с детками в музыкальной школе, а также руководство развивающим центром по своей методике.
Дочь – Екатерина Сергеевна. Также имеет высшее образование, специальность – учитель музыки. Екатерина Железнова работает по своей уникальной методике и постоянно повышает квалификацию.
Как все начиналось
Вначале Железновы, работая с детками, опробовали уже имеющиеся на тот момент методики по развитию музыкальности малышей. Постепенно они разрабатывали свои идеи и внедряли их в жизнь. Нарабатывался опыт, все удачное приобретало более четкие очертания. Так складывалась целостная система подготовки детей к поступлению в музыкальную школу.
Но все наработки, которые существовали, подходили для малышей от 3 лет. А вот для самых маленьких материала недоставало. Поэтому Екатерина и Сергей стали сами придумывать материалы для малышей. Как говорит Железнова, методика подходит для любого ребенка. Неважно, будет ли он в дальнейшем заниматься музыкой или нет, основы, заложенные в детстве, помогут в дальнейшем развитии.
Е. Железнова. Методика и ее суть
В основу методики положены любимые всеми малышами потешки, песенки и соответствующие им движения. Авторы брали за основу народные потешки, а также сами сочиняли небольшие песенки.
Авторы брали за основу народные потешки, а также сами сочиняли небольшие песенки.
Основываясь на том, что жизнь малыша немыслима без движения, все песенки обыгрываются. К тому же в потешках легкие, часто повторяющиеся слова, которые маленький ребенок вскоре начинает сам повторять.
Маленьким деткам важно, чтобы взрослый показывал и выполнял все движения вместе с ними. Так появилась методика Железновых «Музыка с мамой». Прыгая и танцуя с малышом, родители дарят своему ребенку много радостных минут. А педагог, присутствующий на занятии, руководит и направляет.
Цели и задачи музыкальных занятий
Конечно, все занятия с малышами проходят только в игровой форме. Ребенка не заставляют ничего делать. Педагог и мама показывают движения, а ребенок в ответ — по желанию — выполняет.
В итоге получается веселая и развивающая игра с ребенком, которая позволяет решать такие задачи, как:
- Развитие музыкального слуха и ритмики.
- Становление речи, в результате многократного повторения слов – звукоподражаний.

- Развитие моторки в результате взаимодействия с различными предметами, как музыкальными, так и обычными. Очень хорошо воспринимаются детками деревянные ложки и звонкие бубенчики.
- Тесный эмоциональный контакт с мамой, в результате веселого совместного времяпровождения.
- Слуховые и тактильные ощущения и восприятие информации посредством музыки.
- Укрепление общего состояния здоровья в результате активной физической активности.
- Музыка расслабляет, она показана при различных детских неврологических нарушениях, а также является мощной профилактикой неврозов у малышей.
- Развитие способности общаться в коллективе и взаимодействовать с другими малышами.
Замечено, что малыши, с ранних лет приобщенные к музыке, смышленнее своих сверстников. Связывают это с одинаковой работой левого и правого полушария мозга.
Основы методики
- Екатерина Железнова, методика которой направлена на раннее развитие музыкальных способностей деток, рекомендует очень тесное участие мамы в занятиях.
 Так достигается важный контакт малыша и родителя, который важно поддерживать для полноценного развития.
Так достигается важный контакт малыша и родителя, который важно поддерживать для полноценного развития. - Часто можно видеть, как ребенок, услышав музыку, начинает танцевать. Ведь малыш воспринимает музыку через движения. Поэтому занятия по методике Железновых всегда проводятся с играми, танцами и музицированием. Только так ребенок поймет и прочувствует музыку.
- Непосредственно сами песни должны быть либо русскими народными, т. е., классические потешки и песенки, или можно использовать современную, но танцевальную и действительно качественную. Железновы Сергей и Екатерина написали очень много хороших детских песенок и аранжировали старые русские потешки.
- Педагог, используя методику Железновых, обязательно должен играть на настоящем музыкальном инструменте. Но и без использования фонограмм нельзя обойтись. Только так педагог сможет помогать деткам и их мамам, активно учувствовать в танцах и играх.
- На занятиях предлагается знакомить детей с клавиатурой уже с 2-3 летнего возраста.
 Такая методика очень интересна для малышей. А детки после 3 лет уже сами могут наиграть простейший куплет и спеть песенку.
Такая методика очень интересна для малышей. А детки после 3 лет уже сами могут наиграть простейший куплет и спеть песенку.
Когда можно начинать
Методика развития Железновых подходит для совсем маленьких детишек. На занятия приводят деток, которые только-только начали самостоятельно сидеть. Как правило, малышам предлагаются удобные подушки, на которых они вдоволь машут ручками и ножками в такт музыке. Детки постарше уже вовсю ходят по всему периметру комнаты.
Но даже если малыш еще совсем мал, мама всегда может начать с ним играть. Да-да, именно играть. Ведь занятием это назвать нельзя. Хотя пользы от музыкальных игр очень много.
Все игры прекрасно вписываются в повседневный быт малыша. Вот мама несет ребенка умываться и напевает: «Водичка-водичка, умой мое личико…». Или, сгибая и разгибая ножки малыша, проговаривает: «Мишка косолапый…». А всем известные «Сорока-ворона»? Все это начальный этап приобщения ребенка к чувству ритма и музыкальности.
А есть ли недочеты в методике?
Если строго следовать методике и заниматься непосредственно по дискам или в студии раннего развития, то вреда уж точно не будет. Совместное времяпрепровождение, танцы, игры и веселые песенки настроят любого малыша на позитивный лад.
Совместное времяпрепровождение, танцы, игры и веселые песенки настроят любого малыша на позитивный лад.
Но если все же присмотреться пристально, то можно выявить некоторые моменты, которые можно назвать скорее маленькими нюансами, нежели недочетами.
Малышу предлагается четко следовать предложенному плану действий. Не дается право выбора и самостоятельного придумывания движений.
Есть много сложных повторений и стишков, которые маленькие детки не сразу начинают усваивать.
Екатерина Железнова, методика которой применяется во многих развивающих центрах, совместно со своим отцом сочинила множество авторских песенок. Но в основном они однотипные. Часто повторяются одинаковые слова, вроде таких как: зайчик или мишка, их действия, поспать, погулять.
Хотя для совсем маленьких малышей именно такое повторение однотипных слов является предпочтительным.
Для занятий на дому
Когда нет возможности или желания ходить на развивающие занятия по методике Железновых, можно приобрести диски с записями песенок и готовых занятий.
Диски можно найти как для совсем маленьких, так и для деток постарше.
На занятиях, обычно после пропевания песенок педагогом, предлагается деткам повторить. На дисках также после музыки со словами идет просто музыка, для самостоятельного пения мамы с малышом.
Диски условно можно разделить на категории.
Колыбельные
Здесь представлены исконно русские колыбельные, которые пели еще наши бабушки и мамы свои деткам. Песни звучат в их традиционном исполнении. Екатерина Железнова сама поет многие колыбельные. Дополнительным бонусом идут звуки природы, настраивающие на лирический лад.
Потешки
Песенки-потешки давно используются мамами для развлечения своих карапузов. Они способствуют разностороннему развитию ребенка и помогают в налаживании эмоционального контакта. Все помнят и «идет коза рогатая», и «ладушки-ладушки» с детства и дарят минуты радости теперь своим деткам.
Пальчиковые игры
Давно доказано, что речь напрямую зависит от развития мелкой моторики. А этому способствуют так называемые пальчиковые игры. А если их выполнять под музыку, то и польза огромная, и малыш с радостью все выполняет.
А этому способствуют так называемые пальчиковые игры. А если их выполнять под музыку, то и польза огромная, и малыш с радостью все выполняет.
Помимо основных, есть еще диски с физкультминутками, подвижными играми, сказками-шумелками, аэробикой и даже игровым массажем. Железновы Сергей и Екатерина песенки написали на разный возраст и придумали к ним незамысловатые движения, следуя которым ребенок познает мир.
Любой родитель, даже не имея музыкального образования и представления о музыкальной грамоте, сможет, опираясь на методику, всесторонне развить своего малыша и привить ему хороший музыкальный вкус.
Методика Железнова раннее развитие ребенка: пальчиковые игры
Здравствуйте, мои дорогие читатели! Сегодня мне снова хочется коснуться темы воспитания детей. Для любого родителя совершенно естественно беспокоиться о том, как растет его чадо. Многие современные мамочки с ранних лет начинают записывать дочек и сыночков во всевозможные кружки. Они зорко следят за тем, чтобы дети не сидели без дела.
Само это стремление благое. Оно служит единственной цели – дать ребенку возможность расти и всесторонне развиваться с максимальной пользой для себя. Хотя некоторые родители все-таки склонны впадать в крайности. Но все это может быть темой отдельной статьи.
Сегодня же я хочу поговорить про прекрасный способ помочь ребенку развиваться без чрезмерных нагрузок. Напротив – весело и с удовольствием. Итак, тема нашей беседы – методика Железнова раннее развитие ребенка.
Содержание
- 1 Суть методики
- 2 Польза методики
- 3 Что эта методика включает в себя?
- 3.1 Песенки с движениями
- 3.2 Пальчиковые игры
- 4 Некоторые нюансы
Суть методики
Суть методики – музыкальное развитие малыша; то есть развитие музыкальных способностей и слуха.
Авторы методики – отец и дочь, Сергей и Екатерина Железновы. Жизнь обоих тесно связана с музыкой. Сергей Станиславович закончил консерваторию, работал в педагогических вузах, преподавал в музыкальных школах.
Дочь Екатерина практически пошла по его стопам: училась в музыкальном педагогическом колледже, затем изучала дошкольную педагогику и психологию. По специальности она дирижер, преподаватель музыки и педагог-методист.
Главная особенность их методики в том, что по сути это веселая игра, где ребенку ничего не навязывается. Напротив, он сам с удовольствием включается в эту игру, а материал подается ему в самой доступной форме.
Это потешки, песенки, подвижные игры, которые безо всякого сомнения придутся по вкусу малышам. Такой игровой ненавязчивый подход делает методику понятной для самых маленьких.
Польза методики
Благодаря ей происходит постановка правильной речи, потому что занятия включают в себя элементы подражаний разным звукам.
Например тех, которые издают разные животные. Или многократное повторение разных слов, заучивание несложных, но полезных для тренировки речевого аппарата стишков.
У ребенка развивается моторика, потому что ему в упражнениях приходится задействовать разные предметы.
Он получает множество тактильных и слуховых ощущений – развитие органов чувств происходит одновременно и комплексно.
В процессе упражнений ребенок учится действовать в коллективе, налаживает общение с другими детьми. Если речь идет о домашней обстановке, то так он может поддерживать тесный контакт с мамой.
Эта методика хорошо подойдет, если у малышей есть неврологические нарушения. Музыка успокаивает и расслабляет, настраивает ребенка на спокойный позитивный лад.
Что эта методика включает в себя?
Она включает в себя целый комплекс развивающих игр и упражнений. Например логоритмика.
Логоритмика на видео:
В методику Железновых также входят и постановка театральных сценок, и пение веселых песенок. Причем все они разделены по возрастам, и для каждой возрастной категории найдется подходящий вариант. Это и развитие творческих способностей и удовольствие для детей.
Самые простые игры рассчитаны на малышей от полугода, и простираются на весь дошкольный возраст. Методика может успешно использоваться дома, но еще она используется как элемент развития детей в детских садах.
Песенки с движениями
Как пример можно привести песенки с движениями. Тут уже не нужно далеко ходить, достаточно вспомнить всем известные «Ладушки».Смысл этих песенок в том, что слушая их, ребенок выполняет некую инструкцию: совершает движения, которые ему предлагается сделать в песне.
Это развивает его ум, позволяет учиться ориентироваться в пространстве и координировать движения собственного тела. Маленькое замечание: чем ребенок старше, тем осмысленнее и сложнее песенки, и более замысловатые задачи.
Пример полезной песенки с движениями на видео:
Это в любом случае отличная разминка. С одной стороны, это действительно игра, а с другой стороны – все-таки обучение. Детки получают навыки развлекаясь.
Детки получают навыки развлекаясь.
Единственный минус – ребенок ограничен в творчестве. Он не прилагает собственную фантазию, а только делает то, что от него требуют. Но само действие при этом несет пользу, потому что развивает конкретные навыки, которые пригодятся ему для дальнейшей жизни.
Еще могут быть коллективные игры под музыку, вроде жмурок или салочек. В игру могут быть включены не только сверстники, но и родители. Причем это желательно, потому что так родители находятся в близком контакте со своим чадом. Это очень важный момент для деток любого возраста, но младшего – особенно.
Пальчиковые игры
Давайте теперь возьмем для примера пальчиковые игры.
Вспомните знакомую игру для малышей – «Сорока-Белобока», где нужно перечислять, каким из своих деток сорока дала каши, и при этом загибать ребенку пальчики.
Пальчиковые игры незатейливы и просты, стишки к ним хорошо ложатся на детскую память.
Нет более контактного вида игр! Во время всего действия взрослый взаимодействует с малышом напрямую: держит на ручках или сажает на колени, поглаживает, обнимает.
Пальчиковые игры видео:
Для детей постарше подойдут более сложные игры. Им может доставить большое удовольствие инсценировка сказок – в детях изначально заложено стремление подражать. Более того, если у ребенка есть актерский талант, такие инсценировки помогут ему раскрыться.
Некоторые нюансы
В целом методика хороша и не имеет существенных недостатков.
Своеобразным «противопоказанием» может стать «индивидуальная непереносимость», то есть, личные предпочтения ребенка.
Какие-то упражнения, игры и песенки ему понравятся, какие-то – нет. Что-то может оказаться полегче, а что-то сложнее.
В случае, если ему что-то не нравится, он не станет проявлять интереса, начнет капризничать, а то и вовсе откажется от выполнения заданий. Но это частный случай.
Всегда можно скорректировать свои занятия, учитывая то, что ему понравится. Особенно легко это будет сделать дома, где сама обстановка более свободная, чем в садике.
Особенно легко это будет сделать дома, где сама обстановка более свободная, чем в садике.
Вы сами видите, что не обязательно пытаться с пеленок водить ребенка по разным тематическим кружкам, чтобы он развивался. Методика Железновых – один из действенных вариантов развивать малыша комплексно, но при этом без фанатизма.
На этом у меня все. Надеюсь, что вы почерпнули для себя что-то интересное и полезное. Желаю вашим детям расти счастливыми и здоровыми! Не забывайте делиться записью в соцсетях, если она вам понравилась, и обязательно заходите еще. Вам будут рады! До новых встреч!
Открытие железного ящика: транскрипционная металлорегуляция белка меха
1. Абдул-Техрани Х., Хадсон А.Дж., Чанг И.С., Тиммс А.Р., Хокинс С., Уильямс Дж.М., Харрисон П.М., Гест Дж.Р., Эндрюс С.С. Ферритиновые мутанты Escherichia coli имеют дефицит железа и нарушение роста, а мутанты fur имеют дефицит железа. J Бактериол. 1999; 181:1415–1428. [Статья бесплатно PMC] [PubMed] [Google Scholar]
J Бактериол. 1999; 181:1415–1428. [Статья бесплатно PMC] [PubMed] [Google Scholar]
2. Althaus E W, Outten C E, Olson KE, Cao H, O’Halloran TV. Репрессор регуляции поглощения железа (Fur) представляет собой металлопротеин цинка. Биохимия. 1999;38:6559–6569. [PubMed] [Google Scholar]
3. Арчибальд Ф. Lactobacillus plantarum , организм, не требующий железа. FEMS Microbiol Lett. 1983; 19: 29–32. [Google Scholar]
4. Багг А., Нейландс Дж. Б. Картирование мутации, влияющей на регуляцию систем усвоения железа в Escherichia coli K-12. J Бактериол. 1985; 161: 450–453. [Статья бесплатно PMC] [PubMed] [Google Scholar]
5. Bagg A, Neilands J B. Белок, регулирующий поглощение железа, действует как репрессор, используя железо (II) в качестве кофактора для связывания оператора оперона транспорта железа в Кишечная палочка . Биохимия. 1987; 26: 5471–5477. [PubMed] [Google Scholar]
6. Bagg A, Neilands J B. Молекулярный механизм регуляции сидерофор-опосредованной ассимиляции железа. Microbiol Rev. 1987; 51:509–518. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Microbiol Rev. 1987; 51:509–518. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Bearden S W, Perry RD. Система Yfe Yersinia pestis транспортирует железо и марганец и необходима для полной вирулентности чумы. Мол микробиол. 1999; 32: 403–414. [PubMed] [Академия Google]
8. Бересвилл С., Лихте Ф., Вей Т., Фассбиндер Ф., Кист М. Клонирование и характеристика гена fur из Helicobacter pylori . FEMS Microbiol Lett. 1998; 159: 193–200. [PubMed] [Google Scholar]
9. Berish SA, Subbarao S, Chen C-Y, Trees DL, Morse SA. Идентификация и клонирование гомолога Fur из Neisseria gonorrhoeae . Заразить иммун. 1993;61:4599–4606. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Биндерейф А., Нейландс Дж. Б. Картирование промотора и регуляция транскрипции системы ассимиляции железа плазмиды ColV-K30 в Кишечная палочка К-12. J Бактериол. 1985; 162: 1039–1046. [PMC free article] [PubMed] [Google Scholar]
11. Бойд Дж., Оза М.Н., Мерфи Дж.Р. Молекулярное клонирование и анализ последовательности ДНК железозависимого регуляторного элемента (dtxR) дифтерийного токсина из Corynebacterium diphtheriae . Proc Natl Acad Sci USA. 1990; 87: 5968–5972. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Бойд Дж., Оза М.Н., Мерфи Дж.Р. Молекулярное клонирование и анализ последовательности ДНК железозависимого регуляторного элемента (dtxR) дифтерийного токсина из Corynebacterium diphtheriae . Proc Natl Acad Sci USA. 1990; 87: 5968–5972. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Браун В., Шеффер С., Хантке К., Трегер В. Регуляция экспрессии генов железом. 41. Коллоквиум Мосбах 1990. Молекулярные основы метаболизма бактерий. Берлин, Германия: Springer-Verlag; 1990. [Google Scholar]
13. Брикман Т.Дж., Озенбергер Б.А., Макинтош М.А. Регуляция дивергентной транскрипции из промотор-операторных областей fepB-entC , реагирующих на железо, в Escherichia coli . Дж Мол Биол. 1990; 212: 669–682. [PubMed] [Google Scholar]
14. Brickman T J, Armstrong S K. Ген Bordetella pertussis fur восстанавливает репрессивность железом сидерофора и экспрессию белка до нарушения регуляции Мутанты Bordetella bronchiseptica . J Бактериол. 1995; 177: 268–270. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1995; 177: 268–270. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Bsat N, Herbig A, Casillas-Martinez L, Setlow P, Helmann J D. Bacillus subtilis содержит несколько гомологов Fur: идентификация поглощения железа (Fur ) и репрессоры пероксидного регулона (PerR). Мол микробиол. 1998; 29: 189–198. [PubMed] [Google Scholar]
16. Calderwood S, Mekalanos J J. Подтверждение сайта оператора Fur путем вставки синтетического олигонуклеотида в плазмиду слияния оперонов. J Бактериол. 1988;170:1015–1017. [Статья PMC бесплатно] [PubMed] [Google Scholar]
17. Carson SDB, Thomas CE, Elkins C. Клонирование и секвенирование гомолога Haemophilus ducreyi fur . Ген. 1996; 176: 125–129. [PubMed] [Google Scholar]
18. Chai S, Welch TJ, Crosa JH. Характеристика взаимодействия между Fur и промотором транспорта железа плазмиды вирулентности в Vibrio anguillarum . Дж. Биол. Хим. 1998; 273:33841–33847. [PubMed] [Академия Google]
19. Кой М. , Нейландс Дж. Б. Структурная динамика и функциональные домены белка Fur. Биохимия. 1991; 30:8201–8210. [PubMed] [Google Scholar]
, Нейландс Дж. Б. Структурная динамика и функциональные домены белка Fur. Биохимия. 1991; 30:8201–8210. [PubMed] [Google Scholar]
20. Крайтон Р. Р. Неорганическая биохимия метаболизма железа. Нью-Йорк, штат Нью-Йорк: Эллис Хорвуд; 1991. [Google Scholar]
21. Crosa J H. Передача сигналов и транскрипционный и посттранскрипционный контроль генов, регулируемых железом, у бактерий. Microbiol Mol Biol Rev. 1997;61:319–336. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Dalet K, Gouin E, Cenatiempo Y, Cossart P, Hechard Y. Характеристика нового оперона, кодирующего Zur-подобный белок и связанную пермеазу цинка ABC у Listeria monocytogenes. FEMS Microbiol Lett. 1999; 174:111–116. [PubMed] [Google Scholar]
23. Daniel C, Haentjens S, Bissinger MC, Courcol R J. Характеристика регулятора меха Acinetobacter baumannii : клонирование и секвенирование гомолога гена fur . FEMS Microbiol Lett. 1999; 170:199–209. [PubMed] [Академия Google]
24. de Lorenzo V, Bindereif A, Paw B H, Neilands J B. Биосинтез аэробактина и транспортные гены плазмиды ColV-K30 в Escherichia coli K-12. J Бактериол. 1986; 165: 570–578. [Бесплатная статья PMC] [PubMed] [Google Scholar]
de Lorenzo V, Bindereif A, Paw B H, Neilands J B. Биосинтез аэробактина и транспортные гены плазмиды ColV-K30 в Escherichia coli K-12. J Бактериол. 1986; 165: 570–578. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. de Lorenzo V, Wee S, Herrero M, Neilands J B. Операторные последовательности аэробактинового оперона плазмиды ColV-K30, связывающие регуляцию поглощения железа ( fur ) репрессор. J Бактериол. 1987; 169: 2624–2630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. де Лоренцо В., Джованнини Ф., Эрреро М., Нейландс Дж. Б. Регуляция экспрессии генов ионами металлов: взаимодействие репрессор-оператор меха в промоторной области аэробактиновой системы pColV-K30. Дж Мол Биол. 1988; 203: 875–884. [PubMed] [Google Scholar]
27. de Lorenzo V, Herrero M, Giovannini F, Neilands J B. Белок Fur (регуляция поглощения железа) и CAP (белок-активатор катаболита) модулируют транскрипцию гена fur в Escherichia. коли . Евр Дж Биохим. 1988;173:537–546. [PubMed] [Google Scholar]
Евр Дж Биохим. 1988;173:537–546. [PubMed] [Google Scholar]
28. Де Лука Н. Г., Векслер М., Перейра М. Дж., Йоман К. Х., Джонстон А. В. Является ли ген fur Rhizobium leguminosarum существенным? FEMS Microbiol Lett. 1998; 168: 289–295. [PubMed] [Google Scholar]
29. Desai P J, Angerer A, Genco C A. Анализ связывания Fur с последовательностями операторов в промоторе Neisseria gonorrhoeae fbpA . J Бактериол. 1996; 178:5020–5023. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Earhart C F. Поглощение и метаболизм железа и молибдена. В: Neidhardt FC, et al., редакторы. Escherichia coli и Salmonella , клеточная и молекулярная биология. 2-е изд. Вашингтон, округ Колумбия: ASM Press; 1996. С. 1075–1090. [Google Scholar]
31. Эрнст Дж. Ф., Беннетт Р. Л., Ротфилд Л. И. Конститутивная экспрессия систем поглощения железа-энтерохелина и феррихрома в мутантном штамме Salmonella typhimurium . J Бактериол. 1978; 135: 928–9.34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
1978; 135: 928–9.34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Escolar L, de Lorenzo V, Pérez-Martín J. Metalloregulation in vitro промотора аэробактина Escherichia coli мехом (поглощение железа регуляция) белок. Мол микробиол. 1997; 26: 799–808. [PubMed] [Google Scholar]
33. Escolar L, Pérez-Martín J, de Lorenzo V. Координированная репрессия in vitro дивергентных промоторов fepA-fes Escherichia coli с помощью регуляции поглощения железа (Fur ) белок. J Бактериол. 1998;180:2579–2582. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Escolar L, Pérez-Martín J, de Lorenzo V. Связывание репрессора Fur (регулятор поглощения железа) Escherichia coli с массивами последовательности GATAAT. Дж Мол Биол. 1998; 283: 537–547. [PubMed] [Google Scholar]
35. Фетерстон Дж. Д., Бертолино В. Дж., Перри Р. Д. YbtP и YbtQ: два переносчика ABC, необходимые для поглощения железа у Yersinia pestis . Мол микробиол. 1999; 32: 289–299. [PubMed] [Академия Google]
Мол микробиол. 1999; 32: 289–299. [PubMed] [Академия Google]
36. Franza T, Sauvage C, Expert D. Регуляция железа и патогенность в Erwinia chrysanthemi 3937: роль белка-репрессора Fur. Mol Plant Microbe Interact. 1999; 12:119–128. [PubMed] [Google Scholar]
37. Fréchon D, Le Cam E. Взаимодействие белка Fur (регуляция поглощения железа) с ДНК-мишенью: сравнение замедления геля, анализа следов и электронной микроскопии. Biochem Biophys Res Commun. 1994; 201:346–355. [PubMed] [Google Scholar]
38. Фостер Дж. В., Холл Х. К. Эффект Salmonella typhimurium мутации регулятора поглощения железа ( fur ) синтеза белка, регулируемого железом и рН. J Бактериол. 1992; 174:4317–4323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Габалла А., Хелманн Дж. Д. Идентификация специфичного для цинка металлорегуляторного белка Zur, контролирующего опероны транспорта цинка в Bacillus subtilis . J Бактериол. 1998; 180:5815–5821. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Гассемиан М., Штраус Н.А. Фур регулирует экспрессию генов стресса железа у цианобактерий Synechococcus sp. штамм PCC7942. Микробиология. 1996; 142:1469–1476. [PubMed] [Google Scholar]
41. Griggs DW, Tharp BB, Konisky J. Клонирование и идентификация промотора гена cir , регулируемого железом, из Escherichia coli . J Бактериол. 1987; 169: 5343–5352. [Статья бесплатно PMC] [PubMed] [Google Scholar]
42. Griggs DW, Konisky J. Механизм регулируемой железом транскрипции гена Escherichia coli cir : металл-зависимое связывание белка Fur с промоторами. J Бактериол. 1989;171:1048–1054. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Hall HK, Foster JW. Роль Fur в реакции кислотоустойчивости Salmonella typhimurium физиологически и генетически отделена от его роли в усвоении железа. J Бактериол. 1996; 178: 5683–5691. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Hamza I, Chauhan S, Hassett R, O’Brian MR. Бактериальный белок irr необходим для координации биосинтеза гема с доступностью железа. Дж. Биол. Хим. 1998;273:21669–21674. [PubMed] [Google Scholar]
Hamza I, Chauhan S, Hassett R, O’Brian MR. Бактериальный белок irr необходим для координации биосинтеза гема с доступностью железа. Дж. Биол. Хим. 1998;273:21669–21674. [PubMed] [Google Scholar]
45. Хантке К. Регуляция транспорта трехвалентного железа в Escherichia coli K12: выделение конститутивного мутанта. Мол Ген Жене. 1981; 182: 288–292. [PubMed] [Google Scholar]
46. Хантке К. Клонирование гена репрессорного белка железорегулируемой системы в E. coli K-12. Мол Ген Жене. 1984; 197: 337–341. [PubMed] [Google Scholar]
47. Хантке К. Процедура селекции мутантов с нарушенным транспортом железа ( мех ) в Escherichia coli K12: мех влияет не только на метаболизм железа. Мол Ген Жене. 1987; 210: 135–139. [PubMed] [Google Scholar]
48. Hassett D J, Howell ML, Ochsner UA, Vasil ML, Johnson Z, Dean GE. регулятор поглощения железа у мутантов Pseudomonas aeruginosa : fur продуцирует повышенные уровни альгината. J Бактериол. 1997;179:1452–1459. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Бактериол. 1997;179:1452–1459. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Heidrich C, Hantke K, Bierbaum G, Sahl HG. Идентификация и анализ гена, кодирующего мехоподобный белок Staphylococcus epidermidis . FEMS Microbiol Lett. 1996; 140: 253–259. [PubMed] [Google Scholar]
50. Hill PJ, Cockayne A, Landers P, Morrissey JA, Sims CM, Williams P. SirR, новый железозависимый репрессор в Staphylococcus epidermidis . Заразить иммун. 1998; 66: 4123–4129.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Hinkey E K, Cianciotto N P. Клонирование и секвенирование гена Legionella pneumoniae fur . Ген. 1994; 143:117–121. [PubMed] [Google Scholar]
52. Holm L, Syer C, Ruterjans H, Schnarr M, Fogh R, Boelens R, Kaptein R. Репрессор LexA и регулятор усвоения железа из Escherichia coli : новые члены CAP- как суперсемейство ДНК-связывающих доменов. прот инж. 1994;7:14449–14453. [PubMed] [Академия Google]
53. Хант М. Д., Петтис Г. С., Макинтош М. А. Промоторные и операторные детерминанты регуляции железа, опосредованной мехом, в двунаправленной контрольной области fepA-fes системы энтеробактина Escherichia coli . J Бактериол. 1994; 176:3944–3955. [PMC free article] [PubMed] [Google Scholar]
Хант М. Д., Петтис Г. С., Макинтош М. А. Промоторные и операторные детерминанты регуляции железа, опосредованной мехом, в двунаправленной контрольной области fepA-fes системы энтеробактина Escherichia coli . J Бактериол. 1994; 176:3944–3955. [PMC free article] [PubMed] [Google Scholar]
54. Karjalainen T K, Evans D G, Evans D J, Graham D Y, Jr, Lee CH. . Микроб Патог. 1991; 11: 317–323. [PubMed] [Академия Google]
55. Klebba PE, McIntosh MA, Neilands JB. Кинетика биосинтеза мембранных белков, регулируемых железом, в Escherichia coli . J Бактериол. 1982; 149: 880–888. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Le Cam E, Fréchon D, Barray M, Fourcade A, Delain E. Наблюдение за связыванием и полимеризацией репрессора Fur на содержащей оператор ДНК с помощью электронной и атомной силы микроскопы. Proc Natl Acad Sci USA. 1994; 91:11816–11820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Lee H S, Lee Y S, Kim H S, Choy J Y, Hassan H M, Chung M H. Механизм регуляции 8-гидроксигуанин эндонуклеазы окислительным стрессом: роль FNR, ArcA и Fur. Свободный Радик Биол Мед. 1998; 24:1193–1201. [PubMed] [Google Scholar]
Механизм регуляции 8-гидроксигуанин эндонуклеазы окислительным стрессом: роль FNR, ArcA и Fur. Свободный Радик Биол Мед. 1998; 24:1193–1201. [PubMed] [Google Scholar]
58. Leoni L, Ciervo A, Orsi N, Visca P. Регулируемая железом транскрипция гена pvdA в Pseudomonas aeruginosa : влияние Fur и PvdS на активность промотора. J Бактериол. 1996;178:2299–2313. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Литвин М., Бойко С.А., Калдервуд С.Б. Клонирование, секвенирование и регуляция транскрипции гена Vibrio cholerae fur . J Бактериол. 1992; 174: 1897–1903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Литвин М., Калдервуд С. Б. Роль железа в регуляции генов вирулентности. Clin Microbiol Rev. 1993; 6:137–149. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Литвин М., Калдервуд С. Б. Клонирование и генетический анализ меха Vibrio vulnificus и конструирование мутанта fur путем замены маркера in vivo . J Бактериол. 1993; 175: 706–715. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Бактериол. 1993; 175: 706–715. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Литвин С. М., Калдервуд С. Б. Анализ сложности регуляции генов с помощью Fur в Vibrio cholerae . J Бактериол. 1994; 176: 240–248. [Статья бесплатно PMC] [PubMed] [Google Scholar]
63. Loong Chan V, Louie H, Bingham HL. Клонирование и регуляция транскрипции регуляторного гена поглощения железа Campylobacter jejuni TGH9011. Ген. 1995; 164: 25–31. [PubMed] [Google Scholar]
64. Ma J, Oschsner U A, Klotz M G, Nanayakkara V K, Howell M L, Johnson Z, Posey J E, Vasil M L, Monaco J J, Hassett D J. Бактериоферритин A модулирует каталазу A (KatA) активность и устойчивость к перекиси водорода Pseudomonas aeruginosa . J Бактериол. 1999;181:3730–3742. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Makemson J C, Hastings J W. Железо подавляет биолюминесценцию в Вибрион харвейи . Карр микробиол. 1982; 7: 181–186. [Google Scholar]
66. McCarter L, Silverman M. Железная регуляция дифференцировки роевых клеток Vibrio parahaemolyticus . J Бактериол. 1989; 171: 731–736. [Бесплатная статья PMC] [PubMed] [Google Scholar]
McCarter L, Silverman M. Железная регуляция дифференцировки роевых клеток Vibrio parahaemolyticus . J Бактериол. 1989; 171: 731–736. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Michaud-Soret I, Adrait A, Jaquinod M, Forest E, Touati D, Latour J-M. Электроспрей-ионизационная масс-спектроскопия анализ апо- и металл-замещенных форм белка Fur. ФЭБС лат. 1997; 413:473–476. [PubMed] [Академия Google]
68. Neilands J B. Сидерофорные системы бактерий и грибов. В: Беверидж Т.Дж., Дойл Р.Дж., редакторы. Ионы металлов и бактерии. Нью-Йорк, штат Нью-Йорк: John Wiley & Sons, Inc.; 1989. С. 141–163. [Google Scholar]
69. Нейландс Дж. Б., Накамура К. Обнаружение, определение, выделение, характеристика и регулирование микробных хелатов железа. В: Винкельманн Г., редактор. Справочник микробных хелатов железа. Бока-Ратон, Флорида: CRC Press; 1991. С. 1–14. [Google Scholar]
70. Нидерхоффер Э. К., Наранхо К. М., Брэдли К. Л., Фи Дж. А. Контроль Гены супероксиддисмутазы Escherichia coli ( sodA и sodB ) по локусу регуляции поглощения железа ( fur ).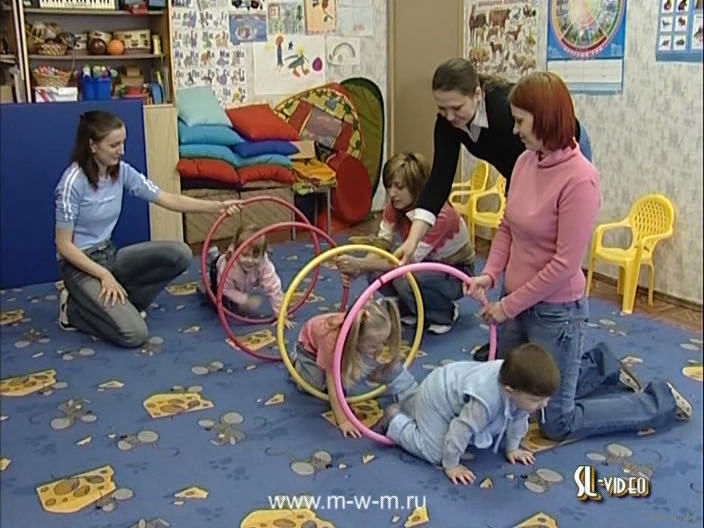 J Бактериол. 1990; 172: 1930–1938. [PMC free article] [PubMed] [Google Scholar]
J Бактериол. 1990; 172: 1930–1938. [PMC free article] [PubMed] [Google Scholar]
71. Охснер Ю.А., Василь А.И., Василь М.Л. Роль регулятора поглощения железа Pseudomonas aeruginosa в регуляции экспрессии сидерофоров и экзотоксина А: очистка и активность на промоторах, регулируемых железом. J Бактериол. 1995;177:7194–7201. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Охснер У. А., Василь М. Л. Репрессия генов регулятором поглощения железа у Pseudomonas aeruginosa : циклическая селекция генов, регулируемых железом. Proc Natl Acad Sci USA. 1996; 93:4409–4414. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Ochsner U A, Johnson Z, Hassett D J, Vasil M L. Тезисы 99-го общего собрания Американского общества микробиологии, 1999. Вашингтон, округ Колумбия: Американское общество микробиологии. микробиология; 1999. Характеристика локуса, кодирующего бактериоферритин и пероксидазу в штамме Pseudomonas aeruginosa , абстр. К46; п. 409. [Google Scholar]
409. [Google Scholar]
74. O’Sullivan DJ, Dowling DN, de Lorenzo V, O’Gara F. Регулятор поглощения железа Escherichia coli (Fur) может опосредовать регуляцию псевдомонадного стимулятора, регулируемого железом. FEMS Lett. 1994; 117: 327–332. [PubMed] [Google Scholar]
75. Patzer S I, Hantke K. Система высокоаффинного усвоения цинка ZnuABC и ее регулятор Zur в Кишечная палочка . Мол микробиол. 1998; 28:1199–1210. [PubMed] [Google Scholar]
76. Принц Р. В., Кокс С. Д., Васил М. Л. Координированная регуляция производства сидерофора и экзотоксина А: молекулярное клонирование и секвенирование гена Pseudomonas aeruginosa fur . J Бактериол. 1993; 175: 2589–2598. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Пташне М. Генетический переключатель. Кембридж, Массачусетс: Cell Press и научные публикации Blackwell; 1992. [Google Scholar]
78. Saito I, Wormald MR, Williams RJ P. Некоторые структурные особенности белка, регулирующего усвоение железа. Евр Дж Биохим. 1991; 197: 29–38. [PubMed] [Google Scholar]
Евр Дж Биохим. 1991; 197: 29–38. [PubMed] [Google Scholar]
79. Schaffer S, Hantke K, Braun V. Нуклеотидная последовательность гена, регулирующего железо fur . Мол Ген Жене. 1985; 201: 204–212. [PubMed] [Google Scholar]
80. Шмитт М.П., Предич М., Доухан Л., Смит И., Холмс Р.К. Характеристика железозависимого регуляторного белка (IdeR) Mycobacterium tuberculosis в качестве функционального гомолога репрессора дифтерийного токсина (DtxR) из Corynebacterium diphtheriae . Заразить иммун. 1995; 63:4284–4289. [Статья бесплатно PMC] [PubMed] [Google Scholar]
81. Schneider R, Hantke K. Системы поглощения гидроксамата железа в Bacillus subtilis : идентификация липопротеина как части транспортной системы, зависящей от связывающего белка. Мол микробиол. 1993; 8: 111–121. [PubMed] [Google Scholar]
82. Staggs TM, Perry RD. Идентификация и клонирование регуляторный ген меха в Yersinia pestis . J Бактериол. 1991; 173: 417–425. [Статья бесплатно PMC] [PubMed] [Google Scholar]
1991; 173: 417–425. [Статья бесплатно PMC] [PubMed] [Google Scholar]
83. Staggs TM, Fetherston JD, Perry RD. Плейотропные эффекты мутации Yersinis pestis fur . J Бактериол. 1994; 176:7614–7624. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Stojiljkovic I, Bäumer AJ, Hantke K. Fur regulon в грамотрицательных бактериях. Дж Мол Биол. 1994; 236: 531–545. [PubMed] [Академия Google]
85. Stojiljkovic I, Hantke K. Функциональные домены белка-регулятора поглощения железа Escherichia coli (Fur) Mol Gen Genet. 1995; 247:199–205. [PubMed] [Google Scholar]
86. Tao X, Schiering N, Zeng H, Ringe D, Murphy JR. Iron, DtxR и регуляция экспрессии дифтерийного токсина. Мол микробиол. 1994; 14: 191–197. [PubMed] [Google Scholar]
87. Тардат Б., Туати Д. Регуляция железом и кислородом экспрессии Escherichia coli MnSOD: конкуренция между глобальными регуляторами Fur и ArcA за связывание с ДНК. Мол микробиол. 1993;9:53–63. [PubMed] [Google Scholar]
88. Thomas CE, Sparling PF. Идентификация и клонирование гомолога fur из Neisseria meningitidis . Мол микробиол. 1994; 11: 725–737. [PubMed] [Google Scholar]
Thomas CE, Sparling PF. Идентификация и клонирование гомолога fur из Neisseria meningitidis . Мол микробиол. 1994; 11: 725–737. [PubMed] [Google Scholar]
89. Thomas CE, Sparling PF. Выделение и анализ fur мутанта Neisseria gonorrhoeae . J Бактериол. 1996; 178:4224–4232. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Толмаски М. Е., Вертхаймер А. М., Актис Л. А., Кроза Дж. Х. Характеристика Vibrio anguillarum fur gen: роль в регуляции экспрессии белка наружной мембраны FatA и катеколов. J Бактериол. 1994; 176: 213–220. [Статья бесплатно PMC] [PubMed] [Google Scholar]
91. Touati D, Jacques M, Tardat B, Bouchard L, Despied S. Летальные окислительные повреждения и мутагенез вызываются железом у Δ fur мутантов Escherichia coli. : защитная роль супероксиддисмутазы. J Бактериол. 1995;177:2305–2314. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Tsolis RM, Bäumler AJ, Stojiljkovic I, Heffron F. Fur regulon in Salmonella typhimurium : идентификация новых генов, регулируемых железом. J Бактериол. 1995; 177:4628–4637. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Fur regulon in Salmonella typhimurium : идентификация новых генов, регулируемых железом. J Бактериол. 1995; 177:4628–4637. [Статья бесплатно PMC] [PubMed] [Google Scholar]
93. Ван Влит А. Х. М., Вулдридж К. Г., Кетли Дж. М. Регуляция генов, чувствительных к железу, у мутанта Campylobacter jejuni fur . J Бактериол. 1998; 180:5291–5298. [PMC free article] [PubMed] [Google Scholar]
94. Vasil M L, Ochsner U A, Johnson Z, Colmer J A, Hamood A N. Fur-регулируемый ген, кодирующий альтернативный сигма-фактор PvdS, необходим для железозависимой экспрессии. регулятора типа LysR PtxR в Синегнойная палочка . J Бактериол. 1998; 180:6784–6788. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Venturi V, Ottevanger C, Bracke M, Weinsbeek P. Железная регуляция биосинтеза и транспорта сидерофоров в Pseudomonas putida WCS358: участие транскрипционного активатора и Меховой белок. Мол микробиол. 1995; 15:1081–1093. [PubMed] [Google Scholar]
96. Wackett LP, Orme-Johnson WH, Walsh CT. Ферменты переходных металлов в бактериальном метаболизме. В: Беверидж Т.Дж., Дойл Р.Дж., редакторы. Ионы металлов и бактерии. Нью-Йорк, штат Нью-Йорк: John Wiley & Sons, Inc.; 1989. стр. 165–206. [Google Scholar]
Wackett LP, Orme-Johnson WH, Walsh CT. Ферменты переходных металлов в бактериальном метаболизме. В: Беверидж Т.Дж., Дойл Р.Дж., редакторы. Ионы металлов и бактерии. Нью-Йорк, штат Нью-Йорк: John Wiley & Sons, Inc.; 1989. стр. 165–206. [Google Scholar]
97. Wang G, Wylie GP, Twigg PD, Caspar DI, Murphy JR, Logan TM M. Структура раствора и исследования связывания пептидов C-концевого src-гомологии 3-подобного домена белка-репрессора дифтерийного токсина . Proc Natl Acad Sci USA. 1999;96:6119–6124. [Статья бесплатно PMC] [PubMed] [Google Scholar]
98. Watnick PI, Eto T, Takahashi H, Calderwood S B. Очистка Vibrio cholerae Fur и оценка его внутриклеточного содержания с помощью иммуноферментного анализа сэндвич-антитела. . J Бактериол. 1997;179:243–247. [PMC free article] [PubMed] [Google Scholar]
99. Watnick PI, Butterton JR, Calderwood SB. Взаимодействие факторов транскрипции Vibrio cholerae , Fur и IrgB, с перекрывающимися промоторами двух генов вирулентности, irgA и irgB. Ген. 1998; 209: 65–70. [PubMed] [Google Scholar]
Ген. 1998; 209: 65–70. [PubMed] [Google Scholar]
100. Wee S, Neilands JB, Bittner ML, Hemming BC, Haymore BL, Seetharam R. Экспрессия, выделение и свойства белка Fur (регуляция поглощения железа) Кишечная палочка К-12. Биол Металлы. 1988; 1: 62–68. [PubMed] [Google Scholar]
101. Уайт А., Дин Х., ВандерСпек Дж. К., Мерфи Дж. Р., Ринг Д. Структура комплекса репрессор/токс-оператор дифтерийного токсина, активируемого ионами металла. Природа. 1998; 394: 502–506. [PubMed] [Google Scholar]
102. Вонг Д.К., Ли Б.Ю., Хорвиц М.А., Гибсон Б.В. Идентификация Fur, аконитазы и других белков, экспрессируемых Mycobacterium tuberculosis в условиях низких и высоких концентраций железа комбинированным методом. двумерный гель-электрофорез и масс-спектрометрия. Заразить иммун. 1999;67:327–336. [Статья бесплатно PMC] [PubMed] [Google Scholar]
103. Wooldridge KG, Williams PH, Ketley JM. Реагирующая на железо генетическая регуляция в Campylobacter jejuni : клонирование и характеристика гомолога fur . J Бактериол. 1994; 176: 5852–5856. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Бактериол. 1994; 176: 5852–5856. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Yamamoto S, Funahashi T, Ikai H, Shinoda S. Клонирование и секвенирование гена меха Vibrio parahaemolyticus . Микробиол Иммунол. 1997; 41: 737–740. [PubMed] [Академия Google]
Физиологический и протеомный анализ роста кишечной палочки с ограниченным железом хемостатом
1. Ames BN. 2006. Низкое потребление микронутриентов может ускорить дегенеративные заболевания старения, выделение дефицитных микронутриентов путем сортировки. проц. Натл. акад. науч. США. 103:17589–17594. 10.1073/pnas.0608757103 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Elser JJ, Bracken MES, Cleland EE, Gruner DS, Harpole WS, Hillebrand H, Ngai JT, Seabloom EW, Shurin JB , Смит Дж. Э. 2007. Глобальный анализ лимитирования азота и фосфора первичных продуцентов в пресноводных, морских и наземных экосистемах. Экол. лат. 10:1135–1142. 10.1111/j.1461-0248.2007.01113.x [PubMed] [CrossRef] [Google Scholar]
3. Каземи Серешт А., Палмквист Э.А., Олссон Л.
2011.
Влияние дефицита фосфатов на производство фармацевтических белков у S. cerevisiae: связь транскриптомных данных с фенотипическими реакциями. микроб. Сотовый факт.
10:104. 10.1186/1475-2859-10-104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Каземи Серешт А., Палмквист Э.А., Олссон Л.
2011.
Влияние дефицита фосфатов на производство фармацевтических белков у S. cerevisiae: связь транскриптомных данных с фенотипическими реакциями. микроб. Сотовый факт.
10:104. 10.1186/1475-2859-10-104 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Elser JJ, Acquisti C, Kumar S. 2011. Стехиогеномика: эволюционная экология элементного состава макромолекул. Тенденции Экол. Эвол. 26:38–44. 10.1016/j.tree.2010.10.006 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Стернер Р.В., Эльзер Дж.Дж. 2002. Экологическая стехиометрия: биология элементов от молекул до биосферы. Princeton University Press, Princeton, NJ [Google Scholar]
6. Makino W, Cotner JB, Sterner RW, Elser JJ. 2003. Бактерии больше похожи на растения или животных? Скорость роста и ресурсозависимость бактериальной стехиометрии C:N:P. Функц. Экол. 17:121–130. 10.1046/j.1365-2435.2003.00712.x [CrossRef] [Google Scholar]
7. Zinn M, Witholt B, Egli T.
2004.
Рост, ограниченный двойным питательным веществом: модели, экспериментальные наблюдения и приложения. Дж. Биотехнология.
113: 263–279. 10.1016/j.jbiotec.2004.03.030 [PubMed] [CrossRef] [Google Scholar]
Zinn M, Witholt B, Egli T.
2004.
Рост, ограниченный двойным питательным веществом: модели, экспериментальные наблюдения и приложения. Дж. Биотехнология.
113: 263–279. 10.1016/j.jbiotec.2004.03.030 [PubMed] [CrossRef] [Google Scholar]
8. Baudouin-Cornu P, Surdin-Kerjan Y, Marlière P, Thomas D. 2001. Молекулярная эволюция атомного состава белков. Наука 293: 297–300. 10.1126/science.1061052 [PubMed] [CrossRef] [Google Scholar]
9. Bragg JG, Wagner A. 2009. Стоимость белкового материала: отдельные атомы могут иметь значение для эволюции. Тенденции Жене. 25:5–8. 10.1016/j.tig.2008.10.007 [PubMed] [CrossRef] [Google Scholar]
10. Арчибальд Ф. 1983. Lactobacillus plantarum, организм, не требующий железа. ФЭМС микробиол. лат. 19:29–32. 10.1111/j.1574-6968.1983.tb00504.x [CrossRef] [Google Scholar]
11. Posey JE, Gheridini FC. 2000. Отсутствие роли железа в возбудителе болезни Лайма. Наука 288: 1651–1653. 10.1126/science.288.5471.1651 [PubMed] [CrossRef] [Google Scholar]
12.
13. Boukhalfa H, Crumbliss AL. 2002. Химические аспекты опосредованного сидерофорами транспорта железа. Биометаллы 15:325–339. 10.1023/A:1020218608266 [PubMed] [CrossRef] [Google Scholar]
14. Хантке К. 1981. Регуляция транспорта трехвалентного железа в Escherichia coli K12: выделение конститутивного мутанта. Мол. Генерал Жене. 182: 288–292. 10.1007/BF00269672 [PubMed] [CrossRef] [Google Scholar]
15. Weinberg ED. 1975 год. Пищевой иммунитет — попытка хозяина удержать железо от микробных захватчиков. ДЖАМА 231:39–41. 10.1001/jama.1975.03240130021018 [PubMed] [CrossRef] [Google Scholar]
16. Kehl-Fie TE, Skaar EP. 2010. Пищевой иммунитет помимо железа: роль марганца и цинка. Курс. мнение хим. биол. 14:218–224. 10.1016/j.cbpa.2009.11.008 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Schaible UE, Kaufmann SHE.
2004.
Железо и микробная инфекция. Нац. Преподобный Микробиолог.
2: 946–953. 10.1038/nrmicro1046 [PubMed] [CrossRef] [Google Scholar]
Schaible UE, Kaufmann SHE.
2004.
Железо и микробная инфекция. Нац. Преподобный Микробиолог.
2: 946–953. 10.1038/nrmicro1046 [PubMed] [CrossRef] [Google Scholar]
18. Skaar EP. 2010. Битва за железо между бактериальными патогенами и их позвоночными хозяевами. PLoS Патог. 6:e1000949. 10.1371/journal.ppat.1000949 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Litwin CM, Calderwood SB. 1993. Роль железа в регуляции генов вирулентности. клин. микробиол. преп. 6:137–149 [бесплатная статья PMC] [PubMed] [Google Scholar]
20. Абдул-Техрани Хадсон А.Дж., Юнг-Шенг С., Тиммс А.Р., Хокинс С., Уильямс Дж.М., Харрисон П.М., Гест Дж.Р., Эндрюс С.К. 1999. Мутанты ферритина Escherichia coli имеют дефицит железа и нарушение роста, а мутанты fur имеют дефицит железа. Дж. Бактериол. 181:1415–1428 [бесплатная статья PMC] [PubMed] [Google Scholar]
21. Мишель К.П., Писториус Э.К.
2004.
Адаптация фотосинтетической цепи переноса электронов у цианобактерий к дефициту железа: функция IdiA и IsiA. Физиол. Завод.
120:36–50. 10.1111/j.0031-9317.2004.0229.x [PubMed] [CrossRef] [Google Scholar]
Физиол. Завод.
120:36–50. 10.1111/j.0031-9317.2004.0229.x [PubMed] [CrossRef] [Google Scholar]
22. Bullen J, Griffiths E, Rogers H, Ward G. 2000. Сепсис: решающая роль железа. микробы заражают. 2: 409–415. 10.1016/S1286-4579(00)00326-9 [PubMed] [CrossRef] [Google Scholar]
23. Эндрюс С.К., Робинсон А.К., Родригес-Киньонес Ф. 2003. Бактериальный гомеостаз железа. ФЭМС микробиол. преп. 27:215–237. 10.1016/S0168-6445(03)00055-X [PubMed] [CrossRef] [Google Scholar]
24. Newton SMC, Igo JD, Scott DC, Klebba PE. 1999. Влияние делеций петли на связывание и транспорт трехвалентного энтеробактина с помощью FepA. Мол. микробиол. 32:1153–1165. 10.1046/j.1365-2958.1999.01424.x [PubMed] [CrossRef] [Google Scholar]
25. Браун В., Браун М. 2002. Транспорт железа и передача сигналов у Escherichia coli. ФЭБС лат. 529:78–85. 10.1016/S0014-5793(02)03185-X [PubMed] [CrossRef] [Google Scholar]
26. Raymond KN, Dertz EA, Kim SS.
2003.
Энтеробактин: архетип микробного транспорта железа. проц. Натл. акад. науч. США.
100:3584–3588. 10.1073/pnas.0630018100 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США.
100:3584–3588. 10.1073/pnas.0630018100 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Смит А.В. 1998. Железное голодание и сидерофор-опосредованный транспорт железа. Методы микробиол. 27:331–342. 10.1016/S0580-9517(08)70294-0 [CrossRef] [Google Scholar]
28. Erdner DL, Anderson DM. 1999. Ферредоксин и флаводоксин как биохимические индикаторы ограничения железа при обогащении железом в открытом океане. Лимнол. океаногр. 44:1609–1615. 10.4319/lo.1999.44.7.1609 [CrossRef] [Google Scholar]
29. Herbert D, Elsworth R, Telling RC. 1956. непрерывная культура бактерий; теоретическое и экспериментальное исследование. J. Gen. Microbiol. 14:601–622. 10.1099/00221287-14-3-601 [PubMed] [CrossRef] [Google Scholar]
30. Novick A, Szilard L. 1950. Описание хемостата. Наука 112: 715–716. 10.1126/science.112.2920.715 [PubMed] [CrossRef] [Google Scholar]
31. Boer VM, Crutchfield CA, Bradley PH, Botstein D, Rabinowitz JD. 2010.
Внутриклеточные метаболиты, ограничивающие рост, у дрожжей, растущих в условиях различных ограничений питательных веществ. Мол. биол. Клетка
21:198–211. 10.1091/mbc.E09-07-0597 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2010.
Внутриклеточные метаболиты, ограничивающие рост, у дрожжей, растущих в условиях различных ограничений питательных веществ. Мол. биол. Клетка
21:198–211. 10.1091/mbc.E09-07-0597 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. О’Фаррелл PH. 1975 год. Двумерный электрофорез белков высокого разрешения. Дж. Биол. хим. 250:4007–4021 [бесплатная статья PMC] [PubMed] [Google Scholar]
33. Шевченко А., Дженсен О.Н., Подтележников А.В., Саглиокко Ф., Вильм М., Ворм О., Мортенсен П., Бушери Х., Манн М. 1996. Связывание генома и протеома с помощью масс-спектрометрии: крупномасштабная идентификация дрожжевых белков из двумерных гелей. проц. Натл. акад. науч. США. 93:14440–14445. 10.1073/pnas.93.25.14440 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Дюршмид К., Райшер Х., Шмидт-Хек В., Гребичек Т., Гутке Р., Рицци А., Байер К.
2008.
Мониторинг профилей транскриптома и протеома для изучения клеточного ответа E. coli на экспрессию рекомбинантного белка в определенных условиях хемостата. Дж. Биотехнология.
135:34–44. 10.1016/j.jbiotec.2008.02.013 [PubMed] [CrossRef] [Google Scholar]
Дж. Биотехнология.
135:34–44. 10.1016/j.jbiotec.2008.02.013 [PubMed] [CrossRef] [Google Scholar]
35. Lok C-N, Ho CM, Chen R, He QY, Yu WY, Sun H, Tam PK-H, Chiu J-F, Che СМ. 2006. Протеомный анализ механизма антибактериального действия наночастиц серебра. Дж. Протеом Рез. 5:916–924. 10.1021/pr0504079 [PubMed] [CrossRef] [Google Scholar]
36. Людерс С., Фалле С., Франко-Лара Э. 2009. Анализ протеома реакции кишечной палочки на тепловой шок в стационарных условиях. протеомная наука. 7:36. 10.1186/1477-5956-7-36 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Schliep M, Ryall B, Ferenci T. 2012. Идентификация глобальных паттернов и уникальных сигнатур белков в 14 средах с использованием протеомики наружных мембран бактерий. Мол. Биосист. 8:3017–3027. 10.1039/c2mb25212k [PubMed] [CrossRef] [Google Scholar]
38. Tang Y, Quail MA, Artymiuk PJ, Green J.
2002.
Аконитазы Escherichia coli и окислительный стресс: посттранскрипционная регуляция экспрессии sodA . микробиология
148: 1027–1037
http://mic.sgmjournals.org/content/148/4/1027.long [PubMed] [Google Scholar]
микробиология
148: 1027–1037
http://mic.sgmjournals.org/content/148/4/1027.long [PubMed] [Google Scholar]
39. Wick LM, Quadroni M, Egli T. 2001. Краткосрочные и долговременные изменения состава протеома и кинетических свойств в культуре Escherichia coli при переходе от глюкозо-избыточных к глюкозо-лимитированным условиям роста в непрерывной культуре и наоборот. Окружающая среда. микробиол. 3: 588–599. 10.1046/j.1462-2920.2001.00231.x [PubMed] [CrossRef] [Google Scholar]
40. Golec P, Karczewska-Golec J, Voigt B, Albrecht D, Schweder T, Hecker M, Węgrzyn G, Лось М. 2013. Протеомные профили и кинетика развития бактериофага Т4 и его мутантов rI и rIII в медленно растущей Escherichia coli. Дж. Генерал Вирол. 94:896–905. 10.1099/vir.0.048686-0 [PubMed] [CrossRef] [Google Scholar]
41. McHugh JP, Rodríguez-Quiñones F, Hossein AT, Svistunenko DA, Poole RK, Cooper CE, Andrews SC.
2003.
Глобальная железозависимая регуляция генов у Escherichia coli: новый механизм гомеостаза железа.
42. Massé E, Gottesman S. 2002. Малая РНК регулирует экспрессию генов, участвующих в метаболизме железа в Escherichia coli. проц. Натл. акад. науч. США. 99:4620–4625. 10.1073/pnas.032066599 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Ihssen J, Egli T. 2004. Удельная скорость роста, а не плотность клеток контролируют общий стрессовый ответ Escherichia coli. микробиология 150: 1637–1648. 10.1099/mic.0.26849-0 [PubMed] [CrossRef] [Google Scholar]
44. Ihssen J, Egli T. 2005. Общий физиологический анализ растущей Escherichia coli с ограничением по углероду и энергии подтверждает высокую степень катаболической гибкости и готовности к использованию смешанного субстрата. Окружающая среда. микробиол. 7: 1568–1581. 10.1111/j.1462-2920.2005.00846.x [PubMed] [CrossRef] [Google Scholar]
45. Carlson RP.
2007.
Анализ затрат и выгод метаболических систем для интерпретации сетевой структуры и регулирования. Биоинформатика
23:1258–1264. 10.1093/bioinformatics/btm082 [PubMed] [CrossRef] [Google Scholar]
Биоинформатика
23:1258–1264. 10.1093/bioinformatics/btm082 [PubMed] [CrossRef] [Google Scholar]
46. Carlson RP. 2009. Разложение сложного микробного поведения на стрессовые реакции, основанные на ресурсах. Биоинформатика 25:90–97. 10.1093/bioinformatics/btn589 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Flamholz A, Noor E, Bar-Even A, Liebermeister W, Milo R. 2013. Гликолитическая стратегия как компромисс между выходом энергии и стоимостью белка. проц. Натл. акад. науч. США. 110:10039–10044. 10.1073/pnas.1215283110 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Моленаар Д., ван Берло Р., де Риддер Д., Теусинк Б. 2009. Сдвиги в стратегиях роста отражают компромиссы в сотовой экономике. Мол. Сист. биол. 5:323. 10.1038/msb.2009.82 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Holzhutter HG.
2004.
Принцип минимизации потоков и его применение для оценки стационарных потоков в метаболических сетях. Евро. Дж. Биохим.
271:2905–2922. 10.1111/j.1432-1033.2004.04213.x [PubMed] [CrossRef] [Google Scholar]
Дж. Биохим.
271:2905–2922. 10.1111/j.1432-1033.2004.04213.x [PubMed] [CrossRef] [Google Scholar]
50. Ausubel F, Brent R, Kingston R, Moore D, Seidman JG, Smith JA, Struhl K. (ed). 1992. Краткие протоколы по молекулярной биологии, 2-е изд. Greene Publishing Associates and John Wiley & Sons, New York, NY [Google Scholar]
51. Riemer J, Hoepken HH, Czerwinska H, Robinson SR, Dringen R. 2004. Колориметрический анализ на основе феррозина для количественного определения железа в культивируемых клетках. Анальный. Биохим. 331: 370–375. 10.1016/j.ab.2004.03.049 [PubMed] [CrossRef] [Google Scholar]
52. Liu X, Ferenci T. 1998. Регуляция порин-опосредованной проницаемости внешней мембраны путем ограничения питательных веществ в Escherichia coli. Дж. Бактериол. 180:3917–3922 [бесплатная статья PMC] [PubMed] [Google Scholar]
53. Senn H, Lendenmann U, Snozzi M, Hamer G, Egli T.
1994.
Рост Escherichia coli в культурах хемостата с ограниченным содержанием глюкозы: повторное исследование кинетики. Биохим. Биофиз. Акта
1201: 424–436. 10.1016/0304-4165(94)-8 [PubMed] [CrossRef] [Google Scholar]
Биохим. Биофиз. Акта
1201: 424–436. 10.1016/0304-4165(94)-8 [PubMed] [CrossRef] [Google Scholar]
54. Searle PL. 1984. Реакция Бертло или индофенола и ее использование в аналитической химии азота: обзор. Аналитик 109: 549–568. 10.1039/an9840
9 [CrossRef] [Google Scholar]
55. Стиг С. 2005. 4500-NH 3 F фенатный метод, стр. 4–114 В Eaton AD, Clesceri LS, Rice EW, Greenberg AE, Franson MAH. (ред.), Стандартные методы исследования воды и сточных вод, 21-е (столетие) изд. Американская ассоциация общественного здравоохранения/Американская ассоциация водопроводных сооружений/Федерация водной среды, Вашингтон, округ Колумбия [Google Scholar]
56. Schwyn B, Neilands JB. 1987. Универсальный химический тест для обнаружения и определения сидерофоров. Анальный. Биохим. 160:47–56. 10.1016/0003-2697(87)90612-9 [PubMed] [CrossRef] [Google Scholar]
57. Драц Э.А., Грико П.А.
январь
2004.
Цвиттерионные красители для мечения в протеомных и других биологических анализах. патент США
7 582 260
патент США
7 582 260
58. Шипман М., Любик К., Фушар Д., Гурам Р., Грико П., Ютила М., Драц Э.А. 2012. Протеомный и системный биологический анализ моноцитов, подвергшихся воздействию секуринина, антагониста рецептора GABA A и иммунного адъюванта. PLoS один 7:e41278. 10.1371/journal.pone.0041278 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Кандиано Г., Бруски М., Мусанте Л., Сантуччи Л., Гиггери Г.М., Карнемолла Б., Ореккья П., Зарди Л., Ригетти П.Г. 2004. Голубое серебро: очень чувствительное окрашивание коллоидным кумасси G-250 для анализа протеома. Электрофорез 25:1327–1333. 10.1002/elps.200305844 [PubMed] [CrossRef] [Google Scholar]
60. Хартманн А., Браун В. 1981. Поглощение железа и железо ограничивают рост Escherichia coli K-12. Арка микробиол. 130:353–356. 10.1007/BF00414599 [PubMed] [CrossRef] [Google Scholar]
61. Александр М.Л., Рамкришна Д.
1991.
Кибернетическое моделирование ограниченного роста железа и производства сидерофоров. Биотехнолог. биоинж.
38:637–652. 10.1002/bit.260380609 [PubMed] [CrossRef] [Google Scholar]
Биотехнолог. биоинж.
38:637–652. 10.1002/bit.260380609 [PubMed] [CrossRef] [Google Scholar]
62. Castan A, Sven-Olof E. 2002. Накопление формиата за счет высвобождения ДНК при аэробном культивировании Escherichia coli. Биотехнолог. биоинж. 77:324–328. 10.1002/bit.1198 [PubMed] [CrossRef] [Google Scholar]
63. Де Мезенейр С.Л., Де Мей М., Вандедринк С., Вандамм Э.Дж. 2006. Метаболическая характеристика мутантов цитратсинтазы и фосфоенолпируваткарбоксилазы E. coli в аэробных культурах. Биотехнолог. лат. 28:1945–1953. 10.1007/s10529-006-9182-8 [PubMed] [CrossRef] [Google Scholar]
64. Alexeeva S, de Kort B, Sawers G, Hellingwerf KJ, Teixeira JM. 2000. Влияние ограниченной аэрации и системы ArcAB на промежуточный катаболизм пирувата в Escherichia coli. Дж. Бактериол. 182:4934–4940. 10.1128/JB.182.17.4934-4940.2000 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Alexeeva S, Hellingwerf KJ, de Mattos MJT.
2002.
Количественная оценка доступности кислорода: воспринимаемый аэробиоз и его влияние на распределение потока в дыхательной цепи кишечной палочки. Дж. Бактериол.
184: 1402–1406. 10.1128/JB.184.5.1402-1406.2002 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Бактериол.
184: 1402–1406. 10.1128/JB.184.5.1402-1406.2002 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Sauer U, Lasko DR, Fiaux J, Hochuli M, Glaser R, Szyperski T, Wüthrich K, Bailey JE. 1999. Анализ соотношения метаболических потоков генетических и экологических модуляций центрального углеродного метаболизма Escherichia coli. Дж. Бактериол. 181:6679–6688 [бесплатная статья PMC] [PubMed] [Google Scholar]
67. Lin J, Smith MP, Chapin KC, Baik HS, Bennett GN, Foster JW. 1996. Механизмы кислоторезистентности энтерогеморрагической кишечной палочки. заявл. Окружающая среда. микробиол. 62:3094–3100 [бесплатная статья PMC] [PubMed] [Google Scholar]
68. Моро Пл. 2007. Лизиндекарбоксилаза CadA защищает Escherichia coli, лишенную фосфатов, от кислот брожения. Дж. Бактериол. 189: 2249–2261. 10.1128/JB.01306-06 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Griggs DW, Tharp BB, Konisky J.
1987.
Клонирование и идентификация промотора регулируемого железом гена cir Escherichia coli. Дж. Бактериол.
169:5343–5352 [бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Бактериол.
169:5343–5352 [бесплатная статья PMC] [PubMed] [Google Scholar]
70. Alteri CJ, Mobley HLT. 2007. Количественный профиль протеома наружной мембраны уропатогенной кишечной палочки при росте в моче человека. Заразить. Иммун. 75:2679–2688. 10.1128/IAI.00076-06 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Hagan EC, Mobley HLT. 2007. Уропатогенные антигены внешней мембраны Escherichia coli экспрессируются при инфекции мочевыводящих путей. Заразить. Иммун. 75:3941–3949. 10.1128/IAI.00337-07 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Molloy MP, Herbert BR, Slade MB, Rabilloud T, Nouwens AS, Williams KL, Gooley AA. 2000. Протеомный анализ внешней мембраны кишечной палочки. Евро. Дж. Биохим. 267: 2871–2881. 10.1046/j.1432-1327.2000.01296.x [PubMed] [CrossRef] [Google Scholar]
73. Fischer E, Sauer U.
2003.
Новый метаболический цикл катализирует окисление глюкозы и анаплероз у голодных кишечных палочек. Дж. Биол. хим.
278:46446–46451. 10.1074/jbc.M307968200 [PubMed] [CrossRef] [Google Scholar]
Биол. хим.
278:46446–46451. 10.1074/jbc.M307968200 [PubMed] [CrossRef] [Google Scholar]
74. Hua Q, Yang C, Oshima T, Mori H, Shimizu K. 2004. Анализ экспрессии генов в Escherichia coli в ответ на изменение лимитирующего рост питательного вещества в культурах хемостата. заявл. Окружающая среда. микробиол. 70:2354–2366. 10.1128/AEM.70.4.2354-2366.2004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Карлсон Р.П., Таффс Р.Л. 2010. Компромиссы на молекулярном уровне и метаболическая адаптация к одновременным стрессорам. Курс. мнение Биотехнолог. 21: 670–676. 10.1016/j.copbio.2010.05.011 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Massé E, Vanderpool CK, Gottesman S. 2005. Влияние малой РНК RyhB на глобальное использование железа в Escherichia coli. Дж. Бактериол. 187:6962–6971. 10.1128/JB.187.20.6962-6971.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Blank L, Green J, Guest JR.
2002.
AcnC Escherichia coli представляет собой 2-метилцитратдегидратазу (PrpD), которая может использовать цитрат и изоцитрат в качестве субстратов.

 Так достигается важный контакт малыша и родителя, который важно поддерживать для полноценного развития.
Так достигается важный контакт малыша и родителя, который важно поддерживать для полноценного развития. Такая методика очень интересна для малышей. А детки после 3 лет уже сами могут наиграть простейший куплет и спеть песенку.
Такая методика очень интересна для малышей. А детки после 3 лет уже сами могут наиграть простейший куплет и спеть песенку.