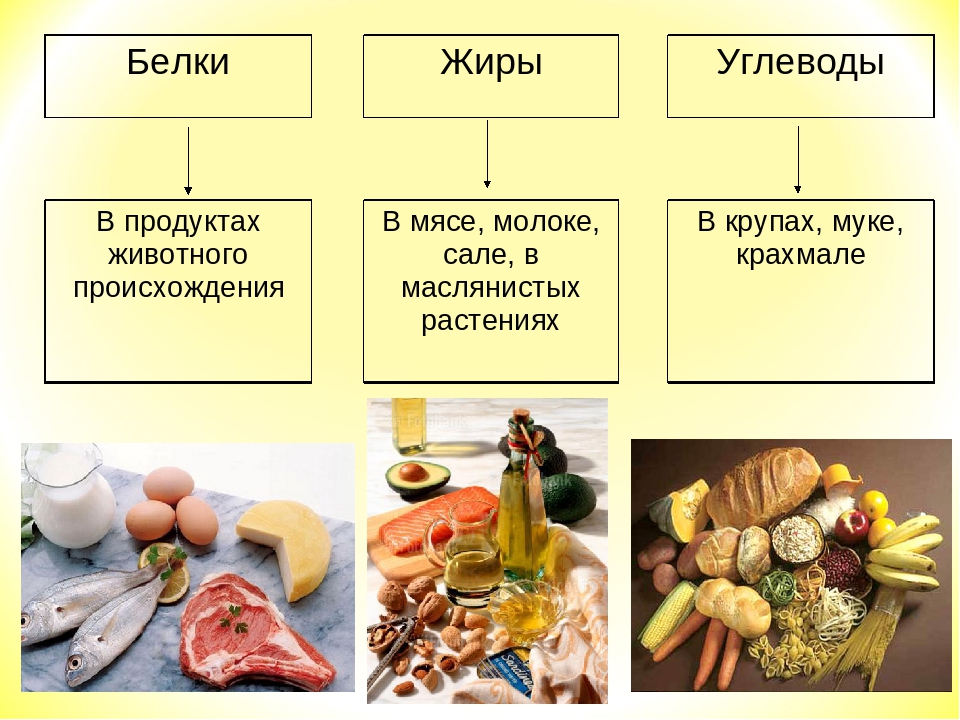
Пищевые вещества
Питание является одним из важнейших факторов, определяющих здоровье человека. Питание должно быть безопасным, качественным, соответствовать физиологическим и возрастным потребностям человека и обеспечивать поступление всех необходимых питательных веществ.
Пищевые вещества (нутриенты) — это химические вещества, составные части пищевых продуктов, которые организм использует для построения, обновления и исправления своих органов и тканей, а также для получения из них энергии для выполнения работы.
Различают две группы пищевых веществ. Одна группа называется основными пищевыми веществами или макронутриентами (от греческого «макрос» — большой). Пищевые вещества другой группы называются микронутриентами (от греческого «микрос» — малый), в которую входят витамины и минеральные вещества.
Макронутриенты или основные пищевые вещества — белки, жиры и углеводы — нужны человеку в количествах, измеряемых несколькими десятками граммов.
Микронутриенты — витамины и минеральные вещества — нужны человеку и находятся в пище в очень малых количествах — в миллиграммах или микрограммах. Они не являются источниками энергии, но участвуют в усвоении энергии пищи, в регуляции функций в осуществлении процессов роста и развития организма.
Помимо этого, пищевые вещества подразделяются на незаменимые и заменимые. Незаменимые пищевые вещества – это 10 аминокислот, в ходящие в состав белков, некоторые жирные кислоты, витамины, минеральные вещества, которые не образуются в организме, но необходимы для нормального обмена веществ.
Среди всех пищевых веществ есть вещества, которые не образуются в организме человека. Эти пищевые вещества называются незаменимыми или эссенциальными.
Они обязательно должны поступать с пищей. Отсутствие в пище любого из этих пищевых веществ приводит к заболеванию, а при длительном недостатке — к смерти, независимо от того, много или мало нужно такого вещества.
Заменимые пищевые вещества могут образоваться в организме человека из незаменимых пищевых веществ. Поэтому они называются заменимыми, т.е. их можно заменить, имея в достатке незаменимые пищевые вещества. Однако заменимые пищевые вещества также должны поступать с пищей в определенных количествах, так как они служат источниками энергии.
Все пищевые вещества составляют 6 главных групп — углеводы, белки, жиры, витамины, минеральные вещества и вода.
Кроме того, пища содержит большое количество других биологически активных веществ, имеющих значение для сохранения здоровья и профилактики многих хронических заболеваний. К ним относится множество химических компонентов, содержащихся преимущественно в растительных продуктах, объединяемых общим названием фитосоединения.
Потребление необходимого количества пищевых веществ и в нужных соотношениях составляет один из основных научных принципов оптимального, здорового питания.
Именно об этих питательных веществах здесь поговорим подробнее.
Белок является важным компонентом каждой клетки в о… читать далее
Пять основных питательных веществ — Лечебно-диагностический центр
11 мая 2021Организм человека требует 300 питательных веществ, это означает, что он не может их производить, и их нужно получать из своего рациона. Основные питательные вещества относятся к шести классам: углеводы, жиры, белки, минералы, витамины и вода.
Жизненно важное питательное вещество — это питательное вещество, которое организм не может производить самостоятельно — или производит в недостаточном количестве, поэтому оно должно поступать из диеты. Эти питательные вещества являются обязательными для организма для правильного функционирования. Шесть жизненно важных питательных веществ включают углеводы, белки, жиры, витамины, минералы и воду.
Эти питательные вещества являются обязательными для организма для правильного функционирования. Шесть жизненно важных питательных веществ включают углеводы, белки, жиры, витамины, минералы и воду.
Углеводы
Углеводы являются основным источником жизни для мозга. За исключением приема углеводов, организм не может правильно выполнять основные физиологические функции. Источники углеводов включают хлеб и злаки, фрукты, крахмалистые овощи и сахара. Половина зерна, которые вы едите, должна быть цельной. Фрукты и цельные зерна полны клетчатки, которая помогает поддерживать нормальный уровень глюкозы в крови и снижает вероятность ишемической болезни сердца.
Белок
Белок является ключевым структурным компонентом клеток и отвечает за построение и восстановление мышц. Белок расщепляется на аминокислоты, которые являются блоками белка. Девять из 20 аминокислот являются незаменимыми аминокислотами, которые следует употреблять в пищу, так как они не могут вырабатываться организмом. От 10 до 35% ваших ежедневных калорий должны поступать из нежирных источников белка, таких как молочные продукты, мясо с низким содержанием жира или яйца.
Жир
Жир дает нам энергию, при его потреблении увеличивается использование жирорастворимых витаминов, в том числе витаминов A, D, E и K. Потребление жиров должно составлять от 20 до 35% суточной нормы. Выбирайте полезные продукты, богатые омега-3, такие, как грецкие орехи, рыба и растительные масла. Рекомендуется употреблять насыщенные жиры в ограниченном количестве, такие как мясо с высоким содержанием жиров и жирные молочные продукты. Другие проницательные варианты — орехи, семена и авокадо.
Витамины
Витамин С необходим для выработки коллагена, который обеспечивает структуру кровеносных сосудов, костей и связок. Богатыми источниками являются цитрусовые, клубника и перец. Фолиевая кислота, содержащаяся в пищевых продуктах, помогает предотвратить врожденные дефекты. Беременным женщинам всегда рекомендуется принимать добавки фолиевой кислоты, а женщинам, которые планируют забеременеть, следует поговорить с врачом о приеме добавки фолиевой кислоты вместе со сбалансированным питанием.
Минералы
Натрий помогает поддерживать объем жидкости вне клеток и помогает клеткам функционировать в обычном режиме. Нужно потреблять 2400 миллиграммов в день. Калий поддерживает объем жидкости внутри и снаружи клеток и предотвращает дополнительное повышение кровяного давления при большем потреблении натрия.
Наш медицинский центр всегда готов предоставить вам эффективное лечение
Мы открыты в самое удобное время: часы работы клиники: пн-вс. 9:00-21:00
Наши специалисты всегда готовы оказать вам максимально полную профессиональную помощь
Записаться на прием круглосуточно
8 (495) 150-03-02Что такое химическая реакция? | Глава 6: Химические изменения
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 6.1
Ключевые понятия:
- Физическое изменение, такое как изменение состояния или растворение, не создает новое вещество, а химическое изменение создает.

- В химической реакции взаимодействующие друг с другом атомы и молекулы называются реагентами.
- В химической реакции атомы и молекулы, образующиеся в результате реакции, называются продуктами.
- В химической реакции в продукты могут попасть только атомы, присутствующие в реагентах. Новые атомы не создаются и не разрушаются.
- В химической реакции реагенты контактируют друг с другом, связи между атомами в реагентах разрываются, атомы перестраиваются и образуют новые связи, образуя продукты.
Резюме
Учитель использует небольшое пламя свечи, чтобы продемонстрировать химическую реакцию между воском свечи и кислородом воздуха. Студенты увидят молекулярную анимацию горения метана и кислорода как модель подобной реакции. Учащиеся будут использовать вырезки моделей атомов, чтобы смоделировать реакцию и увидеть, что все атомы в реагентах проявляются в продуктах.
Задача
Учащиеся смогут объяснить, что для того, чтобы произошла химическая реакция, связи между атомами в реагентах разрываются, атомы перестраиваются и образуются новые связи между атомами для образования продуктов. Студенты также смогут объяснить, что в химической реакции атомы не образуются и не разрушаются.
Студенты также смогут объяснить, что в химической реакции атомы не образуются и не разрушаются.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки. Будьте осторожны при зажигании свечи. Убедитесь, что спичка и свеча полностью погашены, когда вы закончите демонстрацию.
Материалы для демонстрации
- Чайная свеча или другая небольшая стабильная свеча
- совпадений
- Стеклянная банка, достаточно большая, чтобы ее можно было поставить над свечой
Материалы для каждого учащегося
- Вырезки атомов из рабочего листа
- Лист цветной бумаги или плотной бумаги
- Цветные карандаши
- Ножницы
- Клей или лента
Рассмотрите, что происходит во время физического изменения, и познакомьте с понятием химического изменения.

Скажите учащимся, что в предыдущих главах они изучали различные аспекты физических изменений. Когда атомы и молекулы ускоряются или замедляются, это физическое изменение. Когда они меняют свое состояние с жидкого на твердое или с газообразного на жидкое, это физическое изменение. Когда вещество растворяется в воде или каком-либо другом растворителе, новое вещество на самом деле не образуется. Ионы или молекулы все еще могут собраться вместе, чтобы сформировать исходное вещество.
Сообщите учащимся, что в этой главе они будут изучать, что происходит во время химического превращения. При химическом изменении атомы в реагентах перестраиваются и связываются друг с другом по-разному, образуя один или несколько новых продуктов с другими характеристиками, чем у реагентов. Когда образуется новое вещество, это изменение называется химическим изменением.
В качестве демонстрации зажгите свечу и объясните, что происходит, используя термины
реагенты , продукты и химическая реакция .
Объясните, что в большинстве химических реакций два или более вещества, называемые реагентами , взаимодействуют с образованием различных веществ, называемых продуктами. Скажите учащимся, что горение свечи является примером химической реакции.
Материалы для демонстрации
- Чайная свеча или другая небольшая устойчивая свеча
- Совпадений
- Стеклянная банка, достаточно большая, чтобы ее можно было поставить над свечой
Процедура
- Осторожно зажгите чайную свечу или другую маленькую свечу.
- Держите свечу горящей, пока вы задаете ученикам приведенные ниже вопросы. Вы потушите свечу во второй части демонстрации.
Ожидаемые результаты
Фитиль загорится, а пламя будет поддерживаться химической реакцией.
Следующий вопрос непрост, и на данный момент учащиеся не должны знать ответ. Тем не менее, если рассматривать горение свечи с точки зрения химической реакции, это будет хорошей отправной точкой для понимания того, что имеется в виду, когда вещества вступают в химическую реакцию.

Спросите студентов:
- Как вы думаете, какие реагенты участвуют в этой химической реакции?
- Реагентами являются воск и кислород воздуха.
Студенты часто говорят, что горит нить или фитиль. Верно, что нить фитиля горит, но это воск на нитке, а не столько сама нить, которая горит и поддерживает горение свечи. Объясните, что молекулы воска соединяются с кислородом воздуха, образуя углекислый газ и водяной пар.
Укажите учащимся, что это одна из основных характеристик химической реакции: в химической реакции атомы реагентов объединяются новыми и разными способами, образуя молекулы продуктов.
Студенты могут быть удивлены тем, что вода может быть получена в результате горения. Поскольку мы используем воду для тушения огня, может показаться странным, что вода на самом деле образуется в результате горения. Вы можете сообщить учащимся, что когда они «сжигают» пищу в своем теле, они также производят углекислый газ и воду.

Поставьте банку на свечу, чтобы помочь учащимся понять, что кислород является реагентом при горении свечи.
Напомните учащимся, что воздух представляет собой смесь газов. Объясните, что когда что-то горит, оно вступает в реакцию с кислородом воздуха.
Попросите учащихся сделать прогноз:
- Будет ли свеча гореть, если один из реагентов (воск или кислород) больше не доступен?
- Учащиеся могут предположить, что свеча не будет гореть, потому что для продолжения химической реакции необходимы оба реагента.
Процедура
Осторожно поставьте стеклянную банку на зажженную свечу.
Ожидаемые результаты
Пламя гаснет.
Спросите студентов:
- Как вы думаете, почему пламя гаснет, когда мы ставим банку на свечу?
- Помещение банки над свечой ограничивает количество кислорода в воздухе вокруг свечи. Без достаточного количества кислорода для реакции с воском химическая реакция не может произойти, и свеча не может гореть.

- Когда свеча горит какое-то время, она постепенно становится все меньше и меньше. Куда девается воск свечи?
- Когда горит свеча, кажется, что воск свечи «исчезает». Однако на самом деле он не исчезает: он вступает в химическую реакцию, и новые продукты попадают в воздух.
Примечание: некоторые любопытные студенты могут спросить, из чего сделано пламя. Это отличный вопрос, и на него не так просто ответить. Пламя горит парами воска. Свет пламени вызван процессом, называемым хемилюминесценцией. Энергия, высвобождаемая в результате химической реакции, заставляет электроны разных молекул переходить в более высокое энергетическое состояние. Когда электроны возвращаются вниз, энергия высвобождается в виде света.
Представьте химическое уравнение горения метана и объясните, что атомы перестраиваются, превращаясь в другие молекулы.
Объясните учащимся, что воск состоит из длинных молекул, называемых парафином, и что парафин состоит только из атомов углерода и атомов водорода, связанных вместе.
 Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.
Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.Спроецируйте изображение Химическая реакция между метаном и кислородом.
Покажите учащимся, что метан и кислород находятся в левой части химического уравнения, а углекислый газ и вода — в правой. Объясните, что молекулы слева — это реагенты, а молекулы справа — продукты. Когда свеча горела, парафин реагировал с кислородом воздуха с образованием углекислого газа и воды, подобно химической реакции между метаном и кислородом.
Объясните учащимся, что химическая формула метана – CH 4 . Это означает, что метан состоит из одного атома углерода и четырех атомов водорода.
Покажите учащимся, что другим реагентом являются две молекулы газообразного кислорода. Укажите, что каждая молекула газообразного кислорода состоит из двух атомов кислорода, связанных вместе.
 Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .
Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .Спросите студентов:
- Откуда берутся атомы, составляющие углекислый газ и воду в правой части уравнения?
- Атомы в продуктах образуются из атомов в реагентах. В химической реакции связи между атомами в реагентах разрываются, а атомы перестраиваются и образуют новые связи, образуя продукты.
Примечание: оставьте это уравнение спроецированным на протяжении всего занятия в разделе «Изучение» этого урока. Студенты должны будут обращаться к нему, когда они моделируют химическую реакцию.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьмите на вооружение» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций.
 Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.Предложите учащимся построить модель, показывающую, что в химической реакции атомы реагентов перестраиваются с образованием продуктов.
Вопрос для расследования
Откуда берутся атомы в продуктах химической реакции?
Материалы для каждого учащегося
- Вырезы модели Atom (углерод, кислород и водород)
- Лист цветной бумаги или плотной бумаги
- Цветные карандаши
- Ножницы
- Клей или лента
Процедура
Подготовить атомы
- Раскрасьте атомы углерода в черный цвет, атомы кислорода в красный цвет, а атомы водорода оставьте белыми.
- Используйте ножницы, чтобы аккуратно вырезать атомы.
Создание реактивов
На листе бумаги поместите атомы вместе, чтобы получились молекулы реагентов в левой части химического уравнения горения метана.

- Напишите химическую формулу под каждой молекулой реагентов. Также нарисуйте знак + между реагентами.
После того, как вы убедитесь, что учащиеся составили и записали формулы молекул реагентов, скажите учащимся, что они будут переставлять атомы в реагентах для образования продуктов.
Создание продуктов
- Нарисуйте стрелку после второй молекулы кислорода, чтобы показать, что происходит химическая реакция.
- Переставьте атомы в реагентах так, чтобы молекулы продуктов оказались справа от стрелки.
- Напишите химическую формулу под каждой молекулой продукта. Также нарисуйте знак + между продуктами.
Расскажите учащимся, что в химической реакции атомы реагентов расходятся, перестраиваются и образуют новые связи, образуя продукты.
Представьте химическое уравнение
- Предложите учащимся использовать оставшиеся атомы, чтобы снова составить реагенты, чтобы представить химическую реакцию в виде полного химического уравнения.

- Приклейте или приклейте скотчем атомы к бумаге, чтобы составить более надежное химическое уравнение горения метана.
- Предложите учащимся использовать оставшиеся атомы, чтобы снова составить реагенты, чтобы представить химическую реакцию в виде полного химического уравнения.
Помогите учащимся подсчитать количество атомов в каждой части уравнения.
Спроектируйте анимацию «Движущееся химическое уравнение горения метана».
Покажите учащимся, что атомы в метане и кислороде должны разделиться, как в их моделях. Также отметьте, что атомы располагаются по-разному и снова соединяются, образуя новые продукты. Это также похоже на их модель. Убедитесь, что учащиеся понимают, что атомы в продуктах образуются только из реагентов. Других атомов нет. Никакие новые атомы не создаются и никакие атомы не разрушаются.
Объясните учащимся, что химические реакции более сложны, чем упрощенная модель, показанная на анимации. Анимация показывает, что связи между атомами в реагентах разрываются, а атомы перестраиваются и образуют новые связи, образуя продукты. На самом деле реагенты должны столкнуться и взаимодействовать друг с другом, чтобы их связи разорвались и перестроились.
 Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.
Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.Подробнее о сжигании метана читайте в разделе «История учителя».
Помогите учащимся вместе ответить на следующий вопрос:
- Сколько атомов углерода, водорода и кислорода содержится в реагентах по сравнению с числом атомов углерода, водорода и кислорода в продуктах?
- Покажите учащимся, как использовать большое число (коэффициент) перед молекулой и маленькое число после атома молекулы (нижний индекс) для подсчета атомов в обеих частях уравнения. Объясните учащимся, что нижний индекс говорит о том, сколько атомов определенного типа содержится в молекуле. Коэффициент говорит, сколько существует молекул определенного типа. Таким образом, если перед молекулой стоит коэффициент, а после атома — нижний индекс, вам нужно умножить коэффициент на нижний индекс, чтобы получить количество атомов.

- Например, в продуктах химической реакции 2H 2 O. Коэффициент означает, что молекул воды две. Нижний индекс означает, что каждая молекула воды имеет два атома водорода. Поскольку в каждой молекуле воды два атома водорода, а молекул воды две, то атомов водорода должно быть 4 (2 × 2).
Таблица 1. Подсчет атомов в реагентах и продуктах химического уравнения горения метана. 903:00 Атомы Сторона реагента Сторона продукта Углерод Водород Кислород Примечание: Коэффициенты фактически показывают соотношение количества молекул в химической реакции.
 Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода.
Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода.Объясните, что в химической реакции масса сохраняется.
Спросите студентов:
- Атомы образуются или разрушаются в результате химической реакции?
- №
- Откуда ты знаешь?
- В исследованном нами химическом уравнении имеется одинаковое количество атомов каждого типа как на стороне реагента, так и на стороне продукта.
- При физическом изменении, например при переходе из твердого состояния в жидкое, само вещество на самом деле не меняется. Чем химическое изменение отличается от физического?
- При химическом изменении молекулы реагентов взаимодействуют с образованием новых веществ.
 При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.
При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.
Объясните, что еще один способ сказать, что атомы не образуются и не разрушаются в химической реакции, — это сказать: «Масса сохраняется».
Спроецируйте изображение Balanced Equation.
Объясните, что весы показывают, что масса метана и кислорода с одной стороны точно равна массе углекислого газа и воды с другой. Когда уравнение химической реакции написано, оно «уравновешено» и показывает, что атомы в реагентах в конечном итоге превращаются в продукты и что новые атомы не создаются и не разрушаются.
Расскажите о двух других реакциях горения и попросите учащихся проверить, сбалансированы ли они.
Сообщите учащимся, что, помимо воска и метана, распространенными углеводородами являются пропан (топливо для уличных газовых грилей) и бутан (топливо для одноразовых зажигалок). Попросите учащихся подсчитать количество атомов углерода, водорода и кислорода в реагентах и продуктах каждого уравнения, чтобы проверить, сбалансировано ли уравнение.
 Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.
Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.Зажигание уличного газового гриля — сжигание пропана
C 3 H 8 + 5O 2 → 3CO 2 + 4H 2 0
Использование одноразовой зажигалки — сжигание бутана
2C 4 H 10 + 13O 2 → 8CO 2 + 10H 2 O
После того, как учащиеся подсчитали каждый тип атома, просмотрите их ответы, чтобы убедиться, что они знают, как интерпретировать индексы и коэффициенты.
Химическая реакция | Определение, уравнения, примеры и типы
сжигание
Посмотреть все СМИ
- Ключевые люди:
- Антуан Лавуазье Клод-Луи Бертолле Вильгельм Оствальд Анри-Луи Ле Шателье Сэр Дерек Х. Р. Бартон
- Похожие темы:
- кислотно-основная реакция механизм реакции катализ окислительно-восстановительная реакция ионообменная реакция
Просмотреть весь связанный контент →
Популярные вопросы
Каковы основы химических реакций?
- Химическая реакция – это процесс, в котором одно или несколько веществ, также называемых реагентами, превращаются в одно или несколько различных веществ, известных как продукты.
 Вещества – это либо химические элементы, либо соединения.
Вещества – это либо химические элементы, либо соединения. - Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов. Свойства продуктов отличаются от свойств реагентов.
- Химические реакции отличаются от физических изменений, которые включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней.
Подробнее ниже: Основные понятия о химических реакциях
химический элемент
Узнайте об этом типе вещества, которое не может быть разложено на более простые вещества обычными химическими процессами.химическое соединение
Узнайте об этом типе вещества, которое можно разложить на более простые вещества с помощью обычных химических процессов.Что происходит с химическими связями, когда происходит химическая реакция?
Согласно современному взгляду на химические реакции, связи между атомами в реагентах должны быть разрушены, а атомы или фрагменты молекул снова собираются в продукты путем образования новых связей. Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
Энергия поглощается для разрыва связей, а энергия выделяется по мере образования связей. В некоторых реакциях энергия, необходимая для разрыва связей, больше энергии, выделяемой при образовании новых связей, и конечным результатом является поглощение энергии. Следовательно, в реакции могут образовываться различные типы связей. Кислотно-основная реакция Льюиса, например, включает образование ковалентной связи между основанием Льюиса, веществом, которое поставляет электронную пару, и кислотой Льюиса, веществом, которое может принимать электронную пару. Аммиак является примером основания Льюиса. Пара электронов, расположенных на атоме азота, может быть использована для образования химической связи с кислотой Льюиса.
химическая связь
Узнайте о различных типах химической связи.кислотно-основная реакция: реакции кислот Льюиса
Узнайте о кислотно-основных реакциях Льюиса.Как классифицируются химические реакции?
Химики классифицируют химические реакции несколькими способами: по типу продукта, по типу реагентов, по результату реакции и по механизму реакции. Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Часто данную реакцию можно отнести к двум или даже трем категориям, включая реакции газообразования и реакции осаждения. Многие реакции производят газ, такой как двуокись углерода, сероводород, аммиак или двуокись серы. Подъем теста для торта вызван газообразующей реакцией между кислотой и пищевой содой (гидрокарбонатом натрия). Классификация по типам реагентов включает кислотно-основные реакции и окислительно-восстановительные реакции, которые включают перенос одного или нескольких электронов от восстановителя к окислителю. Примеры классификации по результату реакции включают реакции разложения, полимеризации, замещения, отщепления и присоединения. Цепные реакции и реакции фотолиза являются примерами классификации по механизму реакции, которая дает подробную информацию о том, как атомы перетасовываются и повторно собираются при образовании продуктов.
Подробнее читайте ниже: Классификация химических реакций
кислотно-щелочные реакции
Узнайте о кислотно-щелочных реакциях.
окислительно-восстановительная реакция
Узнайте об окислительно-восстановительных или окислительно-восстановительных реакциях.цепная реакция
Узнайте о цепных или самоподдерживающихся реакциях.химическая реакция , процесс, в котором одно или несколько веществ, реагентов, превращаются в одно или несколько различных веществ, продуктов. Вещества – это либо химические элементы, либо соединения. Химическая реакция перестраивает составляющие атомы реагентов для создания различных веществ в качестве продуктов.
Химические реакции являются неотъемлемой частью технологии, культуры и самой жизни. Сжигание топлива, плавка железа, изготовление стекла и гончарных изделий, пивоварение, производство вина и сыра — вот лишь некоторые примеры деятельности, включающей химические реакции, которые были известны и использовались на протяжении тысячелетий. Химические реакции изобилуют в геологии Земли, в атмосфере и океанах, а также в огромном количестве сложных процессов, происходящих во всех живых системах.
Химические реакции следует отличать от физических изменений. Физические изменения включают изменения состояния, такие как таяние льда в воду и испарение воды в пар. Если произойдет физическое изменение, физические свойства вещества изменятся, но его химическая идентичность останется прежней. В любом физическом состоянии вода (H 2 O) — одно и то же соединение, каждая молекула которого состоит из двух атомов водорода и одного атома кислорода. Однако если вода в виде льда, жидкости или пара встречается с металлическим натрием (Na), атомы перераспределяются с образованием новых веществ: молекулярного водорода (H 2 ) и гидроксида натрия (NaOH). Таким образом, мы знаем, что произошло химическое изменение или реакция.
Исторический обзор
Концепция химической реакции возникла примерно 250 лет назад. Он берет свое начало в ранних экспериментах, которые классифицировали вещества как элементы и соединения, а также в теориях, объясняющих эти процессы. Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Развитие концепции химической реакции сыграло главную роль в определении науки химии, какой она известна сегодня.
Викторина «Британника»
Викторина «Наука»
Первые серьезные исследования в этой области были посвящены газам. Особое значение имело определение кислорода в 18 веке шведским химиком Карлом Вильгельмом Шееле и английским священником Джозефом Пристли. Влияние французского химика Антуана-Лорана Лавуазье было особенно заметным, поскольку его идеи подтвердили важность количественных измерений химических процессов. В своей книге Traité élémentaire de chimie (1789; Elementary Treatise on Chemistry ), Лавуазье определил 33 «элемента» — субстанции, не разделенные на более простые сущности. Среди своих многочисленных открытий Лавуазье точно измерил вес, прибавляемый при окислении элементов, и приписал результат соединению элемента с кислородом. Концепция химических реакций с участием комбинации элементов ясно возникла из его работ, и его подход побудил других заняться экспериментальной химией как количественной наукой.
Другим событием исторического значения, касающимся химических реакций, было развитие атомной теории. Большая заслуга в этом принадлежит английскому химику Джону Дальтону, постулировавшему свою атомную теорию в начале XIX века. Дальтон утверждал, что материя состоит из маленьких неделимых частиц, что частицы или атомы каждого элемента уникальны и что химические реакции связаны с перестройкой атомов с образованием новых веществ. Этот взгляд на химические реакции точно определяет текущий предмет. Теория Дальтона послужила основой для понимания результатов более ранних экспериментаторов, в том числе закона сохранения материи (материя не создается и не разрушается) и закона постоянного состава (все образцы вещества имеют одинаковый элементный состав).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас Таким образом, эксперимент и теория, два краеугольных камня химической науки в современном мире, вместе определили концепцию химических реакций.





 Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород.
Молекулы, состоящие только из углерода и водорода, называются углеводородами. Скажите учащимся, что вы будете использовать простейший углеводород (метан) в качестве модели, чтобы показать, как горит воск или любой другой углеводород. Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 .
Студентов может сбить с толку тот факт, что атом кислорода и молекула кислорода называются кислородом. Пусть студенты знают, что когда мы говорим о кислороде в воздухе, это всегда молекула кислорода, которая представляет собой два атома кислорода, связанных вместе, или O 2 . Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.

 Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.
Кроме того, анимация показывает, как все атомы в реагентах распадаются и перестраиваются, образуя продукты. Но во многих химических реакциях разрываются только некоторые связи, а группы атомов остаются вместе, поскольку реагенты образуют продукты.
 Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода.
Это не фактическое число, как в двух молекулах кислорода и одной молекуле метана, поскольку обычно реагируют миллиарды триллионов молекул. Коэффициент показывает, что молекул кислорода в два раза больше, чем молекул метана. Правильно было бы сказать, что в этой реакции на каждую молекулу метана приходится две молекулы кислорода. При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции.
При физическом изменении, таком как изменение состояния или растворение, не образуется никакой новой субстанции. Они должны записать количество атомов каждого типа в таблице на своем рабочем листе.
Они должны записать количество атомов каждого типа в таблице на своем рабочем листе. Вещества – это либо химические элементы, либо соединения.
Вещества – это либо химические элементы, либо соединения.