Слова «отгадка» морфологический и фонетический разбор
Объяснение правил деление (разбивки) слова «отгадка» на слоги для переноса.
Онлайн словарь Soosle.ru поможет: фонетический и морфологический разобрать слово «отгадка» по составу, правильно делить на слоги по провилам русского языка, выделить части слова, поставить ударение, укажет значение, синонимы, антонимы и сочетаемость к слову «отгадка».
Содержимое:
- 1 Слоги в слове «отгадка» деление на слоги
- 2 Как перенести слово «отгадка»
- 3 Морфологический разбор слова «отгадка»
- 4 Разбор слова «отгадка» по составу
- 5 Сходные по морфемному строению слова «отгадка»
- 6 Синонимы слова «отгадка»
- 7 Ударение в слове «отгадка»
- 8 Фонетическая транскрипция слова «отгадка»
- 9 Фонетический разбор слова «отгадка» на буквы и звуки (Звуко-буквенный)
- 10 Предложения со словом «отгадка»
- 11 Сочетаемость слова «отгадка»
- 12 Значение слова «отгадка»
- 13 Как правильно пишется слово «отгадка»
- 14 Ассоциации к слову «отгадка»
Слоги в слове «отгадка» деление на слоги
Количество слогов: 3
По слогам: о-тга-дка
По правилам школьной программы слово «отгадка» можно поделить на слоги разными способами. Допускается вариативность, то есть все варианты правильные. Например, такой:
Допускается вариативность, то есть все варианты правильные. Например, такой:
от-гад-ка
По программе института слоги выделяются на основе восходящей звучности:
о-тга-дка
Ниже перечислены виды слогов и объяснено деление с учётом программы института и школ с углублённым изучением русского языка.
т примыкает к этому слогу, а не к предыдущему, так как не является сонорной (непарной звонкой согласной)
д примыкает к этому слогу, а не к предыдущему, так как не является сонорной (непарной звонкой согласной)
Как перенести слово «отгадка»
от—гадка
отга—дка
отгад—ка
Морфологический разбор слова «отгадка»
Часть речи:
Имя существительное
Грамматика:
часть речи: имя существительное;
одушевлённость: неодушевлённое;
род: женский;
число: единственное;
падеж: именительный;
отвечает на вопрос: (есть) Что?
Начальная форма:
отгадка
Разбор слова «отгадка» по составу
| от | приставка |
| гад | корень |
| к | суффикс |
| а | окончание |
отгадка
Сходные по морфемному строению слова «отгадка»
Сходные по морфемному строению слова
Синонимы слова «отгадка»
1. разгадка
разгадка
2. решение
3. ответ
4. отгадывание
Ударение в слове «отгадка»
отга́дка — ударение падает на 2-й слог
Фонетическая транскрипция слова «отгадка»
[атг`атка]
Фонетический разбор слова «отгадка» на буквы и звуки (Звуко-буквенный)
| Буква | Звук | Характеристики звука | Цвет |
|---|---|---|---|
| о | [а] | гласный, безударный | о |
| т | [т] | согласный, глухой парный, твёрдый, шумный | т |
| г | [г] | согласный, звонкий парный, твёрдый, шумный | г |
| а | [`а] | гласный, ударный | а |
| д | [т] | согласный, глухой парный, твёрдый, шумный | д |
| к | [к] | согласный, глухой парный, твёрдый, шумный | к |
| а | [а] | гласный, безударный | а |
Число букв и звуков:
На основе сделанного разбора делаем вывод, что в слове 7 букв и 7 звуков.
Буквы: 3 гласных буквы, 4 согласных букв.
Звуки: 3 гласных звука, 4 согласных звука.
Предложения со словом «отгадка»
Тем не менее, насчёт обид ещё нужно подумать, вполне возможно, что отгадка кроется именно здесь.
Источник: Алексей Колик, Альтернатива: мы или конкуренты, 2015.
Загадка продолжения рода у этих зверьков имеет простую отгадку.
Источник: Д. Г. Бердышев, Самые необычные животные, 2013.
Рано или поздно отгадка найдётся.
Источник: Л. В. Кудрявцев, Звездный порт.
Сочетаемость слова «отгадка»
1. в поисках отгадки
2. найти отгадку
3. знать отгадку
4. (полная таблица сочетаемости)
Значение слова «отгадка»
ОТГА́ДКА , -и, род. мн. -док, дат. -дкам, ж. 1. Действие по знач. глаг. отгадать—отгадывать. (Малый академический словарь, МАС)
мн. -док, дат. -дкам, ж. 1. Действие по знач. глаг. отгадать—отгадывать. (Малый академический словарь, МАС)
Как правильно пишется слово «отгадка»
Правописание слова «отгадка»
Орфография слова «отгадка»
Правильно слово пишется: отга́дка
Нумерация букв в слове
Номера букв в слове «отгадка» в прямом и обратном порядке:
- 7
о
1 - 6
т
2 - 5
г
3 - 4
а
4 - 3
д
5 - 2
к
6 - 1
а
7
Ассоциации к слову «отгадка»
Загадка
Ключ
Пушкин
Обрывок
Догадка
Содержание
Чтение
Читатель
Мозг
Тайный
Простой
Правильный
Пышный
Пришлый
Крыться
Таиться
Ускользать
Подсказать
Угадать
Найти
Послужить
Подсказывать
Содержаться
Искать
Ломать
Заключаться
Где-то
Напрасно
5 основных частей URL: краткое руководство
- Блог Hubspot
- HubSpot.
 com
com
Загрузка
О нет! Мы не смогли найти ничего подобного.
Попробуйте еще раз поискать, и мы постараемся.
Оптимизируйте свой веб-сайт с помощью этого бесплатного контрольного списка.
Загрузить сейчас: Бесплатный контрольный список по оптимизации веб-сайта
Клиффорд Чи
Обновлено:
Опубликовано:
Если ваш веб-сайт структурирован как дом, то URL-адрес вашего веб-сайта похож на адрес этого дома. Он определяет, где находится ваш веб-сайт в Интернете, подобно тому, как ваш домашний адрес определяет, где вы живете в районе, помогая вашим посетителям легко найти ваш сайт.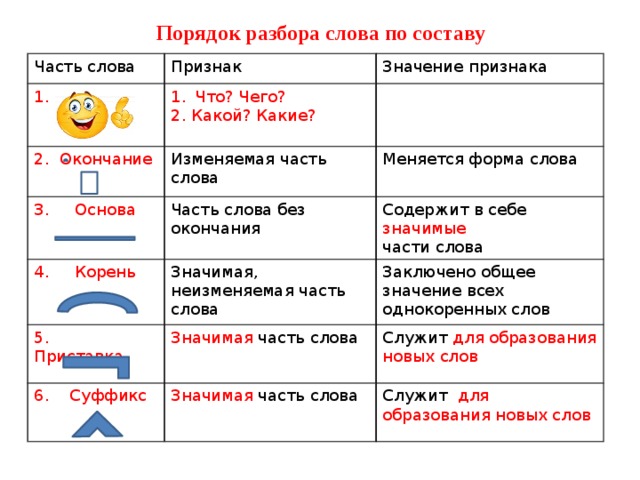
Технически существует пять частей URL, и они очень важны для оптимизации взаимодействия с пользователем (UX) и SEO вашего сайта. Чтобы помочь вам получить конкретное представление о каждой части URL-адреса, давайте подробно рассмотрим каждую из них.
Из каких частей состоит URL-адрес?
URL-адрес состоит из пяти частей: схемы, поддомена, домена верхнего уровня, домена второго уровня и подкаталога.
Ниже приведены иллюстрации различных частей URL-адреса.
Давайте разберем эту структуру URL ниже.
Структура URL
Схема
Схема сообщает веб-серверам, какой протокол использовать при доступе к странице вашего сайта.
В настоящее время наиболее распространенной схемой является HTTPS, что означает безопасный протокол передачи гипертекста. Он сообщает вашему веб-браузеру шифровать любую информацию, которую вы вводите на странице, например ваши пароли или информацию о кредитной карте, чтобы киберпреступники не могли получить к ней доступ. Этот протокол безопасности защищает посетителей вашего веб-сайта, и его реализация поможет вашему сайту лучше ранжироваться в Google. Вот почему внедрение SSL является обязательным в любом техническом руководстве по SEO.
Этот протокол безопасности защищает посетителей вашего веб-сайта, и его реализация поможет вашему сайту лучше ранжироваться в Google. Вот почему внедрение SSL является обязательным в любом техническом руководстве по SEO.
Другие схемы, которые вы можете увидеть, это mailto://, который может открыть поставщика услуг электронной почты по умолчанию на вашем компьютере, чтобы помочь вам составить электронное письмо на адрес электронной почты, который вы указали в URL-адресе, и ftp://, который является стандартным протоколом для передача компьютерных файлов между клиентом и сервером в компьютерной сети.
Субдомен
Если ваш веб-сайт похож на дом, ваши субдомены похожи на отдельные комнаты в этом доме. Субдомен в URL-адресе указывает, какую конкретную страницу вашего веб-сайта должен обслуживать веб-браузер. Например, поддомены, такие как «блог» или «предложения», будут предоставлять страницу блога или страницу предложений вашего веб-сайта.
Субдомены также распределяют ваш веб-сайт по основным категориям контента и показывают Google и вашим посетителям, что на вашем сайте есть больше информации, чем просто главная страница.
Домен второго уровня
Ваш домен второго уровня (SLD) — это имя вашего веб-сайта. Это помогает людям узнать, что они посещают сайт определенного бренда. Например, люди, которые посещают «mlb.com», знают, что они находятся на веб-сайте Высшей лиги бейсбола, и им не нужна дополнительная информация.
Домен верхнего уровня
Домен верхнего уровня (TLD) указывает, какой тип организации регистрирует ваша организация в Интернете.
Например, «.com» предназначен для коммерческих организаций в США, поэтому многие американские компании регистрируются с использованием домена верхнего уровня «.com». Точно так же «.edu» предназначен для академических учреждений в Соединенных Штатах, поэтому многие американские колледжи и университеты регистрируются в домене верхнего уровня «. edu».
edu».
Подкаталог
Подкаталог, также известный как подпапка, помогает людям и поисковым роботам понять, в каком именно разделе веб-страницы они находятся.
Например, если у вас есть интернет-магазин, в котором продаются футболки, кепки и кружки, один из URL-адресов вашего веб-сайта может выглядеть как «https://shop.yourstore.com/hats». Обратите внимание, что субдомен — это «магазин», а подкаталог — «шляпы». Это означает, что этот URL будет обслуживать страницу «Шляпы», которая является подпапкой страницы «Магазин». Футболки и кружки будут другими подпапками на этой странице.
Структура URL: тонкая, но важная
Несмотря на то, что URL-адреса могут показаться простыми и легкомысленными, на самом деле они важны для UX и SEO вашего веб-сайта. Теперь, когда вы понимаете каждую из частей URL, ознакомьтесь с сообщениями в блоге ниже, чтобы узнать больше о техническом SEO.0009
Темы: Техническое SEO
Не забудьте поделиться этим постом!
Связанные статьи
- hubspot.com/marketing/top-search-engines»>
Внутренняя ошибка сервера HTTP 500: что это значит и как это исправить
15 сентября 2022 г.
Постоянные ссылки: что это такое и как их структурировать для максимальной ценности SEO
04 февраля 2022 г.
hubspot.com/marketing/technical-seo-guide»>16 основных ошибок веб-сайтов, которых следует избегать в 2021 году [+ 16 простых исправлений]
28 окт. 2021 г.
hubspot.com/marketing/how-to-unindex-pages-from-search-engines»>Что такое перенаправление 301 и когда его следует использовать?
26 авг. 2021 г.
hubspot.com/marketing/504-gateway-timeout»>5 основных частей URL: краткое руководство
29 июля 2021 г.
Топ-6 поисковых систем по популярности
19 октября 2022 г.
Что такое веб-краулер? (50 слов или меньше)
18 февраля 2022 г.
Полное руководство по техническому SEO
29 окт. 2021 г.
Использование HTML-метатегов Noindex и Nofollow: как запретить Google индексировать страницу в поиске
13 окт. 2021 г.
Краткое и простое руководство по устранению ошибок 504 Gateway Timeout Errors
12 августа 2021 г.
2.4 Неорганические соединения, необходимые для жизнедеятельности человека – анатомия и физиология
Перейти к содержимому
Цели обучения
К концу этого раздела вы сможете:
- Сравнивать и сопоставлять неорганические и органические соединения
- Определите свойства воды, которые делают ее необходимой для жизни
- Объясните роль солей в функционировании организма
- Различать кислоты и основания и объяснять их роль в рН
- Обсудите роль буферов в поддержании гомеостаза рН организма
Понятия, которые вы уже изучили в этой главе, управляют всеми формами материи и могут служить основой как для геологии, так и для биологии. Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
Этот раздел главы сужает фокус до химии человеческой жизни; то есть соединения, важные для структуры и функций организма. Как правило, эти соединения являются либо неорганическими, либо органическими.
- Неорганическое соединение представляет собой вещество, не содержащее ни углерода, ни водорода. Многие неорганические соединения содержат атомы водорода, такие как вода (H 2 O) и соляная кислота (HCl), вырабатываемая желудком. Напротив, только несколько неорганических соединений содержат атомы углерода. Углекислый газ (CO 2 ) является одним из немногих примеров.
- Органическое соединение представляет собой вещество, которое содержит как углерод, так и водород. Органические соединения синтезируются посредством ковалентных связей в живых организмах, в том числе в организме человека. Вспомните, что углерод и водород являются вторым и третьим по распространенности элементами в вашем теле. Вскоре вы обнаружите, как эти два элемента сочетаются в продуктах, которые вы едите, в соединениях, составляющих структуру вашего тела, и в химических веществах, питающих ваше функционирование.

В следующем разделе рассматриваются четыре группы неорганических соединений, необходимых для жизни: вода, соли, кислоты и основания. Органические соединения рассматриваются далее в этой главе.
Вода
До 70 процентов массы тела взрослого человека составляет вода. Эта вода содержится как внутри клеток, так и между клетками, из которых состоят ткани и органы. Несколько ее функций делают воду незаменимой для жизнедеятельности человека.
Вода в качестве смазки и прокладки
Вода является основным компонентом многих смазочных жидкостей организма. Подобно тому, как масло смазывает дверные петли, вода в синовиальной жидкости смазывает движения суставов тела, а вода в плевральной жидкости помогает легким расширяться и сжиматься при дыхании. Водянистые жидкости способствуют прохождению пищи по пищеварительному тракту и обеспечивают движение соседних органов брюшной полости без трения.
Вода также защищает клетки и органы от физических травм, например, амортизирует мозг внутри черепа и защищает нежную нервную ткань глаз. Вода смягчает развивающийся плод и в утробе матери.
Вода смягчает развивающийся плод и в утробе матери.
Вода в качестве теплоотвода
Радиатор — это вещество или объект, который поглощает и рассеивает тепло, но не испытывает соответствующего повышения температуры. В организме вода поглощает тепло, выделяемое химическими реакциями, без значительного повышения температуры. Более того, когда температура окружающей среды резко возрастает, вода, хранящаяся в организме, помогает охлаждать тело. Этот охлаждающий эффект возникает, когда теплая кровь из ядра тела течет к кровеносным сосудам прямо под кожей и переносится в окружающую среду. В то же время потовые железы выделяют теплую воду вместе с потом. Когда вода испаряется в воздух, она уносит тепло, а затем более холодная кровь с периферии циркулирует обратно к ядру тела.
Вода как компонент жидких смесей
Смесь представляет собой комбинацию двух или более веществ, каждое из которых сохраняет свою химическую идентичность. Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Другими словами, составляющие вещества не связаны химически в новое, более крупное химическое соединение. Эту концепцию легко представить, если подумать о порошкообразных веществах, таких как мука и сахар; когда вы перемешиваете их вместе в миске, они, очевидно, не связываются, образуя новое соединение. Комнатный воздух, которым вы дышите, представляет собой смесь газов, состоящую из трех отдельных элементов — азота, кислорода и аргона — и одного соединения — двуокиси углерода. Существует три типа жидких смесей, все из которых содержат воду в качестве ключевого компонента; это растворы, коллоиды и суспензии.
Чтобы клетки в организме выжили, их необходимо поддерживать во влажном состоянии в жидкости на водной основе, называемой раствором. В химии жидкий раствор состоит из растворителя, который растворяет вещество, называемое растворенным веществом. Важной характеристикой растворов является их однородность; то есть молекулы растворенного вещества равномерно распределены по всему раствору. Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Если бы вы размешали чайную ложку сахара в стакане воды, сахар растворился бы в молекулах сахара, разделенных молекулами воды. Отношение сахара к воде в левой части стакана будет таким же, как отношение сахара к воде в правой части стакана. Если бы вы добавили больше сахара, соотношение сахара и воды изменилось бы, но распределение — при условии, что вы хорошо перемешали — все равно было бы равномерным.
Вода считается «универсальным растворителем» и считается, что жизнь не может существовать без воды из-за этого. Вода, безусловно, самый распространенный растворитель в организме; практически все химические реакции в организме происходят между соединениями, растворенными в воде. Поскольку молекулы воды полярны, с областями положительного и отрицательного электрического заряда, вода легко растворяет ионные соединения и полярные ковалентные соединения. Такие соединения называются гидрофильными или «водолюбивыми». Как было сказано выше, сахар хорошо растворяется в воде. Это связано с тем, что молекулы сахара содержат области полярных водородно-кислородных связей, что делает его гидрофильным. Неполярные молекулы, плохо растворяющиеся в воде, называются гидрофобными или «водобоязненными».
Неполярные молекулы, плохо растворяющиеся в воде, называются гидрофобными или «водобоязненными».
Концентрации растворенных веществ
В химии описаны различные смеси растворенных веществ и воды. Концентрация данного растворенного вещества — это количество частиц этого растворенного вещества в данном пространстве (кислород составляет около 21 процента атмосферного воздуха). В кровотоке человека концентрация глюкозы обычно измеряется в миллиграммах (мг) на децилитр (дл), а у здорового взрослого человека она составляет в среднем около 100 мг/дл. Другой метод измерения концентрации растворенного вещества — его молярность, то есть количество молей (М) молекул на литр (л). Моль элемента — это его атомный вес, а моль соединения — это сумма атомных весов его компонентов, называемая молекулярной массой. Часто используемым примером является расчет моля глюкозы с химической формулой C6h22O6. Используя периодическую таблицу, атомный вес углерода (С) составляет 12,011 грамма (г), а в глюкозе шесть атомов углерода, что дает общий атомный вес 72,066 г. Делая те же расчеты для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («молекулярная масса грамма» глюкозы). При добавлении воды для получения одного литра раствора получается один моль (1М) глюкозы. Это особенно полезно в химии из-за связи молей с «числом Авогадро». В моле любого раствора содержится одинаковое количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются тысячными долями моля или миллимолями (мМ).
Делая те же расчеты для водорода (H) и кислорода (O), молекулярная масса равна 180,156 г («молекулярная масса грамма» глюкозы). При добавлении воды для получения одного литра раствора получается один моль (1М) глюкозы. Это особенно полезно в химии из-за связи молей с «числом Авогадро». В моле любого раствора содержится одинаковое количество частиц: 6,02 × 10 23 . Многие вещества в кровотоке и других тканях тела измеряются тысячными долями моля или миллимолями (мМ).
Коллоид представляет собой смесь, похожую на тяжелый раствор. Частицы растворенного вещества состоят из крошечных сгустков молекул, достаточно больших, чтобы сделать жидкую смесь непрозрачной (поскольку частицы достаточно велики, чтобы рассеивать свет). Знакомыми примерами коллоидов являются молоко и сливки. В щитовидной железе гормон щитовидной железы хранится в виде густой белковой смеси, также называемой коллоидом.
Суспензия представляет собой жидкую смесь, в которой более тяжелое вещество временно взвешено в жидкости, но со временем оседает. Такое отделение частиц от суспензии называется седиментацией. Пример оседания происходит в анализе крови, который устанавливает скорость оседания или скорость седации. Тест измеряет, как быстро эритроциты в пробирке оседают из водянистой части крови (известной как плазма) в течение установленного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но аспекты некоторых заболеваний могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Такое отделение частиц от суспензии называется седиментацией. Пример оседания происходит в анализе крови, который устанавливает скорость оседания или скорость седации. Тест измеряет, как быстро эритроциты в пробирке оседают из водянистой части крови (известной как плазма) в течение установленного периода времени. Быстрое осаждение клеток крови обычно не происходит в здоровом организме, но аспекты некоторых заболеваний могут вызывать слипание клеток крови, и эти тяжелые скопления клеток крови оседают на дно пробирки быстрее, чем нормальные клетки крови.
Роль воды в химических реакциях
Два типа химических реакций связаны с созданием или потреблением воды: синтез дегидратации и гидролиз.
- В синтезе дегидратации один реагент отдает атом водорода, а другой реагент отдает гидроксильную группу (ОН) при синтезе нового продукта. При образовании их ковалентной связи в качестве побочного продукта выделяется молекула воды (рис. 2.4.1). Это также иногда называют реакцией конденсации.

- При гидролизе молекула воды разрушает соединение, разрывая его связи. Вода сама расщепляется на Н и ОН. Затем одна часть разорванного соединения связывается с атомом водорода, а другая часть связывается с гидроксильной группой.
Эти реакции являются обратимыми и играют важную роль в химии органических соединений (которая будет обсуждаться в ближайшее время).
Рисунок 2.4.1 – Дегидратационный синтез и гидролиз: Мономеры, основные единицы для построения более крупных молекул, образуют полимеры (два или более химически связанных мономера). (а) При дегидратационном синтезе два мономера ковалентно связываются в результате реакции, в которой один отдает гидроксильную группу, а другой — атом водорода. Молекула воды высвобождается как побочный продукт при реакциях дегидратации. (б) При гидролизе ковалентная связь между двумя мономерами расщепляется за счет присоединения атома водорода к одному и гидроксильной группы к другому, что требует вклада одной молекулы воды.
Соли
Вспомните, что соли образуются, когда ионы образуют ионные связи. В этих реакциях один атом отдает один или несколько электронов и, таким образом, становится положительно заряженным, тогда как другой принимает один или несколько электронов и становится отрицательно заряженным. Теперь вы можете определить соль как вещество, которое при растворении в воде диссоциирует на ионы, отличные от H + или OH – . Этот факт важен для отличия солей от кислот и оснований, о чем пойдет речь далее.
Типичная соль NaCl полностью диссоциирует в воде (рис. 2.4.2). Положительные и отрицательные участки молекулы воды (концы водорода и кислорода соответственно) притягивают отрицательные ионы хлорида и положительные ионы натрия, отталкивая их друг от друга. Опять же, в то время как неполярные и полярные ковалентно связанные соединения распадаются на молекулы в растворе, соли диссоциируют на ионы. Эти ионы являются электролитами; они способны проводить электрический ток в растворе.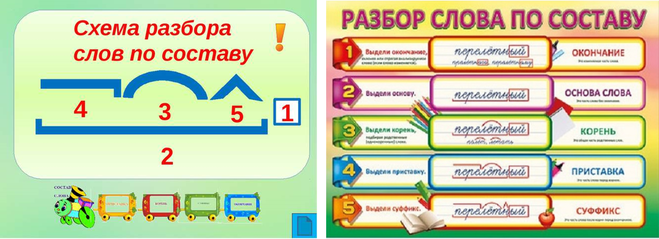 Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Это свойство имеет решающее значение для функции ионов в передаче нервных импульсов и стимулировании сокращения мышц.
Многие другие соли важны для организма. Например, соли желчных кислот, вырабатываемые печенью, помогают расщеплять пищевые жиры, а соли фосфата кальция образуют минеральную часть зубов и костей.
Кислоты и основания
Кислоты и основания, как и соли, диссоциируют в воде на электролиты. Кислоты и основания могут очень сильно изменять свойства растворов, в которых они растворены.
Кислоты
Кислота представляет собой вещество, выделяющее ионы водорода (H + ) в растворе (рис. 2. 4.3 a ). Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой долей вероятности может участвовать в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H+ в раствор; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается клетками слизистой оболочки желудка, является сильной кислотой, потому что она высвобождает весь свой H9.0224 + в водянистой среде желудка. Эта сильная кислота способствует пищеварению и убивает проглоченные микробы. Слабые кислоты полностью не ионизируются; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; его называют ацетатом после того, как он отдает протон.
4.3 a ). Поскольку атом водорода имеет только один протон и один электрон, положительно заряженный ион водорода — это просто протон. Этот уединенный протон с большой долей вероятности может участвовать в химических реакциях. Сильные кислоты — это соединения, которые выделяют весь свой H+ в раствор; то есть они полностью ионизируются. Соляная кислота (HCl), которая высвобождается клетками слизистой оболочки желудка, является сильной кислотой, потому что она высвобождает весь свой H9.0224 + в водянистой среде желудка. Эта сильная кислота способствует пищеварению и убивает проглоченные микробы. Слабые кислоты полностью не ионизируются; то есть некоторые из их ионов водорода остаются связанными внутри соединения в растворе. Примером слабой кислоты является уксус или уксусная кислота; его называют ацетатом после того, как он отдает протон.
 Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (б) В водном растворе основание диссоциирует на гидроксильные ионы (ОН – ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию ОН – .
Почти каждая молекула сильной кислоты диссоциирует, образуя высокую концентрацию H + . (б) В водном растворе основание диссоциирует на гидроксильные ионы (ОН – ) и катионы. Почти каждая молекула сильного основания диссоциирует, образуя высокую концентрацию ОН – .Основания
Основание представляет собой вещество, которое высвобождает гидроксильные ионы (ОН – ) в растворе или принимает Н+, уже присутствующий в растворе (см. рис. 2.4.3 b ). Ионы гидроксила (также известные как ионы гидроксида) или другие основные вещества соединяются с H + образуют молекулу воды, тем самым удаляя H+ и снижая кислотность раствора. Сильные основания высвобождают большую часть или все свои гидроксильные ионы; слабые основания выделяют только некоторые гидроксильные ионы или поглощают только несколько H + . Пища, смешанная с соляной кислотой из желудка, обожгла бы тонкий кишечник (следующий отдел пищеварительного тракта после желудка), если бы не выделение бикарбоната (HCO 3 – ), слабого основания, притягивающего Н + . Бикарбонат принимает часть протонов Н+, тем самым снижая кислотность раствора.
Бикарбонат принимает часть протонов Н+, тем самым снижая кислотность раствора.
Концепция pH
Относительную кислотность или щелочность раствора можно определить по его рН. pH раствора — это отрицательный логарифм по основанию 10 концентрации ионов водорода (H + ) в растворе. Например, раствор с pH 4 имеет концентрацию H + , которая в десять раз больше, чем у раствора с pH 5. То есть раствор с рН 4 в десять раз более кислый, чем раствор с рН 5. Понятие рН станет более понятным, когда вы изучите шкалу рН, как показано на рис. 2.4.4. Шкала состоит из ряда приращений от 0 до 14. Раствор с рН 7 считается нейтральным — ни кислым, ни щелочным. Чистая вода имеет рН 7. Чем меньше число ниже 7, тем более кислый раствор или тем выше концентрация Н + . Концентрация ионов водорода при каждом значении рН в 10 раз отличается от следующего значения рН. Например, значение рН 4 соответствует концентрации протонов 10 -4 М, или 0,0001 М, а значение рН 5 соответствует концентрации протонов 10 -5 М, или 0,00001 М.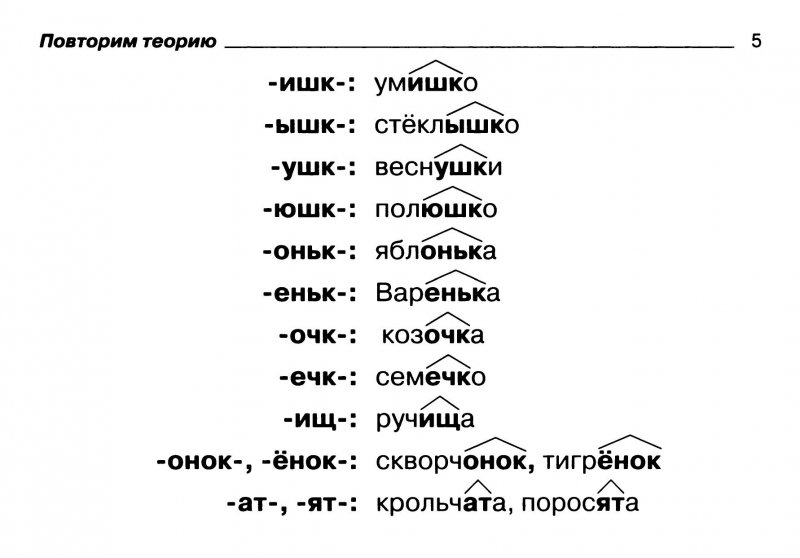 Чем выше число выше 7, тем более щелочным (щелочным) является раствор или тем ниже концентрация H + . Человеческая моча, например, в десять раз более кислая, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода.
Чем выше число выше 7, тем более щелочным (щелочным) является раствор или тем ниже концентрация H + . Человеческая моча, например, в десять раз более кислая, чем чистая вода, а HCl в 10 000 000 раз более кислая, чем вода.
Буферы
pH крови человека обычно колеблется от 7,35 до 7,45, хотя обычно определяется как pH 7,4. При этом слегка щелочном pH кровь может снизить кислотность, возникающую из-за того, что углекислый газ (CO 2 ) постоянно выделяется в кровоток триллионами клеток тела. Гомеостатические механизмы (наряду с выдыханием CO 2 при дыхании) обычно удерживают рН крови в этом узком диапазоне. Это очень важно, потому что колебания — слишком кислые или слишком щелочные — могут привести к опасным для жизни расстройствам.
Все клетки организма зависят от гомеостатической регуляции кислотно-щелочного баланса при рН примерно 7,4. Следовательно, в организме есть несколько механизмов для этой регуляции, включая дыхание, выделение химических веществ с мочой и внутреннее высвобождение химических веществ, которые в совокупности называются буферами, в жидкости организма. Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже незначительное снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыток ионов водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Буфер представляет собой раствор слабой кислоты и сопряженного с ней основания. Буфер может нейтрализовать небольшое количество кислот или оснований в жидкостях организма. Например, если есть даже незначительное снижение pH жидкости организма ниже 7,35, буфер в жидкости — в данном случае действующий как слабое основание — будет связывать избыток ионов водорода. Напротив, если pH поднимается выше 7,45, буфер будет действовать как слабая кислота и вносить ионы водорода.
Гомеостатический дисбаланс
Повышенная кислотность кислот и оснований, крови и других жидкостей организма известна как ацидоз. Распространенными причинами ацидоза являются ситуации и расстройства, которые снижают эффективность дыхания, особенно способность человека к полному выдоху, что вызывает накопление CO 2 (и H + ) в кровотоке. Ацидоз также может быть вызван метаболическими проблемами, которые снижают уровень или функцию буферов, действующих как основания, или которые способствуют выработке кислот. Например, при тяжелой диарее организм может терять слишком много бикарбоната, что приводит к накоплению кислот в жидкостях организма. У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное состояние, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Например, при тяжелой диарее организм может терять слишком много бикарбоната, что приводит к накоплению кислот в жидкостях организма. У людей с плохо управляемым диабетом (неэффективное регулирование уровня сахара в крови) кислоты, называемые кетонами, вырабатываются в качестве топлива для организма. Они могут накапливаться в крови, вызывая серьезное состояние, называемое диабетическим кетоацидозом. Почечная недостаточность, печеночная недостаточность, сердечная недостаточность, рак и другие заболевания также могут вызывать метаболический ацидоз.
Напротив, алкалоз — это состояние, при котором кровь и другие жидкости организма становятся слишком щелочными (щелочными). Как и в случае с ацидозом, респираторные расстройства являются основной причиной; однако при респираторном алкалозе уровень углекислого газа падает слишком низко. Заболевания легких, передозировка аспирина, шок и обычное беспокойство могут вызвать респираторный алкалоз, который снижает нормальную концентрацию H + .
Метаболический алкалоз часто возникает в результате длительной сильной рвоты, которая вызывает потерю ионов водорода и хлора (как компонентов HCl). Лекарства также могут вызвать алкалоз. К ним относятся мочегонные средства, которые заставляют организм терять ионы калия, а также антациды, принимаемые в чрезмерных количествах, например, при постоянной изжоге или язве.
Обзор главы Неорганические соединения, необходимые для жизнедеятельности человека, включают воду, соли, кислоты и основания. Эти соединения неорганические; то есть они не содержат ни водорода, ни углерода. Вода является смазкой и подушкой, теплоотводом, компонентом жидких смесей, побочным продуктом реакций дегидратационного синтеза, реагентом в реакциях гидролиза. Соли — это соединения, которые при растворении в воде диссоциируют на ионы, отличные от H + или OH – . Напротив, кислоты выделяют H + в раствор, делая его более кислым. Основания принимают H + , тем самым делая раствор более щелочным (едким).
Основания принимают H + , тем самым делая раствор более щелочным (едким).
pH любого раствора – это его относительная концентрация H + . Раствор с рН 7 нейтрален. Растворы с рН ниже 7 являются кислотами, а растворы с рН выше 7 — щелочами. Изменение на одну цифру шкалы pH (например, с 7 до 8) соответствует десятикратному увеличению или уменьшению концентрации H + . У здорового взрослого человека рН крови колеблется от 7,35 до 7,45. Механизмы гомеостатического контроля, которые важны для поддержания крови в здоровом диапазоне pH, включают химические вещества, называемые буферами, слабыми кислотами и слабыми основаниями, высвобождаемыми, когда pH крови или других жидкостей организма колеблется в любом направлении за пределами этого нормального диапазона.
Лицензия
Анатомия и физиология Линдси М. Бига, Сьерра Доусон, Эми Харвелл, Робин Хопкинс, Джоэл Кауфманн, Майк ЛеМастер, Филип Матерн, Кэти Моррисон-Грэм, Девон Квик и Джон Руньон лицензирована Creative Commons Attribution -ShareAlike 4.
 com
com
