Получено или полученно — как правильно пишется слово
Содержание:
Определение и разбор слова
Данное слово является формой краткого страдательного причастия к глаголу «получить», который может употребляться в одном из следующих значений:
- Принять что-либо вручаемое;
- Принять для исполнения;
- Произвести что-либо в результате работы;
- Приобрести какую-либо болезнь.
Варианты написания
В суффиксе рассматриваемого слова пишется две буквы «н» или одна? Выбор написания – «получено» или «полученно» – определяется правилом орфографии, которое мы в статье рассмотрим.
Существует два основных варианта написания слова:
- «получено», где в слове пишется одна буква «н»;
- «полученно», где в слове пишутся две буквы «н».

Как правильно пишется: «получено» или «полученно»?
С точки зрения правил русской орфографии верным является следующее написание слова:
«
ПОЛУЧЕНО»Какое правило применяется?
Сделаем разбор слова по составу:
- «получ» — корень;
- «ен» — суффикс;
- «о» — окончание.
Нас интересует правописание суффикса. По правилам русского языка в суффиксах краткого страдательного причастия пишется одна буква «н». «Получено» является краткой страдательной формой причастия «полученный». Поэтому пишем в слове одну «н».
Примеры использования слова в речи
Письмо было получено мною вчера и зачитано вслух.
Вчера было получено несколько посылок из Англии.
Все, что вы собрали и выслали мне, получено в полной сохранности.
Вами получено образование, которое непременно пригодится в построении успешной карьеры.

Как свидетельствует подпись, письмо получено.
Подводим итоги:
- Верное написание: «получено»
- Неверное написание: «полученно»
Если вы нашли ошибку, пожалуйста, выделите необходимый фрагмент текста и нажмите Ctrl+Enter.
ВКонтактеFacebookTwitterPinterest
Смотрите также:
Как правильно написать грамоте учиться всегда пригодится
Как пишется «Грамоте учиться всегда пригодиться»?
а) Грамоте учится всегда пригодиться
б) Грамоте учиться всегда пригодится
с) Грамоте учиться всегда пригодиться.
Какой правильный? Интересует последнее слово. С мягким знаком или без? И почему?
Правильным вариантом из трех предложенных в данном случае будет:
б) Грамоте учиться — всегда пригодится
Т.е.мягкий знак в «пригодится» отсутствует.
Объясняется это правилами русского языка о написании глаголов.
Для простоты использовать данное правило можно так: задать мысленно самому себе специальные вопросы к слову.
Сравнить: Эта вещь тебе ещё пригодится.
Тире обозначает паузу в речи, это связано с инверсией дополнения.
Сравнить: Учиться грамоте всегда пригодится.
Слово «барабан» относится к словарным словам и проверочного слова к нему нет.
Нам нужно просто запомнить как оно правильно пишется, чтобы при написании не допустить ошибки.
В случае надобности берем орфографический словарь и проверяем.
В руках у мальчика был барабан.
Саша хотел, чтобы мама ему купила барабан.
Прилагательные «эмАлевый» и «гуттапЕрчевый» имеют суффикс «-ев-«.
Морфемный разбор (разбор по составу) слова «эмалевый»:
Исключениями являются «мИлостивый» и «юрОдивый».
Буква «и» пишется в суффиксах «-чив-» и «-лив-«: находчивый, разборчивый, заманчивый, переменчивый, опрометчивый, заносчивый, счастливый, непоседливый, завистливый, заботливый, причудливый, отчётливый.
Чтобы подобрать проверочное слово к слову принарядилась, разберем его по составу, чтобы выяснить, в какой его части существует орфографическая проблема и какие шаги предпринять для её решения.
Глагол прошедшего времени женского рода «принарядилась» произносится с ударным суффиксом, из-за чего неясно слышатся предыдущие гласные корня и приставки:
Начнем с начала слова: приставка при- является смысловой и в данном случае, на мой взгляд, обозначает неполноту действия:
полностью нарядилась и чуть-чуть принарядилась, украсив свой наряд бантиком, брошкой и т.д.
В корне слова пишется буква а, которая является непроверяемой, как ни подбирай родственные слова:
наряд, нарядный, нарядность, нарядить, нарядиться.
Об её написании справимся в орфографическом словаре.
Слово имеет несколько значений:
Для русского языка оно является иностранным — мы позаимствовали его из французского. Было в нём словечко piquant, означающее «острый», «колючий». Первоначально оно использовалось исключительно для обозначения вкуса, а уже потом приобрело расширенное значение «вызывающий интерес, сенсационный, забавный».
Само собой разумеется, вторая буква французского оригинала «pIquant» читается по-русски именно как И. Так что интересующее Вас прилагательное пишется через И: пИкантный и никак не иначе.
Командиру не нужно было и объяснять своим солдатам, что они смогут победить, если будут драться насмерть.
Но поговорить хотелось, потому что и он, и его ребята понимали, что бой будет «не на жизнь, а на смерть«.
отвечает на вопрос «КАК, КАКИМ ОБРАЗОМ будут драться?»
Наречие образовано слиянием предлога на, перешедшего при этом в разряд приставок, с именем существительным смерть.
Между ними невозможно вставить никакое другое слово (определение), не изменив смысла сказанного.
Да и поставить падежный вопрос к существительному нельзя.
Такие наречия пишутся слитно.
Во втором предложении в использованном фразеологизме дано предложно-падежное сочетание на смерть, в котором между предлогом и существительным можно вставить определение (например, на верную смерть).
Такие предложно-падежные сочетания пишутся раздельно.
Источник
Успех остальных
Популяризатор науки Александр Толмачев полагает разочарование в высшем образовании кажущимся. «Я вижу в цифрах ВЦИОМ возрастание осознанности и даже веры в самого себя по окончании вуза. Ведь в действительности далеко не только высшее образование обеспечивает и успех в карьере, и достижение жизненных целей. Здесь скорее ключевую роль играет важнейший навык учиться тогда, когда от тебя этого уже не требуют».
Эксперт прогнозирует, что через 10 лет вклад высшего образования в карьерный успех продолжит уменьшаться. «Но в этом нет беды. Это всего лишь означает, что на наш прогресс в век информации влияет все больше прочих причин, таких как наша открытость, скорость обучения, коммуникабельность, развитие эмоционального интеллекта», — подчеркивает он.
«Но в этом нет беды. Это всего лишь означает, что на наш прогресс в век информации влияет все больше прочих причин, таких как наша открытость, скорость обучения, коммуникабельность, развитие эмоционального интеллекта», — подчеркивает он.
Даниил Добрынченко отмечает, что в вузах, которые продолжают пытаться дать высшее образование в полном смысле слова, развернуть недостающие исследовательские практики, — другая история. «Почему раньше нужно было идти в вуз и это обеспечивало будущий успех? Во вторую очередь, это действительно вопрос картины мира, качественного образования, твоей позиции в этом мире, установок, стремлений и ценностей. Но в первую очередь шли не за этим, а чтобы попасть в определенную когорту людей, с которыми дальше двигаешься по жизни», — поясняет он.
«Собственно, высшее образование есть там, где складывается социальная группа взаимной поддержки, стремящаяся к постоянному улучшению своего мастерства и профессионализма: если ты попал в вуз, где вокруг тебя сложился хороший коллектив, в котором вы съели не один пуд соли и прошли разные образовательные ситуации, то с гигантской долей вероятности успех каждого будет поддерживаться успехом остальных. Этим хороший университет отличается от не очень хорошего», — отмечает Даниил Добрынченко.
Этим хороший университет отличается от не очень хорошего», — отмечает Даниил Добрынченко.
По мнению эксперта, большинство российских вузов сильно озаботились качеством образования, проверками и т. д. и совсем перестали обращать внимание на становление этих социальных общностей, что отразилось и на востребованности образования: люди могут не понимать этого прямо, но чувствуют, в каком вузе выпускники «дружат», то есть поддерживают карьеру друг друга. Около 20% вузов осознанно занимаются этим.
Смысл пословицы «Грамоте учиться — всегда пригодится»
Знания — это сила. Быть грамотным — это значит быть стойким, сильным духовно, ответственным. Если человек стремится к знаниям, если он находится в постоянном поиске новых интересов, увлечений, он гораздо легче справляется с проблемами и невзгодами. Ему по плечу любое дело, любое сложное задание.
Перед грамотным человеком открыт весь мир, он может выбрать любой путь. У умных людей много разнообразных перспектив. Такие личности не боятся будущего, ведь они привыкли рассчитывать на себя. «Грамоте учиться» означает не только заучивание терминов и формул. Человек должен развиваться. Главное, выбрать сферу деятельности, которая будет ему интересна. Если человек окончил школу, училище, институт, это не повод позабыть об учебе и знаниях. Людям необходимо стремится к интересной насыщенной яркой жизни. Но без знаний это невозможно. Жизнь безграмотного человека больше напоминает тоскливое существование.
«Грамоте учиться» означает не только заучивание терминов и формул. Человек должен развиваться. Главное, выбрать сферу деятельности, которая будет ему интересна. Если человек окончил школу, училище, институт, это не повод позабыть об учебе и знаниях. Людям необходимо стремится к интересной насыщенной яркой жизни. Но без знаний это невозможно. Жизнь безграмотного человека больше напоминает тоскливое существование.
Значение пословицы «Грамоте учиться — всегда пригодится»
Знания нельзя разделить на нужные и ненужные. Не бывает лишних умений и навыков. Мыслительный процесс заставляет мозг работать, обдумывать возникающие ситуации. Смысл пословицы «Грамоте учиться — всегда пригодится» заключается в том, что образованному начитанному человеку гораздо комфортнее находиться в обществе, чем тем, кто не умеет читать и считать. Или тем, кто не может поддержать разговор, вступить в дискуссию только от того, что не знает, о чем говорить. Чтобы ясно выражать свои мысли, отстаивать точку зрения, важно правильно аргументировать свою позицию. Однако без полученных знаний добиться этого не получится.
Однако без полученных знаний добиться этого не получится.
Узнавать что-то новое — это не только полезное занятие, но и интересное. С образованным человеком можно поговорить на самые разнообразные темы, к нему тянутся другие люди. Начитанные умные личности гораздо чаще становятся успешными и обеспеченными, чем те, кто не воспринимал знания как что-то серьезное и нужное. Не существует границ возраста, после которых человеку больше не надо учиться. Получать знания необходимо всегда. Иначе человек не сможет принимать обдуманных взвешенных решений, он утратит способность быстро реагировать на изменяющиеся условия.
Пример пословицы
Пословицу «Грамоте учиться — всегда пригодится» уместно произнести в ситуации, в которой оказался необразованный человек, не поступивший в университет. Некоторые люди не задумываются о своем будущем. Они считаю, что от жизни нужно получать удовольствие, а учеба подождет. Но это ошибочная точка зрения. Даже если для тебя не нашлось студенческого билета, это не конец света. Выход есть всегда. Главное, взять себя в руки и идти навстречу новым знаниям.
Выход есть всегда. Главное, взять себя в руки и идти навстречу новым знаниям.
Не лишним будет произнести пословицу «Грамоте учиться — всегда пригодится» другу, который никак не может определиться, стоит ли ему изучать углубленно отдельные предметы или еще один иностранный язык.
Происхождение пословицы
Пословица «Грамоте учиться — всегда пригодится» — это своеобразный «авторитетный» текст, который пришел из народа. В словах сосредоточено мировоззрение общества, их ценности и жизненные ориентиры. Пословица «Грамоте учиться — всегда пригодится» — устоявшийся элемент русской устной речи.
В этом предложении содержится педагогическая идея, целью которой является повысить заинтересованность в знаниях среди школьников. Пословица не только оказывает воспитательное влияние, она формирует соответствующее представление об истинных ценностях. Немаловажным фактором является и побуждение к самоорганизованности и самовоспитанию.
Во фразе «Грамоте учиться — всегда пригодится» уже есть готовый вывод. Однако пословица заставляет задуматься о правильности своих действий, о своих будущих возможностях и перспективах.
Однако пословица заставляет задуматься о правильности своих действий, о своих будущих возможностях и перспективах.
Источник
Учиться-всегда пригодится. методическая разработка на тему
«Учиться — всегда пригодится».
Воспитательное занятие.
Человек должен учиться, потому, что он человек.
В.А.Сухомлинский.
Цель: развитие у воспитанников осознанного отношения к учебе, воспитание уважения к себе, уверенности, что знания всегда пригодятся в жизни, способствовать развитию мышления и творческой активности учащихся.
Воспитанники сидят полукругом, им хорошо видно друг друга.
— Здравствуйте, ребята! Как вы думаете, что станет предметом нашего разговора сегодня? Мы с вами разберём и объясним пословицы и определим тему нашего сегодняшнего разговора. пословицы:
- Ученье и труд рядом живут.
- Знание и мудрость украшают человека.
- Ученье свет, не ученье – тьма.
- Не стыдно не знать – стыдно не учиться.
- Ученья корень горек, да плод сладок.

- Ученье лучше богатства.
- Рукой победишь одного, головой – тысячи.
— Да, вы правы, мы будем говорить об учебе, а чтобы беседа состоялась, нам нужно сформулировать тему нашего разговора . Кто готов ответить?
Один из ребят говорит: “Учиться – всегда пригодится”.
— Хорошо. Итак, тема нашего разговора: “Учиться – всегда пригодится”.
Ребята, а теперь мне бы хотелось послушать вас, выскажите свое мнение, ответьте мне на один вопрос: “Для чего человек учится?”
Дети говорят искренне, ответы разные (чтобы быть грамотным, чтобы быть богатым, мама заставляет, чтобы получить престижную профессию, чтобы радовать родителей и др.).
— Молодцы, ребята, главное, что вы не лукавите и не хитрите, а сейчас я попрошу вас ответить на несколько вопросов анкеты.
ВОПРОСЫ АНКЕТЫ
- Всегда ли ты с желанием ходишь в школу?
- Легко ли тебе учиться ?
- Какие учебные предметы даются тебе легко?
- Какие учебные предметы даются тебе с трудом?
- Домашние задания выполняешь самостоятельно или прибегаешь к помощи?
- Кем ты видишь себя в будущем?
- Что нужно тебе для того, чтобы в будущем стать тем, кем хочешь?
- Твоя заветная мечта.

- Пожелай себе сам.
— Итак, вы ответили на все вопросы анкеты, большое вам спасибо. А теперь я хочу тоже ответить на вопрос: “Для чего человек учится?” Послушайте меня внимательно.
Человек учится прежде всего потому, что его мучит любознательность, инстинктивная тяга к знанию. Это – внутренние побудительные причины. От природы они есть у всех, но в иных людях они развиваются, в других – заглушаются обстоятельствами. Человек может учиться и потому, что его принуждает к учению житейское здравомыслие: не выучившись, он не сможет занять в жизни то положение, которое хотел бы занять.
Все это создает внешние побудительные причины. Они также сильны, как и внутренние. Когда внешние побуждения развивают природную любознательность, эти два двигателя творят чудеса, делают человека невероятно способным.
Чтобы подтвердить эту мысль, вспомним историю Петра Великого. Ни в ком практическая потребность в знаниях и природная любознательность не проявились с такой бурной силой, как в Петре.
Петр на верфях работает плотником, сидит, согнувшись в тесной каморке над залом английского парламента – слушает речи ораторов; спускается в шахты… Он учится каждый день своей жизни, но учится для того, чтобы приобретенные знания тут же претворить в указ, распоряжение, в дело. Он не стеснялся мелочей, так как он не стеснялся учиться, не стыдился учиться. Учиться – значит покорить в себе гордыню, признаться в невежестве. Этот необузданный, своенравный человек, царь, император, владелец огромных территорий и хозяин миллионов людей, не останавливался ни перед чем и никого не боявшийся, этот человек лишь в одном не знал гордости – в учении, лишь перед одним послушно склонял голову – перед знанием.
— Да ребята, о плодах Петра I можно говорить долго, но время нашей встречи подходит к концу. Я думаю, что каждому из нас есть над чем задуматься и тем, кто не совсем добросовестно относится к учебе, призадуматься над своим будущим.
В завершение нашего разговора, я раздам вам карточки с удивительными рожицами (рисунок 1). Ваша задача: определить, какая из них отражает ваше отношение к учебе.
Ваша задача: определить, какая из них отражает ваше отношение к учебе.
Рисунок 1
Эти карточки я сохраню до 11 класса, мы будем на них отмечать, как изменяется ваше отношение к учению с каждым годом.
— Вот и подошла к концу наша беседа о пользе учения, знаний. Мы обсудили многие вопросы, теперь дело за вами. Удачи.
Литература:
- Платонов К.К. Занимательная психология. М.: Молодая гвардия, 1962
- Пятьдесят сценариев классных часов. М., 2000
- Соловейчик С. Час ученичества. М.: Детская литература, 1986
Транскрипт
1 Конспект внеклассного занятия для учащихся старших классов Форма занятия: КВН Цели занятия: «Грамоте учиться всегда пригодится» Обучающая: обучать формам и приёмам сценической деятельности. Развивающая: выявление и развитие интеллектуальных способностей учащихся. Воспитательная: совершенствовать навыки коллективной работы, воспитать дружбу и взаимовыручку. Коррекционная: развивать связную речь, логическое мышление. Оборудование: ноутбук, интерактивная доска. Материал: карточки, ручки и тетради. Ход занятия: I. Организационный момент. Воспитатель: Здравствуйте, ребята и уважаемые гости! Сегодня у нас необычное занятие КВН (Клуб внимательных и находчивых).. Воспитатель: Сегодня тема КВНа: «Грамоте учиться всегда пригодится» «Величайшее богатство народа его язык! Тысячелетиями накапливаются и вечно живут в слове несметные сокровища человеческой мысли и опыта». Михаил Шолохов Воспитатель: Сегодня, мы будем находиться в царстве великого, могучего властелина русского языка. Вы сможете рассказать о русском языке всё, что узнали за годы обучения в школе, проявить эрудицию и смекалку. — Итак, начинаем КВН. — В игре принимают участие три команды. Представление команд. Каждый капитан представляет свою команду, а соперники угадывают её название 1 команда: Есть одно такое имя, Без него никак нельзя. Это главная часть речи, Обозначает всё на свете, Назовёт любой предмет. И на всё нам даст ответ. 1 команда (Существительное)
Оборудование: ноутбук, интерактивная доска. Материал: карточки, ручки и тетради. Ход занятия: I. Организационный момент. Воспитатель: Здравствуйте, ребята и уважаемые гости! Сегодня у нас необычное занятие КВН (Клуб внимательных и находчивых).. Воспитатель: Сегодня тема КВНа: «Грамоте учиться всегда пригодится» «Величайшее богатство народа его язык! Тысячелетиями накапливаются и вечно живут в слове несметные сокровища человеческой мысли и опыта». Михаил Шолохов Воспитатель: Сегодня, мы будем находиться в царстве великого, могучего властелина русского языка. Вы сможете рассказать о русском языке всё, что узнали за годы обучения в школе, проявить эрудицию и смекалку. — Итак, начинаем КВН. — В игре принимают участие три команды. Представление команд. Каждый капитан представляет свою команду, а соперники угадывают её название 1 команда: Есть одно такое имя, Без него никак нельзя. Это главная часть речи, Обозначает всё на свете, Назовёт любой предмет. И на всё нам даст ответ. 1 команда (Существительное)
2 2 команда: Вместо имени предмета Говорим мы слово: ЭТО, ТО, ОНИ, ОНО, ОНА Всем известные слова. Это, без сомнения, 2 команда (Местоимение) 3 команда: Что без меня предметы? Лишь названия. А я приду всё в действие придет. Летит ракета, Люди строят здания, Цветут сады, И хлеб в полях растет. 3 команда (Глаголы) Командам даются карточки с названием. Воспитатель: Победителей определит жюри (Представление членов жюри) Воспитатель: Напоминаю правила игры. 1. На обсуждение вопроса даётся время. 2. До истечения этого времени команда должна найти ответ, а капитан — поднять руку. 3. Капитан решает вопрос о том, кто будет отвечать. 4. Команда может заработать ещё балл, выполняя дополнительное задание. — Желаю командам удачи. II. Конкурсная программа. Воспитатель: Как всегда КВН начинается с разминки. 1. Разминка команд Задача: продемонстрировать знание правил русского языка 1. Слова, противоположные по смыслу. (Антонимы) 2. Сколько букв в русском алфавите? (33) 3. Часть слова, стоящая перед корнем? ( Приставка) 4. Главный член предложения, который отвечает на вопросы «Что делает?», «Что сделает?» (Сказуемое) 5.
Это, без сомнения, 2 команда (Местоимение) 3 команда: Что без меня предметы? Лишь названия. А я приду всё в действие придет. Летит ракета, Люди строят здания, Цветут сады, И хлеб в полях растет. 3 команда (Глаголы) Командам даются карточки с названием. Воспитатель: Победителей определит жюри (Представление членов жюри) Воспитатель: Напоминаю правила игры. 1. На обсуждение вопроса даётся время. 2. До истечения этого времени команда должна найти ответ, а капитан — поднять руку. 3. Капитан решает вопрос о том, кто будет отвечать. 4. Команда может заработать ещё балл, выполняя дополнительное задание. — Желаю командам удачи. II. Конкурсная программа. Воспитатель: Как всегда КВН начинается с разминки. 1. Разминка команд Задача: продемонстрировать знание правил русского языка 1. Слова, противоположные по смыслу. (Антонимы) 2. Сколько букв в русском алфавите? (33) 3. Часть слова, стоящая перед корнем? ( Приставка) 4. Главный член предложения, который отвечает на вопросы «Что делает?», «Что сделает?» (Сказуемое) 5. Как пишутся предлоги с другими словами? (Раздельно) 6. Слова, близкие по смыслу. (Синонимы) 7. Часть слова, которая изменяет его форму? (Окончание) 8. Изменяется ли существительное по родам (Нет).
Как пишутся предлоги с другими словами? (Раздельно) 6. Слова, близкие по смыслу. (Синонимы) 7. Часть слова, которая изменяет его форму? (Окончание) 8. Изменяется ли существительное по родам (Нет).
6 А целое мы все решали И у доски, и за столом. (За дача) 3 капитан. Мое начало буква алфавита, Она всегда шипит сердито. Второго корабли боятся И обойти его стремятся. А целое весной летает и жужжит, То сядет на цветок, то снова полетит. (Ш мель) 1. Какие два местоимения мешают дорогам? я мы 2. Какие местоимения всегда чистые? вы мы ты 3. К какому местоимению нужно прибавить слог ло, чтобы получить неодушевлённый предмет? мы ло 4. Первый слог — личное местоимение 2-го лица. Второй — звук, который издает лягушка. Вместе — название овоща.? ты ква 5. В каком местоимении два звука, одна буква? Я 6. Первый слог слова — личное местоимение 1-го лица, второй и третий — синоним к слову «горе». Вместе обозначают человека, который любит жаловаться.? я беда Максимальная оценка 3б. 8. Грамотеи Воспитатель: Русский язык более всех новых, может быть, способен приблизиться к языкам классическим по своему богатству, силе, свободе расположения, обилию форм. Но чтобы воспользоваться всеми сокровищами, нужно хорошо знать его, нужно уметь владеть им. Н.А.Добролюбов Работа над текстом. 1) Вставить правильно буквы. 2) Собрать предложения в текст и озаглавить. 3) Выделенное предложение разобрать по членам предложения и частям речи. 4) Найти в тексте сложное предложение. 5) Определить тип текста. 6) В 6 предложении указать падеж имён существительных. Росла в саду яблоня. Осенью упало с неё яблоко. Птицы склевали это яблоко, и только зёрнышко спряталось в землю. Весной из зёрнышка выросло маленькое деревце. А через пять лет выросли на новой яблоньке румяные яблоки. Расти, яблонька, на радость людям!
Но чтобы воспользоваться всеми сокровищами, нужно хорошо знать его, нужно уметь владеть им. Н.А.Добролюбов Работа над текстом. 1) Вставить правильно буквы. 2) Собрать предложения в текст и озаглавить. 3) Выделенное предложение разобрать по членам предложения и частям речи. 4) Найти в тексте сложное предложение. 5) Определить тип текста. 6) В 6 предложении указать падеж имён существительных. Росла в саду яблоня. Осенью упало с неё яблоко. Птицы склевали это яблоко, и только зёрнышко спряталось в землю. Весной из зёрнышка выросло маленькое деревце. А через пять лет выросли на новой яблоньке румяные яблоки. Расти, яблонька, на радость людям!
Источник
2.10: Процентный состав — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 158412
цели обучения
- Рассчитать массовый процентный состав отдельных атомов в соединении
- Использование состава в процентах по массе в качестве коэффициента пересчета для определения массы компонента в смеси и наоборот
- Использование состава в процентах по массе в качестве коэффициента пересчета для определения массы чистого элемента в соединении и наоборот
Процентный состав по массе
Процентный состав очень прост. Процентный состав говорит вам по массе, какой процент каждого элемента присутствует в соединении. Химическое соединение — это комбинация двух или более элементов. Если вы изучаете химическое соединение, вы можете захотеть найти процентное содержание определенного элемента в этом химическом соединении. Уравнение для процентного состава (масса элемента/молекулярная масса) x 100. Если вы хотите узнать процентный состав элементов в соединении, выполните следующие шаги:
Процентный состав говорит вам по массе, какой процент каждого элемента присутствует в соединении. Химическое соединение — это комбинация двух или более элементов. Если вы изучаете химическое соединение, вы можете захотеть найти процентное содержание определенного элемента в этом химическом соединении. Уравнение для процентного состава (масса элемента/молекулярная масса) x 100. Если вы хотите узнать процентный состав элементов в соединении, выполните следующие шаги:
Шаги для решения:
- Найдите молярную массу все элементы в соединении в граммах на моль.
- Найдите молекулярную массу всего соединения.
- Разделите молярную массу компонента на полную молекулярную массу.
- Теперь у вас будет число от 0 до 1. Умножьте его на 100, чтобы получить состав в процентах!
Советы по решению:
- Соединения всегда дают в сумме 100%, поэтому в бинарном соединении вы можете найти % первого элемента, затем выполнить 100%-(% первого элемента), чтобы получить (% второго элемент)
- Если вы используете калькулятор, вы можете сохранить общую молярную массу в переменной, такой как «A».
 Это ускорит расчеты и уменьшит опечатки.
Это ускорит расчеты и уменьшит опечатки.
Эти шаги показаны на рисунке ниже.
Другой пример: если вы хотите узнать процентный состав соляной кислоты (HCl), сначала найдите молярную массу водорода. Н = 1,00794 г. Теперь найдем молекулярную массу HCl: 1,00794 г + 35,4527 г = 36,46064 г. Выполните шаги 3 и 4: (1,00794 г/36,46064 г) x 100 = 2,76% Теперь просто вычтите, чтобы найти процент по массе хлора в соединении: 100%-2,76% = 97,24% Следовательно, HCl составляет 2,76% водорода и 97,24%. % хлора по массе.
Процентный состав в повседневной жизни
Процентный состав играет важную роль в повседневной жизни. Это больше, чем просто количество хлора в вашем бассейне, потому что это касается всего: от денег в вашем кармане до вашего здоровья и образа жизни. Следующие два раздела описывают процентный состав применительно к вам.
Этикетки с пищевой ценностью
Этикетка с пищевой ценностью, которую можно найти на упаковке каждого кусочка обработанных пищевых продуктов, продаваемых в местном продуктовом магазине, использует идею процентного состава. На всех этикетках пищевых продуктов известный размер порции разбит на пять категорий: общий жир, холестерин, натрий, общее количество углеводов и белок. Эти категории разбиты на дополнительные подкатегории, включая насыщенные жиры и пищевые волокна. Масса для каждой категории, кроме белка, затем преобразуется в процент от дневной нормы. Только две подкатегории, насыщенные жиры и пищевые волокна, преобразуются в проценты от дневной нормы. Дневная норма основана на массе каждой категории, рекомендуемой в день на человека при диете в 2000 калорий. Масса белка не конвертируется в проценты, потому что это не рекомендуемая дневная норма белка. Ниже приведена фотография, иллюстрирующая эти идеи.
На всех этикетках пищевых продуктов известный размер порции разбит на пять категорий: общий жир, холестерин, натрий, общее количество углеводов и белок. Эти категории разбиты на дополнительные подкатегории, включая насыщенные жиры и пищевые волокна. Масса для каждой категории, кроме белка, затем преобразуется в процент от дневной нормы. Только две подкатегории, насыщенные жиры и пищевые волокна, преобразуются в проценты от дневной нормы. Дневная норма основана на массе каждой категории, рекомендуемой в день на человека при диете в 2000 калорий. Масса белка не конвертируется в проценты, потому что это не рекомендуемая дневная норма белка. Ниже приведена фотография, иллюстрирующая эти идеи.
Например, если вы хотите узнать процент по массе дневной нормы натрия, которую вы едите, когда съедаете одну порцию продукта с этой этикеткой пищевой ценности, перейдите в категорию с пометкой «Натрий». Посмотрите на ту же строку и прочитайте написанный процент. Если вы съедите одну порцию этой пищи, то вы употребите около 9% рекомендуемой дневной нормы натрия. Чтобы найти массовый процент жира во всей пище, вы можете разделить 3,5 грамма на 15 граммов и увидеть, что эта закуска содержит 23,33% жира.
Чтобы найти массовый процент жира во всей пище, вы можете разделить 3,5 грамма на 15 граммов и увидеть, что эта закуска содержит 23,33% жира.
Пенни: Счастливая медная монета
Пенни следует называть «счастливая медная покрытая монета «. Пенни не делали из твердой меди с 1857 года. После 1857 года правительство США начало добавлять в смесь другие более дешевые металлы. Пенни, будучи всего лишь одним центом, буквально не стоит своего веса в меди. Люди могли плавить медные пенни и продавать медь дороже, чем стоили эти пенни. После 1857 года никель смешивали с более дорогой медью. После 1864 года пенни стали делать из бронзы. Бронза 95% меди и 5% цинка и олова. В течение одного 1943 года в пенни не было меди из-за расходов на Вторую мировую войну. Это была просто оцинкованная сталь. С 1943 по 1982 год у пенни были периоды, когда он был латунным или бронзовым.
Сегодня пенни в Америке состоит из 2,5% меди и 97,5% цинка. Медь покрывает внешнюю часть пенни, а внутренняя часть покрыта цинком. Для сравнения, пенни в Канаде состоит из 94% стали, 1,5% никеля и 4,5% меди.
Для сравнения, пенни в Канаде состоит из 94% стали, 1,5% никеля и 4,5% меди.
Процентный состав монетки может реально повлиять на здоровье, особенно на здоровье маленьких детей и домашних животных. Поскольку новые пенни сделаны в основном из цинка, а не из меди, они представляют опасность для здоровья ребенка при проглатывании. Цинк очень чувствителен к кислоте. Если тонкое медное покрытие поцарапать и соляная кислота, присутствующая в желудке, вступит в контакт с цинковым сердечником, это может вызвать язву, анемию, повреждение почек и печени, а в тяжелых случаях даже смерть. Три важных фактора при проглатывании пенни — это время, pH желудка и количество проглоченных пенни. Конечно, чем больше копеек проглочено, тем больше опасность передозировки цинка. Чем кислее среда, тем больше цинка высвобождается за меньшее время. Затем этот цинк поглощается и отправляется в печень, где начинает наносить ущерб. В такой ситуации время имеет решающее значение. Чем быстрее удаляется копейка, тем меньше цинка усваивается. Если пенни или пенни не удалить, может произойти отказ органов и смерть.
Если пенни или пенни не удалить, может произойти отказ органов и смерть.
Ниже приведено изображение поцарапанной монеты до и после того, как она была погружена в лимонный сок. Лимонный сок имеет аналогичный pH 1,5-2,5 по сравнению с нормальным человеческим желудком после употребления пищи. Прошедшее время: 36 часов.
Как видите, лимонный сок почти не повреждает медь. Вот почему пенни, изготовленные до 1982 года, в основном из меди (кроме пенни 1943 года), относительно безопасно глотать. Скорее всего, они пройдут через пищеварительную систему естественным путем, прежде чем можно будет нанести какой-либо ущерб. Тем не менее, ясно, что цинк частично растворился, хотя он находился в лимонном соке лишь ограниченное время. Поэтому процентный состав поста 1982 пенни опасны для вашего здоровья и здоровья ваших домашних животных при попадании внутрь. Чтобы узнать больше о кислотах и основаниях, проверьте здесь: wiki.
видео репетитор: Процентный состав уксусной кислоты
youtube.com/embed/vtfAKlNsjIg?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>Видеоректор: процент состава ацетилена и бензола
Примечание: Актийл и бензон, что делает та же процент, что и в других процентах, так же, как и другие, так же, как и другие, так же, как и другие, так же, как и другие, так же, как и в другом, а другой, как и в другом, что иначе. не означает, что это одно и то же вещество.
Пример \(\PageIndex{1}\)
Масса одного пенни составляет 2,5 грамма. Сколько пенни может сделать правительство США из 20,0 кг меди, если массовый процент меди в современном пенни составляет 2,5%?
Дано: Мы знаем, что начинаем с 20,0 кг чистой меди. Нам известен массовый процентный состав чистой меди в копеечной смеси. Мы также знаем массу каждого пенни.
Стратегия: Нам нужно вычислить массу медной смеси, которую мы можем сделать из 20,0 кг чистой меди, используя массовый процентный состав меди в пенни смеси. Отсюда мы можем определить, сколько отдельных пенни мы можем сделать из этой смеси.
Отсюда мы можем определить, сколько отдельных пенни мы можем сделать из этой смеси.
Раствор
Пример \(\PageIndex{2}\)
Какова масса углерода, содержащегося в 3,0 г бутана (C 4 H 190901 4)?
Дано: масса всего (бутана), какова масса части (углерода)?
Стратегия: используйте формулы состава в процентах по массе для преобразования массы бутана в массу углерода:
Раствор
Практика: задачи на процентную композицию
Эти задачи имеют ту же сложность, что и задачи на плотность.
- Рассчитайте массовые проценты каждого элемента во фториде цезия (CsF).
- Рассчитайте массовые проценты каждого элемента, присутствующего в четыреххлористом углероде (CCl 4 )
- Раствор соли и воды содержит 33,0% соли по массе и имеет плотность 1,50 г/мл. Какая масса соли в граммах содержится в 5,00 л этого раствора?
- Раствор воды и HCl содержит 25% HCl по массе.
 Плотность раствора 1,05 г/мл. Если вам нужно 1,7 г HCl для реакции, какой объем этого раствора вы будете использовать?
Плотность раствора 1,05 г/мл. Если вам нужно 1,7 г HCl для реакции, какой объем этого раствора вы будете использовать? - Раствор, содержащий 42 % NaOH по массе, имеет плотность 1,30 г/мл. Какая масса в килограммах NaOH содержится в 6,00 л этого раствора?
ПРОБЛЕМА С ДОПОЛНИТЕЛЬНЫМ ГАЗОМ ПРИКРЕПЛЕНА НИЖЕ
Процентный состав Проблема Решения
1) CsF состоит из 87,5% Cs и 12,5% F по массе
2) CCL 4 — 92,2% CL и 7,8% C по массой
3) 2480G
4) 6,5 мл
5) 2,38 кг
Ссылки
- Aut Aut, ARQUMED. Произведения Архимеда. Courier Dover Publications, 2002.
- Чанде, Д. и Т. Фишер (2003). «Есть пенни? Нужен пенни? Исключение одноцентовой монеты из обращения». Canadian Public Policy/Analyse de Politiques 29 (4): 511-517.
Джефферсон, Т. (1999). «Мысль за ваши гроши». JAMA 281 (2): 122.
- Петруччи, Ральф, Уильям Харвуд и Джеффри Херринг.
 Принципы и современное применение. девятый. Нью-Джерси: Peason Eduation, 2007. .
Принципы и современное применение. девятый. Нью-Джерси: Peason Eduation, 2007. . Rauch, F., H. Plotkin, et al. (2003). «Костная масса, размер и плотность у детей и подростков с несовершенным остеогенезом: эффект внутривенной терапии памидронатом». Журнал исследований костей и минералов 18 : 610-614.
Richardson, J., S. Gwaltney-Brant, et al. (2002). «Цинковый токсикоз от проглатывания пенни у собак». Vet Med 97 (2): 96-99.
Тейт, Дж. «Открытия Архимеда: пристальный взгляд».
Внешние ссылки
- http://en.wikipedia.org/wiki/Density
- http://www.sparknotes.com/testprep/b…section2.rhtml
- http://www.science.co.il/PTelements.asp
Авторы
- Содержание заимствовано из: 2.13: Процент композиции
- Боб Белфорд (UA of Little Rock)
- Изменено Ронией Каттум (UA из Литл-Рока)
2. 10: Percent Composition распространяется по незаявленной лицензии и была создана, изменена и/или курирована LibreTexts.
10: Percent Composition распространяется по незаявленной лицензии и была создана, изменена и/или курирована LibreTexts.
- Наверх
-
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- да на странице
- Теги
3.8: Состав соединений — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- 37958
Цели обучения
- Чтобы понять определение и разницу между эмпирическими формулами и химическими формулами
- Чтобы понять, как анализ горения можно использовать для определения химических формул
Химические формулы сообщают вам, сколько атомов каждого элемента содержится в соединении, а эмпирические формулы сообщают вам самое простое или наиболее сокращенное соотношение элементов в соединении. Если химическую формулу соединения уже нельзя сократить, то эмпирическая формула совпадает с химической формулой. Анализ горения может определить эмпирическую формулу соединения, но не может определить химическую формулу (хотя другие методы могут это сделать). Когда химическая формула известна, ее можно рассчитать по эмпирической формуле.
Если химическую формулу соединения уже нельзя сократить, то эмпирическая формула совпадает с химической формулой. Анализ горения может определить эмпирическую формулу соединения, но не может определить химическую формулу (хотя другие методы могут это сделать). Когда химическая формула известна, ее можно рассчитать по эмпирической формуле.
Эмпирические формулы
Эмпирическая формула говорит нам относительное соотношение различных атомов в соединении. Соотношения остаются верными и на уровне молей . Таким образом, H 2 O состоит из двух атомов водорода и 1 атома кислорода. Аналогично, 1,0 моль H 2 O состоит из 2,0 моль водорода и 1,0 моль кислорода . Мы также можем работать в обратном направлении от молярных отношений с , если мы знаем молярные количества каждого элемента в соединении, мы можем определить эмпирическую формулу .
Пример \(\PageIndex{1}\): Хлорид ртути
Ртуть образует соединение с хлором, состоящее из 73,9% ртути и 26,1% хлора по массе. Что такое эмпирическая формула?
Что такое эмпирическая формула?
Раствор
Допустим, у нас есть 100-граммовый образец этого соединения. Таким образом, образец будет содержать 73,9 грамма ртути и 26,1 грамма хлора. Сколько молей каждого атома представляют отдельные массы?
Для Меркурия:
\[(73,9 \;g) \times \left(\dfrac{1\; mol}{200,59\; г}\справа) = 0,368 \;моль \номер \]
Для хлора:
\[(26,1\; г) \раз \влево(\dfrac{1\; моль}{35,45\; г}\справа ) = 0,736\; моль \номер \]
Каково молярное соотношение между двумя элементами?
\[\dfrac{0,736 \;моль \;Cl}{0,368\; моль\; Hg} = 2,0 \nonumber \]
Таким образом, у нас вдвое больше молей (т.е. атомов) \(\ce{Cl}\), чем \(\ce{Hg}\). Таким образом, эмпирическая формула будет выглядеть так (не забудьте указать катионы первыми, анионы последними):
\[\ce{HgCl2} \nonumber \]
Химическая формула из эмпирической формулы
Химическая формула соединения, полученная анализом состава, всегда является эмпирической формулой. Мы можем получить химическую формулу из эмпирической формулы, если знаем молекулярную массу соединения. Химическая формула всегда будет некоторым целым числом, кратным эмпирической формулы (т. е. целым числом, кратным индексам эмпирической формулы). Общий процесс для этого подхода показан на рисунке \(\PageIndex{1}\) и продемонстрирован в примере \(\PageIndex{2}\).
Мы можем получить химическую формулу из эмпирической формулы, если знаем молекулярную массу соединения. Химическая формула всегда будет некоторым целым числом, кратным эмпирической формулы (т. е. целым числом, кратным индексам эмпирической формулы). Общий процесс для этого подхода показан на рисунке \(\PageIndex{1}\) и продемонстрирован в примере \(\PageIndex{2}\).
Пример \(\PageIndex{2}\): аскорбиновая кислота
Витамин C (аскорбиновая кислота) содержит 40,92 % C, 4,58 % H и 54,50 % O по массе. Экспериментально определенная молекулярная масса составляет 176 а.е.м. Какова эмпирическая и химическая формула аскорбиновой кислоты?
Раствор
Возьмем произвольное количество 100 граммов аскорбиновой кислоты, так что мы получим:
- 40,92 грамма C
- 4,58 г H
- 54,50 г O
Это даст нам, сколько молей каждого элемента?
- Углерод
\[ (40.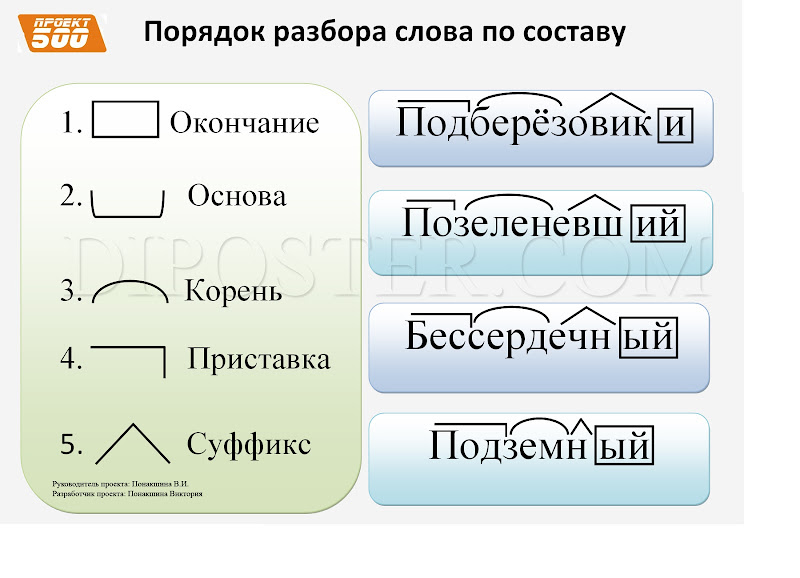 92\; \cancel{g\; C}) \times \left( \dfrac{1\; mol\; C}{12.011\; \cancel{g\; C}} \right) = 3,407\; моль \; C \номер\]
92\; \cancel{g\; C}) \times \left( \dfrac{1\; mol\; C}{12.011\; \cancel{g\; C}} \right) = 3,407\; моль \; C \номер\]
- Водород
\[ (4,58\; \cancel{g\; H}) \times \left( \dfrac{1\; моль\; H}{1,008\; \cancel{g\; H}} \right) = 4,544 \; моль \;H \номер \]
- Кислород
\[ (54.50\; \cancel{g\; O}) \times \left( \dfrac{1\; mol\; O}{15.999\; \cancel{g\; O}} \right) = 3,406\; моль \; O \номер\]
Определите простейшее соотношение целых чисел, разделив его на наименьшее молярное количество (в данном случае 3,406 моль — см. кислород):
- Углерод
\[ C= \dfrac{3.407\; моль}{3,406\; моль} \приблизительно 1,0 \номер\]
- Водород
\[ C= \dfrac{4.5.44\; моль}{3,406\; моль} = 1,0 \номер \]
- Кислород
\[ C= \dfrac{3.406\; моль}{3,406\; mol} = 1.0 \nonnumber \]
Относительные молярные количества углерода и кислорода равны, но относительное молярное количество водорода больше. Поскольку у нас не может быть «дробных» атомов в соединении, нам нужно нормализовать относительное количество водорода, чтобы оно было равно целому числу. 1,333 будет выглядеть как 1 и 1/3, поэтому, если мы умножим относительное количество каждого атома на «3», мы сможем получить целые значения для каждого атома.
Поскольку у нас не может быть «дробных» атомов в соединении, нам нужно нормализовать относительное количество водорода, чтобы оно было равно целому числу. 1,333 будет выглядеть как 1 и 1/3, поэтому, если мы умножим относительное количество каждого атома на «3», мы сможем получить целые значения для каждого атома.
C = (1.0)*3 = 3
H = (1.333)*3 = 4
O = (1.0)*3 = 3
или
\[\ce{C3h5O3} \nonumber \]
Это наша эмпирическая формула для аскорбиновой кислоты.
А химическая формула? Нам говорят, что экспериментально определенная молекулярная масса равна 176 а.е.м. . Какова молекулярная масса нашей эмпирической формулы?
(3*12,011) + (4*1,008) + (3*15,999) = 88,062 а.е.м.
Молекулярная масса из нашей эмпирической формулы значительно ниже значения, определенного экспериментально. Каково соотношение между двумя значениями?
(176 а. е.м. /88,062 а.е.м. ) = 2,0
е.м. /88,062 а.е.м. ) = 2,0
Таким образом, наша эмпирическая формула, по существу, составляет половину массы фактической молекулярной массы. Если бы мы умножили нашу эмпирическую формулу на «2», то молекулярная масса была бы правильной. Таким образом, фактическая химическая формула:
2* C 3 H 4 O 3 = C 6 H 8 O 6
Emprical Formuls: Emprical. Анализ горения
Когда соединение, содержащее углерод и водород, подвергается сжиганию с кислородом в специальном аппарате для сжигания, весь углерод превращается в CO 2 , а водород в H 2 O (рис. \(\PageIndex{2} \)). Количество образовавшегося углерода можно определить, измерив количество CO 2 Произведено. Он улавливается гидроксидом натрия, и, таким образом, мы можем отслеживать массу CO 2 , образующегося путем определения увеличения массы ловушки CO 2 . Точно так же мы можем определить количество H, произведенного по количеству H 2 O, захваченного перхлоратом магния.
Точно так же мы можем определить количество H, произведенного по количеству H 2 O, захваченного перхлоратом магния.
Одним из наиболее распространенных способов определения элементного состава неизвестного углеводорода является аналитическая процедура, называемая анализом сжигания. Небольшой тщательно взвешенный образец неизвестного соединения, который может содержать углерод, водород, азот и/или серу, сжигают в атмосфере кислорода. Другие элементы, например металлы, можно определить другими методами. количества образующихся газообразных продуктов (CO 2 , H 2 O, N 2 и SO 2 соответственно) определяют одним из нескольких возможных способов. Одна процедура, используемая при анализе горения, схематично показана на рисунке \(\PageIndex{3}\), а типичный анализ горения показан в примерах \(\PageIndex{3}\) и \(\PageIndex{4}\).
Одна процедура, используемая при анализе горения, схематично показана на рисунке \(\PageIndex{3}\), а типичный анализ горения показан в примерах \(\PageIndex{3}\) и \(\PageIndex{4}\).
Пример \(\PageIndex{3}\): сжигание изопропилового спирта
Какова эмпирическая формула для изопропилового спирта (содержащего только C, H и O), если сжигание 0,255 г образца изопропилового спирта дает 0,561 г CO 2 и 0,306 г H 2 O?
Раствор
На основании этой информации определите количество C и H в образце.
\[ (0,561\; \отменить{г\; CO_2}) \влево( \dfrac{1 \;моль\; CO_2}{44,0\; \отменить{г\;CO_2}}\вправо)=0,0128\ ; моль \; CO_2 \nonumber \]
Поскольку один моль CO 2 состоит из одного моля C и двух молей O, если в нашем образце содержится 0,0128 моля CO 2 , то мы знаем, что у нас 0,0128 моля. C в образце. Сколько это граммов С?
Сколько это граммов С?
\[ (0,0128 \; \отменить{моль\;С}) \влево(\dfrac{12,011\;г\;С}{1\;\отменить{моль\;С}}\справа)=0,154\ ; грамм \; С \номер\]
Как насчет водорода?
\[ (0,306 \; \cancel{g\; H_2O}) \left( \dfrac{1\; моль \; H_2O}{18,0\; \cancel{g \;H_2O}}\right)=0,017\ ; моль \; H_2O \nonumber \]
Поскольку один моль H 2 O состоит из одного моля кислорода и двух молей водорода, если у нас есть 0,017 моль H 2 O, то мы имеем 2 *(0,017) = 0,034 моля водорода. Так как водород составляет около 1 г/моль, мы должны иметь 0,034 грамма водорода в нашем исходном образце.
Когда мы сложим углерод и водород, мы получим:
0,154 грамма (C) + 0,034 грамма (H) = 0,188 грамма
Но мы знаем, что сожгли 0,255 грамма изопропилового спирта. «Недостающая» масса должна быть от атомов кислорода в изопропиловом спирте:
0,255 грамма — 0,188 грамма = 0,067 грамма кислорода
Это количество кислорода сколько молей?
\[ (0,067 \; \cancel{g\; O}) \left( \dfrac{1\; моль \; O}{15,994\; \cancel{g \;O}}\right)=0,0042\ ; моль \; О \номер\]
Таким образом, в целом имеем:
- 0,0128 моль углерода
- 0,0340 моль водорода
- 0,0042 моль кислорода
Разделите на наименьшее молярное количество для нормализации:
- C = 3,05 атома
- Н = 8,1 атома
- О = 1 атом
В пределах ошибки эксперимента наиболее вероятной эмпирической формулой для пропанола будет \(C_3H_8O\)
Пример \(\PageIndex{4}\): Горение нафалена
Нафталин, активный ингредиент одной из разновидностей нафталина, представляет собой органическое соединение, содержащее только углерод и водород. При полном сгорании навески нафталина массой 20,10 мг в кислороде образовалось 69,00 мг СО 2 и 11,30 мг Н 2 О. Определите эмпирическую формулу нафталина.
При полном сгорании навески нафталина массой 20,10 мг в кислороде образовалось 69,00 мг СО 2 и 11,30 мг Н 2 О. Определите эмпирическую формулу нафталина.
Дано : масса образца и масса продуктов сгорания
Запрошено : эмпирическая формула
Стратегия :
- Используйте массы и молярные массы продуктов сгорания, CO 2 и H 2 O, для расчета масс углерода и водорода, присутствующих в исходном образце нафталина.
- Используйте эти массы и молярные массы элементов для расчета эмпирической формулы нафталина.
Раствор :
A При сгорании на каждый моль атомов углерода в исходном образце образуется 1 моль \(\ce{CO2}\). Аналогично, 1 моль H 2 О образуется на каждые 2 моля атомов водорода, присутствующих в образце. Массы углерода и водорода в исходном образце могут быть рассчитаны из этих отношений, масс CO 2 и H 2 O и их молярных масс. Поскольку единицами молярной массы являются граммы на моль, мы должны сначала преобразовать массы из миллиграммов в граммы:
Поскольку единицами молярной массы являются граммы на моль, мы должны сначала преобразовать массы из миллиграммов в граммы:
\[ масса \, из \, C = 69,00 \, мг \, CO_2 \times {1 \, g \over 1000 \, мг } \раз {1 \, моль \, СО_2 \свыше 44,010 \, г \, СО_2} \раз {1 \, моль С \свыше 1 \, моль \, СО_2 } \раз {12,011 \,г \над 1 \, моль \, C} \номер\] 9{−3}}= 1,250 \номер \]
Таким образом, нафталин содержит отношение молей углерода к молям водорода 1,25:1: C 1,25 H 1,0 . Поскольку отношения элементов в эмпирической формуле должны быть выражены в виде небольших целых чисел, умножьте оба нижних индекса на 4, что дает C 5 H 4 как эмпирическую формулу нафталина. На самом деле химическая формула нафталина C 10 H 8 , что согласуется с нашими результатами.
Упражнение \(\PageIndex{4}\)
- Ксилол, органическое соединение, которое является основным компонентом многих бензиновых смесей, содержит только углерод и водород.
 При полном сгорании навески ксилола массой 17,12 мг в кислороде образовалось 56,77 мг СО 2 и 14,53 мг Н 2 О. Определите эмпирическую формулу ксилола.
При полном сгорании навески ксилола массой 17,12 мг в кислороде образовалось 56,77 мг СО 2 и 14,53 мг Н 2 О. Определите эмпирическую формулу ксилола. - Эмпирическая формула бензола — CH (его химическая формула — C 6 H 6 ). Если анализировать сжигание 10,00 мг бензола, какая масса СО 2 и H 2 O будут производиться?
- Ответить на
Эмпирическая формула C 4 H 5 . (Химическая формула ксилола на самом деле C 8 H 10 .)
- Ответ б
33,81 мг CO 2 ; 6,92 мг H 2 O
Анализ горения: Анализ горения, YouTube(opens in new window) [youtu.be]
Авторы и ссылки
Майк Блабер (Университет штата Флорида)
3.




 Это ускорит расчеты и уменьшит опечатки.
Это ускорит расчеты и уменьшит опечатки. Плотность раствора 1,05 г/мл. Если вам нужно 1,7 г HCl для реакции, какой объем этого раствора вы будете использовать?
Плотность раствора 1,05 г/мл. Если вам нужно 1,7 г HCl для реакции, какой объем этого раствора вы будете использовать? Принципы и современное применение. девятый. Нью-Джерси: Peason Eduation, 2007.
Принципы и современное применение. девятый. Нью-Джерси: Peason Eduation, 2007. При полном сгорании навески ксилола массой 17,12 мг в кислороде образовалось 56,77 мг СО 2 и 14,53 мг Н 2 О. Определите эмпирическую формулу ксилола.
При полном сгорании навески ксилола массой 17,12 мг в кислороде образовалось 56,77 мг СО 2 и 14,53 мг Н 2 О. Определите эмпирическую формулу ксилола.